Kryształ różni się od amorficznego ciała stałego. Ciała krystaliczne i amorficzne: budowa i właściwości. Numer koordynacyjny c.n.
Ciała stałe to ciała krystaliczne i amorficzne. Kryształ – tak w starożytności nazywano lód. A potem zaczęto nazywać kwarc kryształem i uważać te minerały za skamieniały lód. Kryształy są materiałem naturalnym i znajdują zastosowanie w przemyśle jubilerskim, optyce, radiotechnice i elektronice, jako podpory elementów w ultraprecyzyjnych instrumentach, jako ultratwardy materiał ścierny.
Ciała krystaliczne charakteryzują się twardością i mają ściśle regularne położenie w przestrzeni cząsteczek, jonów czy atomów, w wyniku czego powstaje trójwymiarowa okresowa sieć krystaliczna (struktura). Na zewnątrz wyraża się to pewną symetrią kształtu ciała stałego i jego pewnymi właściwościami fizycznymi. W swojej zewnętrznej formie ciała krystaliczne odzwierciedlają symetrię właściwą wewnętrznemu „upakowaniu” cząstek. Określa to równość kątów między ścianami wszystkich kryształów składających się z tej samej substancji.
W nich odległości od środka do środka między sąsiednimi atomami również będą równe (jeśli znajdują się na tej samej linii prostej, to odległość ta będzie taka sama na całej długości linii). Ale dla atomów leżących na linii prostej o innym kierunku odległość między środkami atomów będzie inna. Ta okoliczność wyjaśnia anizotropię. Anizotropia jest główną różnicą między ciałami krystalicznymi i amorficznymi.

Ponad 90% ciał stałych można sklasyfikować jako kryształy. W naturze występują w postaci monokryształów i polikryształów. Monokryształy to monokryształy, których ściany są reprezentowane przez wielokąty foremne; Charakteryzują się obecnością ciągłej sieci krystalicznej i anizotropią właściwości fizycznych.
Polikryształy to ciała składające się z wielu małych kryształów, „rosnących razem” nieco chaotycznie. Polikryształy to metale, cukier, kamienie, piasek. W takich ciałach (na przykład fragmencie metalu) anizotropia zwykle nie pojawia się ze względu na przypadkowe ułożenie pierwiastków, chociaż anizotropia jest charakterystyczna dla pojedynczego kryształu tego ciała.
Inne właściwości ciał krystalicznych: ściśle określona temperatura (obecność punktów krytycznych), wytrzymałość, elastyczność, przewodność elektryczna, przewodność magnetyczna, przewodność cieplna.

Amorficzny - nie mający kształtu. Tak to słowo jest dosłownie przetłumaczone z języka greckiego. Ciała amorficzne są tworzone przez naturę. Na przykład bursztyn, wosk.Człowiek zajmuje się tworzeniem sztucznych ciał amorficznych - szkła i żywic (sztucznych), parafiny, tworzyw sztucznych (polimerów), kalafonii, naftalenu, var. nie mają ze względu na chaotyczny układ cząsteczek (atomów, jonów) w strukturze ciała. Dlatego dla każdego ciała amorficznego są one izotropowe - takie same we wszystkich kierunkach. W przypadku ciał amorficznych nie ma krytycznej temperatury topnienia, pod wpływem ogrzewania stopniowo miękną i zamieniają się w lepkie ciecze. Ciała amorficzne mają przypisaną pozycję pośrednią (przejściową) pomiędzy cieczami a ciałami krystalicznymi: w niskich temperaturach twardnieją i stają się elastyczne, ponadto pod wpływem uderzenia mogą rozpaść się na bezkształtne kawałki. W wysokich temperaturach te same pierwiastki wykazują plastyczność, stając się lepkimi cieczami.
Teraz wiesz, czym są ciała krystaliczne!
Wyślij swoją dobrą pracę do bazy wiedzy jest prosta. Skorzystaj z poniższego formularza
Studenci, doktoranci, młodzi naukowcy, którzy wykorzystują bazę wiedzy w swoich studiach i pracy, będą Państwu bardzo wdzięczni.
Opublikowano na http://www.allbest.ru/
Wstęp
Rozdział 1. Ciała krystaliczne i amorficzne
1.1 Idealne kryształy
1.2 Monokryształy i agregaty krystaliczne
1.3 Polikryształy
Rozdział 2. Elementy symetrii kryształów
Rozdział 3. Rodzaje defektów ciał stałych
3.1 Wady punktowe
3.2 Defekty liniowe
3.3 Wady powierzchni
3.4 Wady objętościowe
Rozdział 4. Zdobywanie kryształów
Rozdział 5. Właściwości kryształów
Wniosek
Bibliografia
Wstęp
Kryształy to jeden z najpiękniejszych i najbardziej tajemniczych tworów natury. Obecnie nauka krystalografii bada różnorodność kryształów. W tej różnorodności odkrywa oznaki jedności, bada właściwości i strukturę zarówno monokryształów, jak i agregatów krystalicznych. Krystalografia jest nauką zajmującą się kompleksowym badaniem materii krystalicznej. Praca ta poświęcona jest także kryształom i ich właściwościom.
Obecnie kryształy są szeroko stosowane w nauce i technologii, ponieważ mają szczególne właściwości. Takie obszary zastosowań kryształów jak półprzewodniki, nadprzewodniki, elektronika kwantowa i wiele innych wymagają głębokiego zrozumienia zależności właściwości fizycznych kryształów od ich składu chemicznego i struktury.
Obecnie znane są metody sztucznego hodowania kryształów. Kryształ można hodować w zwykłym szkle, wymaga to jedynie odpowiedniego rozwiązania i troski, z jaką należy dbać o rosnący kryształ.
W przyrodzie istnieje ogromna różnorodność kryształów i istnieje również wiele różnych form kryształów. W rzeczywistości prawie niemożliwe jest podanie definicji, która miałaby zastosowanie do wszystkich kryształów. Pomocne mogą być tutaj wyniki analizy rentgenowskiej kryształów. Promienie rentgenowskie pozwalają wyczuć atomy wewnątrz ciała krystalicznego i określić ich położenie przestrzenne. W rezultacie stwierdzono, że absolutnie wszystkie kryształy zbudowane są z cząstek elementarnych ułożonych w ściśle określonym porządku wewnątrz ciała krystalicznego.
We wszystkich bez wyjątku strukturach krystalicznych wiele identycznych atomów można odróżnić od atomów, umiejscowionych jak węzły sieci przestrzennej. Aby wyobrazić sobie taką siatkę, wypełnijmy w myślach przestrzeń wieloma równymi równoległościanami, zorientowanymi równolegle i stykającymi się całymi ścianami. Najprostszym przykładem takiego budynku jest mur z identycznych cegieł. Jeśli wybierzemy odpowiednie punkty wewnątrz cegieł, na przykład ich środki lub wierzchołki, to otrzymamy model siatki przestrzennej. Wszystkie ciała krystaliczne bez wyjątku charakteryzują się strukturą sieciową.
Kryształy nazywane są „ wszelkie ciała stałe, w których cząstki składowe (atomy, jony, cząsteczki) są ułożone ściśle regularnie, jak węzły sieci przestrzennych Ta definicja jest jak najbliższa prawdy, nadaje się do wszelkich jednorodnych ciał krystalicznych: kul (forma kryształu, który nie ma ścian, krawędzi, wystających wierzchołków) oraz ziaren i figur o płaskich twarzach.
Rozdział 1.Ciała krystaliczne i amorficzne
W oparciu o właściwości fizyczne i strukturę molekularną ciała stałe dzielą się na dwie klasy – ciała amorficzne i ciała krystaliczne.
Cechą charakterystyczną ciał amorficznych jest ich izotropia, tj. niezależność wszystkich właściwości fizycznych (mechanicznych, optycznych itp.) od kierunku. Cząsteczki i atomy w izotropowych ciałach stałych są rozmieszczone losowo, tworząc jedynie małe lokalne grupy zawierające kilka cząstek (porządek krótkiego zasięgu). W swojej strukturze ciała amorficzne są bardzo zbliżone do cieczy.
Przykładami ciał amorficznych są szkło, różne utwardzone żywice (bursztyn), tworzywa sztuczne itp. Jeśli ciało amorficzne zostanie podgrzane, stopniowo mięknie, a przejście w stan ciekły zajmuje znaczny zakres temperatur.
W ciałach krystalicznych cząsteczki ułożone są w ścisłym porządku, tworząc przestrzenne, okresowo powtarzające się struktury w całej objętości ciała. Aby wizualnie przedstawić takie struktury, przestrzenne sieci krystaliczne, w węzłach, w których znajdują się środki atomów lub cząsteczek danej substancji.
W każdej siatce przestrzennej można wyróżnić element konstrukcyjny o minimalnych rozmiarach, tzw komórka elementarna.
Ryż. 1. Rodzaje sieci krystalicznych: 1 - prosta sieć sześcienna; 2 - siatka sześcienna centrowana na ścianie; 3 - siatka sześcienna skupiona na ciele; 4 - sześciokątna krata
W prostej siatce sześciennej cząstki znajdują się w wierzchołkach sześcianu. W siatce skupionej na ścianie cząstki znajdują się nie tylko na wierzchołkach sześcianu, ale także w środkach każdej jego ścian. W siatce sześciennej skupionej na ciele dodatkowa cząstka znajduje się w środku każdej sześciennej komórki elementarnej.
Należy pamiętać, że cząstki w kryształach są ściśle upakowane, tak aby odległość między ich środkami była w przybliżeniu równa wielkości cząstek. Na obrazie sieci krystalicznych wskazane jest jedynie położenie środków cząstek.
1. 1 Doskonałe kryształy
Prawidłowy kształt geometryczny kryształów zwracał uwagę badaczy już na wczesnych etapach rozwoju krystalografii i dał podstawę do powstania pewnych hipotez na temat ich wewnętrznej budowy.
Jeśli weźmiemy pod uwagę kryształ idealny, nie znajdziemy w nim żadnych naruszeń, wszystkie identyczne cząstki znajdują się w identycznych równoległych rzędach. Jeśli zastosujemy trzy elementarne translacje, które nie leżą w tej samej płaszczyźnie, do dowolnego punktu i powtórzymy to w przestrzeni w nieskończoność, otrzymamy siatkę przestrzenną, tj. trójwymiarowy układ równoważnych węzłów. Zatem w idealnym krysztale układ cząstek materiału charakteryzuje się ścisłą trójwymiarową okresowością. Aby uzyskać jasne wyobrażenie o wzorach związanych z geometrycznie poprawną wewnętrzną strukturą kryształów, na zajęciach laboratoryjnych z krystalografii zwykle wykorzystuje się modele idealnie uformowanych kryształów w postaci wypukłych wielościanów o płaskich powierzchniach i prostych krawędziach. W rzeczywistości ściany prawdziwych kryształów nie są idealnie płaskie, ponieważ w miarę wzrostu pokrywają się guzkami, nierównościami, rowkami, zagłębieniami wzrostowymi, sąsiadującymi (ścianami, które odbiegają całkowicie lub częściowo od ich idealnej pozycji), spiralami wzrostu lub rozpuszczania, itp. .
Idealny kryształ- jest to model fizyczny, będący nieskończonym monokryształem niezawierającym zanieczyszczeń ani wad strukturalnych. Różnica między kryształami rzeczywistymi a kryształami idealnymi wynika ze skończoności ich rozmiarów i obecności defektów. Występowania niektórych defektów (na przykład zanieczyszczeń, granic międzykrystalicznych) w prawdziwych kryształach można prawie całkowicie uniknąć, stosując specjalne metody wzrostu, wyżarzania lub oczyszczania. Jednakże w temperaturze T>0K kryształy zawsze mają skończoną koncentrację (aktywowanych termicznie) wakatów i atomów śródmiąższowych, których liczba w równowadze maleje wykładniczo wraz ze spadkiem temperatury.
Substancje krystaliczne mogą występować w postaci monokryształów lub próbek polikrystalicznych.
Monokryształ to ciało stałe, w którym regularna struktura pokrywa całą objętość substancji. Pojedyncze kryształy występują w przyrodzie (kwarc, diament, szmaragd) lub są wytwarzane sztucznie (rubin).
Próbki polikrystaliczne składają się z dużej liczby małych, losowo zorientowanych kryształów o różnych rozmiarach, które mogą być połączone ze sobą pewnymi siłami interakcji.
1. 2 Monokryształstopy i kruszywa krystaliczne
Monokryształ- oddzielny jednorodny kryształ, który ma ciągłą sieć krystaliczną i czasami ma anizotropię właściwości fizycznych. O zewnętrznym kształcie monokryształu decyduje jego atomowa sieć krystaliczna oraz warunki (głównie szybkość i jednorodność) krystalizacji. Wolno rosnący monokryształ prawie zawsze uzyskuje dobrze zdefiniowany naturalny krój; w nierównowagowych warunkach krystalizacji (średnie tempo wzrostu) cięcie wydaje się słabe. Przy jeszcze większej szybkości krystalizacji zamiast pojedynczego kryształu tworzą się jednorodne polikryształy i agregaty polikrystaliczne, składające się z wielu różnie zorientowanych małych monokryształów. Przykłady fasetowanych naturalnych monokryształów obejmują monokryształy kwarcu, soli kamiennej, drzewca islandzkiego, diamentu i topazu. Monokryształy materiałów półprzewodnikowych i dielektrycznych hodowane w specjalnych warunkach mają ogromne znaczenie przemysłowe. W szczególności monokryształy krzemu i sztuczne stopy pierwiastków grupy III (trzeciej) z pierwiastkami grupy V (piątej) układu okresowego (na przykład arsenek galu GaAs) są podstawą współczesnej elektroniki półprzewodnikowej. Monokryształy metali i ich stopów nie mają specjalnych właściwości i praktycznie nie są stosowane. Monokryształy substancji ultraczystych mają takie same właściwości niezależnie od sposobu ich przygotowania. Krystalizacja zachodzi w pobliżu temperatury topnienia (kondensacja) z gazów (na przykład szronu i płatków śniegu), cieczy (najczęściej) i stałego stanu amorficznego z wydzieleniem ciepła. Krystalizacja z gazu lub cieczy ma potężny mechanizm oczyszczający: skład chemiczny wolno rosnących monokryształów jest prawie idealny. Prawie wszystkie zanieczyszczenia pozostają (kumulują się) w cieczy lub gazie. Dzieje się tak, ponieważ w miarę wzrostu sieci krystalicznej następuje spontaniczna selekcja wymaganych atomów (cząsteczek do kryształów molekularnych) nie tylko według ich właściwości chemicznych (wartościowości), ale także według wielkości.
Współczesnej technologii nie brakuje już ograniczonego zestawu właściwości naturalnych kryształów (szczególnie do tworzenia laserów półprzewodnikowych), a naukowcy opracowali metodę tworzenia substancji krystalopodobnych o właściwościach pośrednich poprzez hodowlę naprzemiennych ultracienkich warstw kryształów o podobnym krysztale parametry sieci.
W przeciwieństwie do innych stanów agregacji, stan krystaliczny jest zróżnicowany. Cząsteczki o tym samym składzie można pakować w kryształy na różne sposoby. Właściwości fizyczne i chemiczne substancji zależą od sposobu pakowania. Zatem substancje o tym samym składzie chemicznym często w rzeczywistości mają różne właściwości fizyczne. Taka różnorodność nie jest typowa dla stanu ciekłego, ale niemożliwa dla stanu gazowego.
Jeśli weźmiemy na przykład zwykłą sól kuchenną, łatwo będzie zobaczyć poszczególne kryształy nawet bez mikroskopu.
Jeśli chcemy podkreślić, że mamy do czynienia z pojedynczym, odrębnym kryształem, to nazywamy to pojedynczy kryształ, aby podkreślić, że mówimy o nagromadzeniu wielu kryształów, używa się tego terminu agregat krystaliczny. Jeżeli poszczególne kryształy agregatu krystalicznego prawie nie są fasetowane, można to wytłumaczyć faktem, że krystalizacja rozpoczęła się jednocześnie w wielu punktach substancji i jej prędkość była dość duża. Rosnące kryształy stanowią dla siebie przeszkodę i uniemożliwiają prawidłowe przecięcie każdego z nich.
W tej pracy będziemy mówić głównie o monokryształach, a ponieważ są one składnikami agregatów krystalicznych, to ich właściwości będą zbliżone do właściwości agregatów.
1. 3 Polikryształy
Polikryształ- agregat małych kryształów dowolnej substancji, czasami nazywany krystalitami lub ziarnami kryształów ze względu na ich nieregularny kształt. Wiele materiałów pochodzenia naturalnego i sztucznego (minerały, metale, stopy, ceramika itp.) to materiały polikrystaliczne.
Właściwości i uzyskiwanie. O właściwościach polikryształów decydują właściwości tworzących je ziaren krystalicznych, ich średnia wielkość, która waha się od 1-2 mikronów do kilku milimetrów (w niektórych przypadkach do kilku metrów), orientacja krystalograficzna ziaren oraz struktura granic ziaren. Jeżeli ziarna są zorientowane losowo, a ich rozmiary są małe w porównaniu z rozmiarem polikryształu, to w polikrysztale nie pojawia się anizotropia właściwości fizycznych charakterystycznych dla monokryształów. Jeśli polikryształ ma dominującą orientację krystalograficzną ziaren, to polikryształ jest teksturowany i w tym przypadku ma właściwości anizotropowe. Obecność granic ziaren znacząco wpływa na właściwości fizyczne, zwłaszcza mechaniczne polikryształów, gdyż na granicach następuje rozpraszanie elektronów przewodzących, fononów, hamowanie dyslokacji itp.
Polikryształy powstają podczas krystalizacji, przemian polimorficznych oraz w wyniku spiekania krystalicznych proszków. Polikryształ jest mniej stabilny niż monokryształ, dlatego podczas długotrwałego wyżarzania polikryształu następuje rekrystalizacja (przeważający wzrost poszczególnych ziaren kosztem innych), prowadząca do powstania dużych bloków krystalicznych.
Rozdział 2. Elementy symetrii kryształów
Pojęcia symetrii i asymetrii pojawiają się w nauce od czasów starożytnych jako kryterium estetyczne, a nie definicje ściśle naukowe. Zanim pojawiła się idea symetrii, matematyka, fizyka i nauki przyrodnicze w ogóle przypominały odrębne wyspy idei, teorii i praw, które były beznadziejnie od siebie odizolowane, a nawet sprzeczne. Symetria charakteryzuje i wyznacza erę syntezy, kiedy odmienne fragmenty wiedzy naukowej łączą się w jeden, holistyczny obraz świata. Jednym z głównych nurtów tego procesu jest matematyzacja wiedzy naukowej.
Symetria jest zwykle uważana nie tylko za podstawowy obraz wiedzy naukowej, ustanawiający wewnętrzne powiązania między systemami, teoriami, prawami i pojęciami, ale także przypisuje ją atrybutom tak podstawowym, jak przestrzeń i czas, ruch. W tym sensie symetria określa strukturę świata materialnego i wszystkich jego składników. Symetria ma charakter wieloaspektowy i wielopoziomowy. Na przykład w systemie wiedzy fizycznej symetrię rozważa się na poziomie zjawisk, praw opisujących te zjawiska i zasad leżących u podstaw tych praw, a w matematyce - przy opisie obiektów geometrycznych. Symetrię można sklasyfikować jako:
· konstrukcyjny;
· geometryczny;
· dynamiczny, opisujący odpowiednio krystalografię,
matematyczne i fizyczne aspekty tej koncepcji.
Najprostsze symetrie można przedstawić geometrycznie w naszej zwykłej trójwymiarowej przestrzeni i dlatego są wizualne. Symetrie takie kojarzone są z operacjami geometrycznymi, które powodują zbieżność danego ciała z samym sobą. Mówią, że symetria objawia się niezmiennością (niezmienniczością) ciała lub układu w stosunku do określonej operacji. Na przykład kula (bez żadnych śladów na powierzchni) jest niezmienna przy każdym obrocie. To pokazuje jego symetrię. Kula ze znakiem, na przykład w postaci punktu, pokrywa się ze sobą tylko po obróceniu, po czym znak na niej powraca do pierwotnej pozycji. Nasza trójwymiarowa przestrzeń jest izotropowa. Oznacza to, że niczym kula bez śladów, pokrywa się ze sobą przy każdym obrocie. Przestrzeń jest nierozerwalnie związana z materią. Dlatego nasz Wszechświat jest również izotropowy. Przestrzeń jest również jednorodna. Oznacza to, że on (i nasz Wszechświat) ma symetrię w odniesieniu do operacji przesunięcia. Czas ma tę samą symetrię.
Oprócz prostych (geometrycznych) symetrii, w fizyce powszechnie spotyka się bardzo złożone, tzw. symetrie dynamiczne, czyli symetrie związane nie z przestrzenią i czasem, ale z pewnym rodzajem interakcji. Nie są wizualne, a nawet najprostsze z nich, np. tzw symetrie miernika, trudno to wyjaśnić bez użycia dość złożonej teorii fizycznej. Niektóre prawa zachowania odpowiadają również symetrii cechowania w fizyce. Na przykład symetria cechowania potencjałów elektromagnetycznych prowadzi do prawa zachowania ładunku elektrycznego.
W toku praktyki społecznej ludzkość zgromadziła wiele faktów wskazujących zarówno na ścisły porządek, równowagę pomiędzy częściami całości, jak i na naruszenia tego porządku. Pod tym względem można wyróżnić pięć następujących kategorii symetrii:
· symetria;
· asymetria;
· dysymetria;
· antysymetria;
· supersymetria.
Asymetria . Asymetria to asymetria, tj. stan, w którym nie ma symetrii. Ale Kant powiedział też, że negacja nigdy nie jest prostym wyjątkiem lub brakiem odpowiedniej treści pozytywnej. Na przykład ruch jest zaprzeczeniem poprzedniego stanu, zmianą obiektu. Ruch zaprzecza odpoczynkowi, ale odpoczynek nie jest brakiem ruchu, ponieważ informacji jest bardzo mało i są one błędne. Nie ma braku odpoczynku, tak jak nie ma ruchu, ponieważ są to dwie strony tej samej istoty. Odpoczynek to kolejny aspekt ruchu.
Nie ma też całkowitego braku symetrii. Figurę, która nie ma elementu symetrii, nazywa się asymetryczną. Ale ściśle rzecz biorąc, tak nie jest. W przypadku figur asymetrycznych po prostu kończy się zaburzenie symetrii, ale nie do całkowitego braku symetrii, ponieważ figury te nadal charakteryzują się nieskończoną liczbą osi pierwszego rzędu, które są również elementami symetrii.
Asymetria wiąże się z brakiem wszystkich elementów symetrii w obiekcie. Taki element jest niepodzielny na części. Przykładem jest ludzka ręka. Asymetria to kategoria przeciwna symetrii, która odzwierciedla brak równowagi istniejącej w obiektywnym świecie, związany ze zmianą, rozwojem i restrukturyzacją części całości. Tak jak mówimy o ruchu, czyli o jedności ruchu i spoczynku, tak symetria i asymetria to dwa biegunowe przeciwieństwa obiektywnego świata. W prawdziwej naturze nie ma czystej symetrii i asymetrii. Zawsze są w jedności i nieustannej walce.
Na różnych poziomach rozwoju materii występuje albo symetria (porządek względny), albo asymetria (tendencja do zakłócania spokoju, ruchu, rozwoju), jednak te dwie tendencje są zawsze zjednoczone, a ich walka jest absolutna. Prawdziwym, nawet najdoskonalszym kryształom daleko do kryształów o idealnym kształcie i idealnej symetrii uwzględnianej w krystalografii w swojej budowie. Zawierają znaczne odchylenia od idealnej symetrii. Mają także elementy asymetrii: dyslokacje, wakaty, które wpływają na ich właściwości fizyczne.
Definicje symetrii i asymetrii wskazują na uniwersalny, ogólny charakter symetrii i asymetrii jako właściwości świata materialnego. Analiza pojęcia symetrii w fizyce i matematyce (z nielicznymi wyjątkami) zmierza do absolutyzacji symetrii i interpretowania asymetrii jako braku symetrii i porządku. Antypoda symetrii jawi się jako koncepcja czysto negatywna, ale warta uwagi. Duże zainteresowanie asymetrią pojawiło się w połowie XIX wieku w związku z eksperymentami L. Pasteura w zakresie badania i rozdzielania stereoizomerów.
Asymetria . Dysymetria to symetria wewnętrzna lub zaburzona, tj. obiektowi brakuje pewnych elementów symetrii. Na przykład rzeki płynące wzdłuż południków Ziemi mają jeden brzeg wyższy od drugiego (na półkuli północnej prawy brzeg jest wyższy od lewego, a na półkuli południowej odwrotnie). Według Pasteura figura asymetryczna to taka, której nie da się połączyć z jej lustrzanym odbiciem poprzez prostą superpozycję. Stopień symetrii obiektu asymetrycznego może być dowolnie wysoki. Dysymetrię w najszerszym znaczeniu można zdefiniować jako dowolną formę przybliżenia obiektu nieskończenie symetrycznego do obiektu nieskończenie asymetrycznego.
Antysymetria . Antysymetria nazywana jest symetrią przeciwną lub symetrią przeciwieństw. Wiąże się to ze zmianą znaku figury: cząstki - antycząstki, wypukłość - wklęsłość, czerń - biel, napięcie - ściskanie, przód - tył itp. Koncepcję tę można wyjaśnić na przykładzie dwóch par czarno-białych rękawiczek. Jeśli z kawałka skóry uszyte zostaną dwie pary czarno-białych rękawiczek, których dwie strony są pomalowane odpowiednio na biało i czarno, wówczas można je rozróżnić na podstawie prawicowości - lewicowości, koloru - czerni i bieli, w innymi słowy, w oparciu o informatyzm znakowy i jakiś inny znak. Operacja antysymetrii składa się ze zwykłych operacji symetrii, którym towarzyszy zmiana drugiego atrybutu figury.
Supersymetria W ostatnich dekadach XX wieku zaczął się rozwijać model supersymetrii, który zaproponowali rosyjscy teoretycy Gelfand i Lichtman. Mówiąc najprościej, ich pomysł był taki, że tak jak istnieją zwykłe wymiary przestrzeni i czasu, muszą istnieć dodatkowe wymiary, które można zmierzyć za pomocą tak zwanych liczb Grassmanna. Jak powiedział S. Hawking, nawet pisarze science fiction nie wymyślili niczego tak dziwnego jak wymiary Grassmanna. W naszej zwykłej arytmetyce, jeśli liczba 4 pomnożona przez 6 jest taka sama, jak 6 pomnożona przez 4. Ale dziwną rzeczą w liczbach Grassmanna jest to, że jeśli X pomnoży się przez Y, to będzie równe minus Y pomnożone przez X. Czujesz, że Jak dalekie jest to od naszych klasycznych wyobrażeń o naturze i sposobach jej opisu?
Symetrię można również rozpatrywać za pomocą form ruchu lub tak zwanych operacji symetrii. Można wyróżnić następujące operacje symetrii:
· odbicie w płaszczyźnie symetrii (odbicie w lustrze);
obrót wokół osi symetrii ( symetria obrotowa);
· odbicie w środku symetrii (inwersja);
przenosić ( audycja) postacie w oddali;
· obroty śruby;
· symetria permutacyjna.
Odbicie w płaszczyźnie symetrii . Odbicie jest najbardziej znanym i najczęściej spotykanym typem symetrii w przyrodzie. Lustro odtwarza dokładnie to, co „widzi”, ale rozpatrywana kolejność jest odwrotna: prawa ręka twojego sobowtóra będzie w rzeczywistości jego lewą ręką, ponieważ palce są ułożone w odwrotnej kolejności. Chyba każdy zna z dzieciństwa film „Królestwo krzywych luster”, w którym imiona wszystkich bohaterów czytano w odwrotnej kolejności. Lustrzaną symetrię można odnaleźć wszędzie: w liściach i kwiatach roślin, architekturze, ozdobach. Ciało ludzkie, jeśli mówimy tylko o jego wyglądzie, ma symetrię lustrzaną, choć nie do końca ścisłą. Co więcej, lustrzana symetria jest nieodłączną częścią ciał prawie wszystkich żywych stworzeń, a taki zbieg okoliczności nie jest bynajmniej przypadkowy. Trudno przecenić znaczenie koncepcji symetrii lustrzanej.
Wszystko, co można podzielić na dwie lustrzane połowy, ma lustrzaną symetrię. Każda z połówek jest lustrzanym odbiciem drugiej, a oddzielająca je płaszczyzna nazywana jest płaszczyzną lustrzanego odbicia, lub po prostu płaszczyzną lustra. Płaszczyznę tę można nazwać elementem symetrii, a odpowiadającą jej operację można nazwać operacją symetrii . Na co dzień spotykamy się z trójwymiarowymi symetrycznymi wzorami: jest to wiele nowoczesnych budynków mieszkalnych, a czasem całe bloki, pudła i pudła piętrzące się w magazynach; atomy substancji w stanie krystalicznym tworzą sieć krystaliczną – element trójwymiarowości symetria. We wszystkich tych przypadkach właściwa lokalizacja pozwala na ekonomiczne wykorzystanie przestrzeni i zapewnia stabilność.
Niezwykłym przykładem lustrzanej symetrii w literaturze jest zdanie „odmienny”: „I róża spadła na łapę Azora”. . W tej linii środkiem lustrzanej symetrii jest litera „n”, względem której wszystkie pozostałe litery (nie biorąc pod uwagę odstępów między wyrazami) znajdują się w wzajemnie przeciwnej kolejności.
Symetria obrotowa . Wygląd wzoru nie zmieni się, jeśli zostanie obrócony o określony kąt wokół własnej osi. Symetria powstająca w tym przypadku nazywana jest symetrią obrotową . Przykładem jest gra dla dzieci „Wiatraczek” z symetrią obrotową. W wielu tańcach figury opierają się na ruchach obrotowych, często wykonywanych tylko w jednym kierunku (tj. bez odbicia), np. tańce okrągłe.
Liście i kwiaty wielu roślin wykazują symetrię promieniową. Jest to symetria, w której liść lub kwiat, obracając się wokół osi symetrii, zamienia się w siebie. Na przekrojach tkanek tworzących korzeń lub łodygę rośliny wyraźnie widoczna jest symetria promieniowa. Kwiatostany wielu kwiatów mają również symetrię promieniową.
Odbicie w środku symetrii . Przykładem obiektu o największej symetrii, charakteryzującego się tą operacją symetrii, jest kula. Formy kuliste są dość powszechne w przyrodzie. Występują powszechnie w atmosferze (kropelki mgły, chmury), hydrosferze (różne mikroorganizmy), litosferze i przestrzeni kosmicznej. Zarodniki i pyłki roślin, krople wody uwalniane w stanie nieważkości na statku kosmicznym mają kształt kulisty. Na poziomie metagalaktycznym największymi strukturami kulistymi są galaktyki sferyczne. Im gęstsza gromada galaktyk, tym bardziej przypomina ona kształt kulisty. Gromady gwiazd są również kuliste.
Tłumaczenie, czyli przeniesienie figury na odległość . Tłumaczenie, czyli równoległe przeniesienie figury na odległość, to dowolny, nieograniczony, powtarzalny wzór. Może być jednowymiarowy, dwuwymiarowy, trójwymiarowy. Tłumaczenie w tych samych lub przeciwnych kierunkach tworzy jednowymiarowy wzór. Tłumaczenie w dwóch nierównoległych kierunkach tworzy dwuwymiarowy wzór. Parkiety, wzory tapet, koronkowe wstążki, ścieżki wyłożone cegłami lub płytkami, krystaliczne figury tworzą wzory, które nie mają naturalnych granic. Badając wzory stosowane w druku książek, odkryto te same elementy symetrii, co w projektowaniu podłóg wyłożonych kafelkami. Ozdobne obramowania kojarzą się z muzyką. W muzyce elementami konstrukcji symetrycznej są operacje powtórzenia (przekładu) i odwrócenia (odbicia). To właśnie te elementy symetrii znajdują się w granicach. Chociaż większość muzyki nie jest ściśle symetryczna, wiele utworów muzycznych opiera się na operacjach symetrii. Są one szczególnie widoczne w piosenkach dla dzieci, które najwyraźniej są tak łatwe do zapamiętania. Operacje symetrii spotykamy w muzyce średniowiecza i renesansu, w muzyce epoki baroku (często w bardzo wyrafinowanej formie). W czasach I.S. Bacha, gdy symetria była ważną zasadą kompozycji, rozpowszechnił się rodzaj muzycznej gry logicznej. Jednym z nich było rozwiązanie tajemniczych „kanonów”. Kanon to forma muzyki polifonicznej polegająca na realizacji tematu prowadzonego przez jeden głos w innych głosach. Kompozytor proponował temat, a słuchacze musieli odgadnąć działania symetrii, jakie zamierzał zastosować przy powtarzaniu tematu.
Natura zadaje zagadki odwrotnego typu: otrzymujemy gotowy kanon i musimy odnaleźć zasady i motywy leżące u podstaw istniejących wzorów i symetrii i odwrotnie, szukać wzorców, które powstają podczas powtarzania motywu według różnych zasad. Pierwsze podejście prowadzi do badania struktury materii, sztuki, muzyki i myślenia. Drugie podejście konfrontuje nas z problemem projektu czy planu, który zajmuje artystów, architektów, muzyków i naukowców od czasów starożytnych.
Skrętne zakręty . Tłumaczenie można połączyć z odbiciem lub obrotem, co tworzy nowe operacje symetrii. Obrót o określoną liczbę stopni, któremu towarzyszy przesunięcie na odległość wzdłuż osi obrotu, generuje symetrię helikalną – symetrię schodów kręconych. Przykładem symetrii spiralnej jest ułożenie liści na łodydze wielu roślin. Główka słonecznika ma pędy ułożone w geometryczne spirale, rozwijające się od środka na zewnątrz. W centrum znajdują się najmłodsi członkowie spirali. W takich układach można zauważyć dwie rodziny spiral, rozwijających się w przeciwnych kierunkach i przecinających się pod kątami zbliżonymi do linii prostych. Ale bez względu na to, jak interesujące i atrakcyjne są przejawy symetrii w świecie roślin, wciąż istnieje wiele tajemnic kontrolujących procesy rozwojowe. Idąc za Goethem, który mówił o tendencji natury do spirali, można założyć, że ruch ten odbywa się po spirali logarytmicznej, każdorazowo zaczynając od centralnego, stałego punktu i łącząc ruch translacyjny (rozciąganie) z obrotem.
Symetria komutacyjna . Dalsze rozszerzanie liczby symetrii fizycznych wiąże się z rozwojem mechaniki kwantowej. Jednym ze specjalnych typów symetrii w mikrokosmosie jest symetria permutacyjna. Opiera się ona na zasadniczej nierozróżnialności identycznych mikrocząstek, które nie poruszają się po określonych trajektoriach, a ich położenie szacuje się na podstawie cech probabilistycznych związanych z kwadratem modułu funkcji falowej. Symetria komutacyjna polega na tym, że kiedy cząstki kwantowe ulegają „przeorganizowaniu”, charakterystyka probabilistyczna nie ulega zmianie; kwadratowy moduł funkcji falowej jest wartością stałą.
Symetria podobieństwa . Innym rodzajem symetrii jest symetria podobieństwa, związana z jednoczesnym zwiększaniem się lub zmniejszaniem podobnych części figury oraz odległości między nimi. Przykładem tego rodzaju symetrii jest lalka Matrioszka. Taka symetria jest bardzo rozpowszechniona w żywej przyrodzie. Wykazują to wszystkie rosnące organizmy.
Zagadnienia symetrii odgrywają decydującą rolę we współczesnej fizyce. Dynamiczne prawa natury charakteryzują się pewnymi typami symetrii. W sensie ogólnym symetria praw fizycznych oznacza ich niezmienność względem pewnych przekształceń. Należy również zauważyć, że rozważane typy symetrii mają pewne ograniczenia stosowalności. Na przykład symetria prawej i lewej strony istnieje tylko w obszarze silnych oddziaływań elektromagnetycznych, ale jest naruszana w słabych. Niezmienniczość izotopowa jest ważna tylko wtedy, gdy uwzględni się siły elektromagnetyczne. Aby zastosować koncepcję symetrii, możesz wprowadzić pewną strukturę, która uwzględnia cztery czynniki:
· badany obiekt lub zjawisko;
· transformacja, w odniesieniu do której uwzględniana jest symetria;
· Niezmienność jakichkolwiek właściwości obiektu lub zjawiska, wyrażająca daną symetrię. Związek symetrii praw fizycznych z prawami zachowania;
· Granice stosowalności różnych typów symetrii.
Badanie właściwości symetrii układów lub praw fizycznych wymaga zastosowania specjalnej analizy matematycznej, przede wszystkim koncepcji teorii grup, która jest obecnie najbardziej rozwinięta w fizyce ciała stałego i krystalografii.
Rozdział 3. Rodzaje defektów ciał stałych
Wszystkie rzeczywiste ciała stałe, zarówno monokrystaliczne, jak i polikrystaliczne, zawierają tzw. defekty strukturalne, których rodzaje, stężenia i zachowanie są bardzo zróżnicowane i zależą od charakteru, warunków otrzymywania materiałów i charakteru wpływów zewnętrznych. Większość defektów powstałych na skutek wpływów zewnętrznych jest niestabilna termodynamicznie, a stan układu w tym przypadku jest wzbudzony (nierównowaga). Takimi wpływami zewnętrznymi mogą być temperatura, ciśnienie, napromienianie cząstkami i kwantami wysokoenergetycznymi, wprowadzenie zanieczyszczeń, utwardzanie fazowe podczas przemian polimorficznych i innych, efekty mechaniczne itp. Przejście do stanu równowagi może odbywać się na różne sposoby i, z reguły realizowany jest poprzez szereg stanów metastabilnych.
Wady tego samego rodzaju, wchodząc w interakcję z wadami tego samego lub innego rodzaju, mogą unicestwiać lub tworzyć nowe zespoły wad. Procesom tym towarzyszy spadek energii układu.
Na podstawie liczby kierunków N, w których przebiega naruszenie okresowego układu atomów w sieci krystalicznej spowodowane danym defektem, wyróżnia się defekty:
· Punkt (zerowymiarowy, N=0);
· Liniowy (jednowymiarowy, N=1);
· Powierzchnia (dwuwymiarowa, N=2);
· Objętość (trójwymiarowa, N=3);
Teraz szczegółowo rozważymy każdą wadę.
3.1 Wady punktowe
Do zerowego wymiaru (lub punkt) defekty kryształów obejmują wszystkie defekty, które są związane z przemieszczeniem lub zastąpieniem małej grupy atomów, a także z zanieczyszczeniami. Powstają podczas ogrzewania, domieszkowania, podczas wzrostu kryształów oraz w wyniku narażenia na promieniowanie. Można je wprowadzić również w wyniku implantacji. Najlepiej zbadano właściwości takich defektów i mechanizmy ich powstawania, w tym ruch, interakcję, anihilację i parowanie.
· Wakat – wolny, niezajęty atom, węzeł sieci krystalicznej.
· Atom śródmiąższowy właściwy – atom pierwiastka głównego znajdujący się w pozycji śródmiąższowej komórki elementarnej.
· Substytucja atomu domieszki – zastąpienie atomu jednego typu atomem innego typu w węźle sieci krystalicznej. Pozycje podstawienia mogą zawierać atomy, które stosunkowo niewiele różnią się rozmiarem i właściwościami elektronicznymi od atomów zasadowych.
· Śródmiąższowy atom domieszki – atom domieszki znajduje się w szczelinach sieci krystalicznej. W metalach zanieczyszczeniami śródmiąższowymi są zwykle wodór, węgiel, azot i tlen. W półprzewodnikach są to zanieczyszczenia, które tworzą głębokie poziomy energii w pasmie wzbronionym, takie jak miedź i złoto w krzemie.
W kryształach często obserwuje się również kompleksy składające się z kilku defektów punktowych, na przykład defekt Frenkla (wakacja + własny atom śródmiąższowy), biwakancja (wakacja + wakat), środek A (wakata + atom tlenu w krzemie i germanie) itp.
Termodynamika defektów punktowych. Defekty punktowe zwiększają energię kryształu, ponieważ na utworzenie każdego defektu zużyto pewną ilość energii. Odkształcenie sprężyste powoduje bardzo małą część energii tworzenia wakatów, ponieważ przemieszczenia jonów nie przekraczają 1%, a odpowiadająca im energia odkształcenia wynosi dziesiąte części eV. Podczas tworzenia atomu śródmiąższowego przemieszczenia sąsiednich jonów mogą osiągnąć 20% odległości międzyatomowej, a odpowiadająca energia odkształcenia sprężystego sieci może osiągnąć kilka eV. Główna część powstawania defektu punktowego wiąże się z naruszeniem okresowości struktury atomowej i sił wiązania między atomami. Wada punktowa metalu oddziałuje z całym gazem elektronowym. Usunięcie jonu dodatniego z miejsca jest równoznaczne z wprowadzeniem punktowego ładunku ujemnego; elektrony przewodnictwa są odpychane od tego ładunku, co powoduje wzrost ich energii. Obliczenia teoretyczne pokazują, że energia powstania wakatu w sieci fcc miedzi wynosi około 1 eV, a atomu śródmiąższowego od 2,5 do 3,5 eV.
Pomimo wzrostu energii kryształów podczas powstawania własnych defektów punktowych, mogą one znajdować się w równowadze termodynamicznej w sieci, ponieważ ich powstawanie prowadzi do wzrostu entropii. W podwyższonych temperaturach wzrost członu entropii TS energii swobodnej w wyniku powstawania defektów punktowych kompensuje wzrost całkowitej energii kryształu U, a energia swobodna okazuje się minimalna.
Równoważna koncentracja wakatów:
Gdzie mi 0 - energia powstania jednego wakatu, k- stała Boltzmanna, T- temperatura absolutna. Ten sam wzór obowiązuje dla atomów śródmiąższowych. Ze wzoru wynika, że koncentracja wolnych miejsc powinna silnie zależeć od temperatury. Wzór do obliczeń jest prosty, ale dokładne wartości ilościowe można uzyskać jedynie znając wartość energetyczną powstania defektu. Teoretycznie bardzo trudno jest obliczyć tę wartość, dlatego należy zadowolić się jedynie przybliżonymi szacunkami.
Ponieważ energia powstania defektu jest zawarta w wykładniku, różnica ta powoduje ogromną różnicę w koncentracji wakatów i atomów śródmiąższowych. Zatem w temperaturze 1000 °C w miedzi stężenie atomów międzywęzłowych wynosi tylko 10–39, czyli o 35 rzędów wielkości mniej niż stężenie wakatów w tej temperaturze. W gęstych upakowaniach, które są charakterystyczne dla większości metali, bardzo trudno jest utworzyć atomy śródmiąższowe, a głównymi defektami punktowymi (nie licząc atomów zanieczyszczeń) w takich kryształach są wakaty.
Migracja defektów punktowych. Atomy podlegające ruchowi wibracyjnemu w sposób ciągły wymieniają energię. Ze względu na losowość ruchu termicznego energia rozkłada się nierównomiernie pomiędzy różnymi atomami. W pewnym momencie atom może otrzymać od sąsiadów taki nadmiar energii, że zajmie sąsiednią pozycję w siatce. W ten sposób następuje migracja (ruch) defektów punktowych w większości kryształów.
Jeśli jeden z atomów otaczających wakat przesunie się na wolne miejsce, wówczas wakat odpowiednio przesunie się na swoje miejsce. Kolejne elementarne akty przemieszczania pewnego wakatu dokonują się za pomocą różnych atomów. Rysunek pokazuje, że w warstwie ciasno upakowanych kulek (atomów), aby jedna z kulek przemieściła się w wolne miejsce, musi odsunąć od siebie kule 1 i 2. W konsekwencji, aby przejść z pozycji w węźle, gdzie energia atomu jest minimalna, do sąsiedniego pustego węzła, gdzie energia jest również minimalna, atom musi przejść przez stan o zwiększonej energii potencjalnej i pokonać barierę energetyczną. W tym celu konieczne jest, aby atom otrzymał od sąsiadów nadmiar energii, którą traci „wciskając” w nowe położenie. Nazywa się wysokość bariery energetycznej E m energia aktywacji migracji wakatów.
Źródła i pochłaniacze defektów punktowych. Głównym źródłem i ujściem defektów punktowych są defekty liniowe i powierzchniowe. W dużych doskonałych monokryształach możliwy jest rozkład przesyconego roztworu stałego własnych defektów punktowych z utworzeniem tzw. mikrodefekty.
Zespoły wad punktowych. Najprostszym zespołem defektów punktowych jest biwakancja (dywakancja): dwa wakaty zlokalizowane w sąsiadujących ze sobą miejscach sieci. Kompleksy składające się z dwóch lub więcej atomów zanieczyszczeń, a także atomów zanieczyszczeń i ich własnych defektów punktowych, odgrywają główną rolę w metalach i półprzewodnikach. W szczególności takie kompleksy mogą znacząco wpływać na wytrzymałość, właściwości elektryczne i optyczne ciał stałych.
3.2 Defekty liniowe
Defekty jednowymiarowe (liniowe) to defekty krystaliczne, których wielkość w jednym kierunku jest znacznie większa od parametru sieci, a w dwóch pozostałych - porównywalna z nim. Do wad liniowych zalicza się dyslokacje i dysklinacje. Ogólna definicja: dyslokacja to granica obszaru niepełnego ścinania w krysztale. Dyslokacje charakteryzują się wektorem ścinania (wektorem Burgersa) i kątem μ pomiędzy nim a linią dyslokacji. Gdy μ = 0, przemieszczenie nazywa się przemieszczeniem śrubowym; przy c=90° - krawędź; pod innymi kątami jest mieszany i można go następnie rozłożyć na składniki śrubowe i krawędziowe. Dyslokacje powstają podczas wzrostu kryształów; podczas jego odkształcenia plastycznego i w wielu innych przypadkach. Ich rozkład i zachowanie pod wpływem czynników zewnętrznych determinują najważniejsze właściwości mechaniczne, w szczególności takie jak wytrzymałość, plastyczność itp. Dysklinacja jest granicą obszaru niepełnego obrotu w krysztale. Charakteryzuje się wektorem rotacji.
3.3 Wady powierzchni
Główną reprezentatywną wadą tej klasy jest powierzchnia kryształu. Innymi przypadkami są granice ziaren materiału, w tym granice o niskim kącie (reprezentujące powiązania dyslokacji), płaszczyzny bliźniacze, powierzchnie fazowe itp.
3.4 Wady objętościowe
Należą do nich skupiska pustych miejsc, które tworzą pory i kanały; cząstki osadzone na różnych defektach (dekoracyjnych), na przykład pęcherzykach gazu, pęcherzykach ługu macierzystego; nagromadzenia zanieczyszczeń w postaci sektorów (klepsydr) i stref wzrostu. Z reguły są to pory lub wtrącenia faz zanieczyszczeń. Są zlepkiem wielu wad. Pochodzenie: zakłócenie reżimu wzrostu kryształów, rozkład przesyconego roztworu stałego, zanieczyszczenie próbek. W niektórych przypadkach (na przykład podczas utwardzania wydzieleniowego) do materiału wprowadza się specjalnie defekty objętościowe, aby zmodyfikować jego właściwości fizyczne.
Rozdział 4. Otrzymaneżadnych kryształów
Rozwój nauki i technologii doprowadził do tego, że wiele kamieni szlachetnych lub po prostu kryształów rzadko spotykanych w przyrodzie stało się bardzo niezbędnych do produkcji części urządzeń i maszyn, do badań naukowych. Zapotrzebowanie na wiele kryształów wzrosło tak bardzo, że nie dało się go zaspokoić poprzez zwiększanie skali produkcji starych i poszukiwanie nowych złóż naturalnych.
Ponadto wiele gałęzi technologii, a zwłaszcza badań naukowych, coraz częściej wymaga monokryształów o bardzo dużej czystości chemicznej i doskonałej strukturze krystalicznej. Kryształy występujące w naturze nie spełniają tych wymagań, gdyż rosną w warunkach bardzo odległych od idealnych.
Powstało zatem zadanie opracowania technologii sztucznego wytwarzania monokryształów wielu pierwiastków i związków chemicznych.
Wypracowanie stosunkowo prostej metody wykonania „klejnotu” powoduje, że przestaje on być cenny. Wyjaśnia to fakt, że większość kamieni szlachetnych to kryształy pierwiastków chemicznych i związków szeroko rozpowszechnionych w przyrodzie. Zatem diament jest kryształem węgla, rubin i szafir to kryształy tlenku glinu z różnymi zanieczyszczeniami.
Rozważmy główne metody uprawy monokryształów. Na pierwszy rzut oka może się wydawać, że krystalizacja ze stopu jest bardzo prosta. Wystarczy podgrzać substancję powyżej jej temperatury topnienia, uzyskać stop, a następnie ochłodzić. Zasadniczo jest to właściwy sposób, ale jeśli nie zostaną podjęte specjalne środki, w najlepszym przypadku otrzymasz próbkę polikrystaliczną. A jeśli eksperyment zostanie przeprowadzony na przykład z kwarcem, siarką, selenem, cukrem, które w zależności od szybkości chłodzenia ich stopów mogą zestalić się w stanie krystalicznym lub amorficznym, wówczas nie ma gwarancji, że ciało amorficzne nie zostanie uzyskana.
Aby wyhodować jeden monokryształ, powolne chłodzenie nie wystarczy. Należy najpierw schłodzić jeden mały obszar wytopu i uzyskać w nim „zarodkowanie” kryształu, a następnie sukcesywnie schładzając wytop otaczający „zarodkowanie”, pozwolić kryształowi urosnąć w całej objętości stopić. Proces ten można osiągnąć poprzez powolne opuszczanie tygla zawierającego stop przez otwór w pionowym piecu rurowym. Kryształ zarodkuje się na dnie tygla, gdyż najpierw wchodzi w obszar niższych temperatur, a następnie stopniowo rozrasta się w całej objętości wytopu. Dno tygla jest specjalnie wąskie, zakończone stożkiem, dzięki czemu może się w nim znajdować tylko jedno jądro krystaliczne.
Metodę tę często stosuje się do hodowli kryształów cynku, srebra, aluminium, miedzi i innych metali, a także chlorku sodu, bromku potasu, fluorku litu i innych soli stosowanych w przemyśle optycznym. W ciągu jednego dnia można wyhodować kryształ soli kamiennej o wadze około kilograma.
Wadą opisywanej metody jest zanieczyszczenie kryształów materiałem tygla. Właściwość symetrii defektu kryształu
Beztyglowa metoda hodowania kryształów ze stopu, którą stosuje się do hodowli np. korundu (rubinów, szafirów), nie ma tej wady. Najdrobniejszy proszek tlenku glinu z ziaren o wielkości 2-100 mikronów wysypuje się cienkim strumieniem z leja zasypowego, przechodzi przez płomień tlenowo-wodorowy, topi się i opada w postaci kropli na pręt z materiału ogniotrwałego. Temperatura pręta jest utrzymywana nieco poniżej temperatury topnienia tlenku glinu (2030°C). Krople tlenku glinu ochładzają się na nim i tworzą skorupę ze spiekanej masy korundowej. Mechanizm zegara powoli (10-20 mm/h) opuszcza pręt, a na nim stopniowo wyrasta nieoszlifowany kryształ korundu w kształcie odwróconej gruszki, tzw. bule.
Podobnie jak w naturze, otrzymanie kryształów z roztworu sprowadza się do dwóch metod. Pierwsza z nich polega na powolnym odparowaniu rozpuszczalnika z nasyconego roztworu, a druga na powolnym obniżaniu temperatury roztworu. Częściej stosowana jest druga metoda. Jako rozpuszczalniki stosuje się wodę, alkohole, kwasy, stopione sole i metale. Wadą metod hodowli kryształów z roztworu jest możliwość zanieczyszczenia kryształów cząsteczkami rozpuszczalnika.
Kryształ wyrasta z obszarów przesyconego roztworu, które bezpośrednio go otaczają. W rezultacie roztwór w pobliżu kryształu okazuje się mniej przesycony niż daleko od niego. Ponieważ roztwór przesycony jest cięższy od nasyconego, zawsze następuje przepływ „zużytego” roztworu ponad powierzchnię rosnącego kryształu. Bez takiego mieszania roztworu wzrost kryształów szybko ustałby. Dlatego często roztwór jest dodatkowo mieszany lub kryształ mocowany jest na obrotowym uchwycie. Dzięki temu możesz hodować bardziej zaawansowane kryształy.
Im niższa szybkość wzrostu, tym lepsze otrzymane kryształy. Zasada ta dotyczy wszystkich metod uprawy. Kryształy cukru i soli kuchennej można łatwo uzyskać z wodnego roztworu w domu. Ale niestety nie wszystkie kryształy można hodować tak łatwo. Przykładowo produkcja kryształów kwarcu z roztworu następuje w temperaturze 400°C i pod ciśnieniem 1000 atm.
Rozdział 5. Właściwości kryształów
Patrząc na różne kryształy, widzimy, że wszystkie mają inny kształt, ale każdy z nich reprezentuje symetryczne ciało. Rzeczywiście, symetria jest jedną z głównych właściwości kryształów. Ciała nazywamy symetrycznymi, jeśli składają się z równych, identycznych części.
Wszystkie kryształy są symetryczne. Oznacza to, że w każdym krystalicznym wielościanie można znaleźć płaszczyzny symetrii, osie symetrii, środki symetrii i inne elementy symetrii tak, aby identyczne części wielościanu pasowały do siebie. Wprowadźmy jeszcze jedno pojęcie związane z symetrią – polarność.
Każdy krystaliczny wielościan ma pewien zestaw elementów symetrii. Kompletny zbiór wszystkich elementów symetrii właściwych dla danego kryształu nazywany jest klasą symetrii. Ich liczba jest ograniczona. Udowodniono matematycznie, że w kryształach występują 32 rodzaje symetrii.
Rozważmy bardziej szczegółowo rodzaje symetrii w krysztale. Po pierwsze, kryształy mogą mieć osie symetrii tylko 1, 2, 3, 4 i 6 rzędów. Oczywiście osie symetrii rzędów 5, 7 i wyższych nie są możliwe, ponieważ przy takiej strukturze rzędy i sieci atomowe nie będą wypełniać przestrzeni w sposób ciągły, pomiędzy pozycjami równowagi atomów pojawią się puste przestrzenie i szczeliny. Atomy nie będą w najbardziej stabilnych pozycjach, a struktura kryształu zapadnie się.
W krystalicznym wielościanie można znaleźć różne kombinacje elementów symetrii – niektóre mają ich niewiele, inne wiele. Według symetrii, głównie wzdłuż osi symetrii, kryształy dzielą się na trzy kategorie.
Do najwyższej kategorii zaliczają się kryształy najbardziej symetryczne, mogą mieć kilka osi symetrii rzędów 2, 3 i 4, nie mają osi 6 rzędu, mogą posiadać płaszczyzny i środki symetrii. Kształty te obejmują sześcian, ośmiościan, czworościan itp. Wszystkie mają wspólną cechę: są w przybliżeniu takie same we wszystkich kierunkach.
Kryształy kategorii środkowej mogą mieć osie 3, 4 i 6 rzędów, ale tylko po jednym na raz. Osi rzędu 2 może być kilka, możliwe są płaszczyzny symetrii i środki symetrii. Kształty tych kryształów: pryzmaty, piramidy itp. Cecha wspólna: wyraźna różnica wzdłuż i w poprzek głównej osi symetrii.
Kryształy w najwyższej kategorii to: diament, kwarc, german, krzem, miedź, aluminium, złoto, srebro, szara cyna, wolfram, żelazo. Do kategorii środkowej: grafit, rubin, kwarc, cynk, magnez, biała cyna, turmalin, beryl. Do najniższego: gips, mika, siarczan miedzi, sól Rochelle itp. Oczywiście na tej liście nie wymieniono wszystkich istniejących kryształów, a jedynie najsłynniejsze z nich.
Kategorie są z kolei podzielone na siedem systemów. W tłumaczeniu z greckiego „syngony” oznacza „podobny kąt”. Kryształy o identycznych osiach symetrii, a co za tym idzie o podobnych kątach obrotu w strukturze, łączą się w układ kryształów.
Właściwości fizyczne kryształów zależą najczęściej od ich struktury i składu chemicznego.
Na początek warto wspomnieć o dwóch podstawowych właściwościach kryształów. Jednym z nich jest anizotropia. Termin ten oznacza zmianę właściwości w zależności od kierunku. Jednocześnie kryształy są ciałami jednorodnymi. Jednorodność substancji krystalicznej polega na tym, że jej dwie części o tym samym kształcie i tej samej orientacji mają identyczne właściwości.
Porozmawiajmy najpierw o właściwościach elektrycznych. Zasadniczo właściwości elektryczne kryształów można rozpatrywać na przykładzie metali, ponieważ metale w jednym ze swoich stanów mogą być agregatami krystalicznymi. Elektrony poruszające się swobodnie w metalu nie mogą wyjść, wymaga to energii. Jeśli w tym przypadku zostanie zużyta energia promieniowania, efekt abstrakcji elektronów powoduje tzw. efekt fotoelektryczny. Podobny efekt obserwuje się w monokryształach. Elektron wyrwany z orbity molekularnej, pozostając wewnątrz kryształu, powoduje w nim przewodnictwo metaliczne (wewnętrzny efekt fotoelektryczny). W normalnych warunkach (bez napromieniania) połączenia takie nie są przewodnikami prądu elektrycznego.
Zachowanie fal świetlnych w kryształach badał E. Bertolin, który jako pierwszy zauważył, że fale przechodząc przez kryształ zachowują się niestandardowo. Pewnego dnia Bertalin szkicował dwuścienne kąty drzewca Islandii, następnie nałożył kryształ na rysunki i wtedy naukowiec po raz pierwszy zobaczył, że każda linia się rozwidla. Kilkukrotnie był przekonany, że wszystkie kryształy drzewcowe rozwidlają światło, dopiero wtedy Bertalin napisał traktat „Eksperymenty z dwójłomnym islandzkim kryształem, które doprowadziły do odkrycia cudownego i niezwykłego załamania światła” (1669). Naukowiec przesłał wyniki swoich eksperymentów indywidualnym naukowcom i akademiom w kilku krajach. Prace przyjęto z całkowitą nieufnością. Angielska Akademia Nauk wyznaczyła grupę naukowców do przetestowania tego prawa (Newton, Boyle, Hooke itp.). Ta autorytatywna komisja uznała zjawisko za przypadkowe, a prawo za nieistniejące. Wyniki eksperymentów Bertalina zostały zapomniane.
Zaledwie 20 lat później Christiaan Huygens potwierdził słuszność odkrycia Bertalina i sam odkrył dwójłomność w kwarcu. Wielu naukowców, którzy później badali tę właściwość, potwierdziło, że nie tylko islandzki drzewce, ale także wiele innych kryształów rozwidla światło.
...Podobne dokumenty
Struktura krystaliczna. Rola, przedmiot i zadania fizyki ciała stałego. Ciała krystaliczne i amorficzne. Rodzaje sieci krystalicznych. Rodzaje wiązań w kryształach. Struktury krystaliczne ciał stałych. Ciekłe kryształy. Wady kryształów.
wykład, dodano 13.03.2007
Pojęcie i główne cechy skondensowanego stanu materii, charakterystyczne procesy. Ciała krystaliczne i amorficzne. Istota i cechy anizotropii kryształów. Charakterystyczne cechy polikryształów i polimerów. Właściwości termiczne i struktura kryształów.
przebieg wykładów, dodano 21.02.2009
Ogólne właściwości ciała stałego, jego stan. Stany zlokalizowane i zdelokalizowane ciała stałego, cechy charakterystyczne. Istota, rodzaje wiązań chemicznych w ciałach stałych. Opisy lokalne i nielokalne w sieciach niezniekształconych. Wady punktowe.
tutorial, dodano 21.02.2009
Kryształy to prawdziwe ciała stałe. Termodynamika defektów punktowych w kryształach, ich migracja, źródła i pochłaniacze. Badanie dyslokacji, defektu liniowego w strukturze krystalicznej ciał stałych. Wady dwuwymiarowe i trójwymiarowe. Amorficzne ciała stałe.
raport, dodano 01.07.2015
Fizyka ciała stałego jest jednym z filarów, na których opiera się nowoczesne społeczeństwo technologiczne. Struktura fizyczna ciał stałych. Symetria i klasyfikacja kryształów. Cechy odkształceń i naprężeń. Wady kryształów, sposoby zwiększania wytrzymałości.
prezentacja, dodano 12.02.2010
Dodanie elementów symetrii nieciągłej. Spójne odbicie w dwóch równoległych płaszczyznach symetrii. Suma płaszczyzny symetrii i przesunięcia prostopadłego do niej. Charakterystyka działania wektora translacji na osiach do niego prostopadłych.
prezentacja, dodano 23.09.2013
Stany krystaliczne i amorficzne ciał stałych, przyczyny defektów punktowych i liniowych. Zarodkowanie i wzrost kryształów. Sztuczna produkcja kamieni szlachetnych, roztworów stałych i ciekłych kryształów. Właściwości optyczne cholesterycznych ciekłych kryształów.
streszczenie, dodano 26.04.2010
Właściwości fotoelektryczne niejednorodnych próbek półprzewodników. Struktura energetyczna styku omowego w obecności nierównomiernie rozmieszczonych pułapek elektronowych. Właściwości fotoelektryczne kryształów przetwarzanych w wyładowaniu gazowym.
teza, dodana 18.03.2008
Wady kryształów rzeczywistych, zasada działania tranzystorów bipolarnych. Zakłócenia sieci krystalicznej w roztworach stałych śródmiąższowych i substytucyjnych. Zjawiska powierzchniowe w półprzewodnikach. Parametry tranzystora i współczynnik przenikania prądu emitera.
test, dodano 22.10.2009
Wiązania wodorowe w wodzie, ich główne kryteria. Anomalne właściwości wody. Pojęcie elektrolizy i elektrolitów. Elektrokrystalizacja i jej prawa. Dynamika sieci wiązań wodorowych podczas elektrokrystalizacji wody. Lody krystaliczne i amorficzne.
4. . 5. . 6. . 7. .
Każdy może łatwo podzielić ciała na stałe i ciekłe. Podział ten będzie jednak opierał się wyłącznie na znakach zewnętrznych. Aby dowiedzieć się, jakie właściwości mają ciała stałe, podgrzejemy je. Niektóre ciała zaczną się palić (drewno, węgiel) - są to substancje organiczne. Inne zmiękną (żywica) nawet w niskich temperaturach – są to materiały amorficzne. Szczególną grupę ciał stałych stanowią te, dla których na rysunku 12 przedstawiono zależność temperatury od czasu ogrzewania. Są to ciała krystaliczne. To zachowanie ciał krystalicznych po podgrzaniu tłumaczy się ich wewnętrzną strukturą. Ciała kryształowe- są to ciała, których atomy i cząsteczki są ułożone w określonej kolejności, a kolejność ta jest zachowana na dość dużej odległości. Nazywa się przestrzennym okresowym rozmieszczeniem atomów lub jonów w krysztale sieci krystalicznej. Punkty sieci krystalicznej, w których znajdują się atomy lub jony, nazywane są węzłami sieci krystalicznej.
Ciała krystaliczne to monokryształy lub polikryształy. Monokryształ ma sieć monokrystaliczną w całej swojej objętości.
Anizotropia monokryształów polega na zależności ich właściwości fizycznych od kierunku. Polikryształ Jest to połączenie małych, różnie zorientowanych monokryształów (ziarn) i nie posiada właściwości anizotropowych. Większość ciał stałych ma strukturę polikrystaliczną (minerały, stopy, ceramika).
Głównymi właściwościami ciał krystalicznych są: pewność temperatury topnienia, sprężystość, wytrzymałość, zależność właściwości od kolejności ułożenia atomów, czyli od rodzaju sieci krystalicznej.
Amorficzny to substancje, które nie mają porządku w rozmieszczeniu atomów i cząsteczek w całej objętości tej substancji. W przeciwieństwie do substancji krystalicznych, substancje amorficzne izotropowy. Oznacza to, że właściwości są takie same we wszystkich kierunkach. Przejście ze stanu amorficznego do ciekłego następuje stopniowo, nie ma określonej temperatury topnienia. Ciała amorficzne nie mają elastyczności, są plastyczne. Różne substancje występują w stanie amorficznym: szkło, żywice, tworzywa sztuczne itp.
Elastyczność- właściwość ciał do przywracania kształtu i objętości po ustaniu działania sił zewnętrznych lub innych przyczyn, które spowodowały deformację ciał. Zgodnie z naturą przemieszczania się cząstek ciała stałego, odkształcenia zachodzące przy zmianie jego kształtu dzielą się na: rozciąganie – ściskanie, ścinanie, skręcanie i zginanie. W przypadku odkształceń sprężystych obowiązuje prawo Hooke'a, zgodnie z którym odkształcenia sprężyste są wprost proporcjonalne do wpływów zewnętrznych, które je powodują. W przypadku odkształcenia rozciągającego i ściskającego prawo Hooke'a ma postać: , gdzie jest naprężeniem mechanicznym, jest wydłużeniem względnym, jest wydłużeniem absolutnym, jest modułem Younga (modułem sprężystości). Elastyczność wynika z interakcji i ruchu termicznego cząstek tworzących substancję.
W zależności od właściwości fizycznych i budowy molekularnej wyróżnia się dwie główne klasy ciał stałych – krystaliczne i amorficzne.
Definicja 1
Ciała amorficzne mają taką cechę jak izotropia. Koncepcja ta oznacza, że są one względnie niezależne od właściwości optycznych, mechanicznych i innych właściwości fizycznych oraz kierunku, w jakim działają na nie siły zewnętrzne.
Główną cechą ciał aphmorycznych jest chaotyczny układ atomów i cząsteczek, które gromadzą się tylko w małych lokalnych grupach, nie większych niż kilka cząstek w każdej.
Ta właściwość zbliża ciała amorficzne do cieczy. Do takich ciał stałych zalicza się bursztyn i inne twarde żywice, różne rodzaje tworzyw sztucznych i szkła. Pod wpływem wysokich temperatur ciała amorficzne miękną, ale aby je przekształcić w ciecz, potrzebne jest silne ciepło.
Wszystkie ciała krystaliczne mają wyraźną strukturę wewnętrzną. Grupy cząstek w tej samej kolejności powtarzają się okresowo w całej objętości takiego ciała. Do wizualizacji takiej struktury zwykle wykorzystuje się przestrzenne sieci krystaliczne. Składają się z pewnej liczby węzłów, które tworzą centra cząsteczek lub atomów określonej substancji. Zazwyczaj taka sieć jest zbudowana z jonów wchodzących w skład pożądanych cząsteczek. Zatem w soli kuchennej struktura wewnętrzna składa się z jonów sodu i chloru, połączonych parami w cząsteczki. Takie ciała krystaliczne nazywane są jonowymi.
Rysunek 3. 6. 1. Sieć krystaliczna soli kuchennej.
Definicja 2
W strukturze każdej substancji można wyróżnić jeden minimalny składnik - komórka elementarna.
Całą sieć, z której składa się ciało krystaliczne, można ułożyć poprzez translację (przeniesienie równoległe) takiej komórki w określonych kierunkach.
Liczba rodzajów sieci krystalicznych nie jest nieskończona. W sumie istnieje 230 gatunków, z których większość została sztucznie stworzona lub znaleziona w materiałach naturalnych. Kraty strukturalne mogą mieć postać sześcianów centrowanych na ciele (na przykład w przypadku żelaza), sześcianów centrowanych na ścianie (w przypadku złota, miedzi) lub pryzmatu o sześciu ścianach (magnez, cynk).
Z kolei ciała krystaliczne dzielą się na polikryształy i monokryształy. Większość substancji należy do polikryształów, ponieważ składają się z tak zwanych krystalitów. Są to małe kryształy połączone ze sobą i losowo zorientowane. Substancje monokrystaliczne są stosunkowo rzadkie, nawet wśród materiałów sztucznych.
Definicja 3
Polikryształy mają właściwość izotropii, to znaczy te same właściwości we wszystkich kierunkach.
Polikrystaliczna struktura korpusu jest wyraźnie widoczna pod mikroskopem, a w przypadku niektórych materiałów, np. żeliwa, nawet gołym okiem.
Definicja 4
Wielopostaciowość– to zdolność substancji do istnienia w kilku fazach, tj. modyfikacje kryształów różniące się między sobą właściwościami fizycznymi.
Nazywa się proces przejścia na inną modyfikację przejście polimorficzne.
Przykładem takiego zjawiska może być przemiana grafitu w diament, która w warunkach przemysłowych zachodzi pod wysokim ciśnieniem (do 100 000 atmosfer) i wysokimi temperaturami
(do 2000 K).
Do badania struktury sieciowej próbki monokrystalicznej lub polikrystalicznej stosuje się dyfrakcję promieni rentgenowskich.
Proste sieci krystaliczne pokazano na poniższym rysunku. Należy wziąć pod uwagę, że odległość między cząstkami jest na tyle mała, że jest porównywalna z wielkością samych cząstek. Dla przejrzystości diagramy pokazują jedynie położenie środków.

Rysunek 3. 6. 2. Proste sieci krystaliczne: 1 – prosta sieć sześcienna; 2 – siatka sześcienna centrowana na ścianie; 3 – siatka sześcienna skupiona na ciele; 4 – siatka sześciokątna.
Najprostsza jest siatka sześcienna: taka konstrukcja składa się z sześcianów z cząstkami na wierzchołkach. Siatka skupiona na twarzy ma cząstki nie tylko w wierzchołkach, ale także na ścianach. Na przykład sieć krystaliczna soli kuchennej składa się z dwóch sieci centrowanych na ścianie, zagnieżdżonych jedna w drugiej. Siatka skupiona na ciele ma dodatkowe cząstki w środku każdego sześcianu.
Kraty metalowe mają jedną ważną cechę. Jony substancji są utrzymywane na miejscu poprzez interakcję z gazem wolnych elektronów. Tak zwany gaz elektronowy składa się z jednego lub większej liczby elektronów oddanych przez atomy. Takie wolne elektrony mogą poruszać się po całej objętości kryształu.

Rysunek 3. 6. 3. Struktura kryształu metalu.
Jeśli zauważysz błąd w tekście, zaznacz go i naciśnij Ctrl+Enter
Podobnie jak płyn, ale także forma. Występują przeważnie w stanie krystalicznym.
Kryształy- są to ciała stałe, których atomy lub cząsteczki zajmują określone, uporządkowane pozycje w przestrzeni. Dlatego kryształy mają płaskie krawędzie. Na przykład ziarno zwykłej soli kuchennej ma płaskie krawędzie, które tworzą ze sobą kąt prosty ( Ryc.12.1).
Można to zobaczyć, badając sól przez szkło powiększające. A jak geometrycznie poprawny jest kształt płatka śniegu! Odzwierciedla także poprawność geometryczną wewnętrznej struktury ciała krystalicznego – lodu ( Ryc.12.2).

Przede wszystkim uderzająca jest różna wytrzymałość mechaniczna kryształów w różnych kierunkach. Na przykład kawałek miki łatwo złuszcza się w jednym kierunku na cienkie płytki ( Ryc.12.3), ale znacznie trudniej jest go złamać w kierunku prostopadłym do płytek.

Kryształ grafitu również łatwo złuszcza się w jednym kierunku. Podczas pisania ołówkiem rozwarstwienie następuje w sposób ciągły i na papierze pozostają cienkie warstwy grafitu. Dzieje się tak, ponieważ sieć krystaliczna grafitu ma strukturę warstwową. Warstwy utworzone są przez szereg równoległych sieci składających się z atomów węgla ( Ryc.12.4). Atomy znajdują się na wierzchołkach regularnych sześciokątów. Odległość między warstwami jest stosunkowo duża - około 2 razy większa od długości boku sześciokąta, więc wiązania między warstwami są słabsze niż wiązania w nich.

Wiele kryształów przewodzi ciepło i prąd w różny sposób w różnych kierunkach. Właściwości optyczne kryształów zależą również od kierunku. Zatem kryształ kwarcu załamuje światło w różny sposób w zależności od kierunku padających na niego promieni.
Nazywa się zależność właściwości fizycznych od kierunku wewnątrz kryształu anizotropia. Wszystkie ciała krystaliczne są anizotropowe.
Monokryształy i polikryształy. Metale mają strukturę krystaliczną. To metale są dziś wykorzystywane głównie do produkcji narzędzi, różnych maszyn i mechanizmów.
Jeśli weźmiemy stosunkowo duży kawałek metalu, to na pierwszy rzut oka jego krystaliczna struktura nie będzie widoczna ani w wyglądzie tego kawałka, ani w jego właściwościach fizycznych. Metale w stanie normalnym nie wykazują anizotropii.
Chodzi o to, że metal zwykle składa się z ogromnej liczby małych kryształów połączonych ze sobą. Łatwo je dostrzec pod mikroskopem lub nawet przez szkło powiększające, zwłaszcza na świeżym pęknięciu metalu ( Ryc.12.5). Właściwości każdego kryształu zależą od kierunku, ale kryształy są losowo zorientowane względem siebie. W rezultacie w objętości znacznie większej niż objętość poszczególnych kryształów wszystkie kierunki w metalach są równe, a właściwości metali są takie same we wszystkich kierunkach.

Nazywa się ciało stałe składające się z dużej liczby małych kryształów polikrystaliczny. Nazywa się monokryształy monokryształy.
Podejmując duże środki ostrożności, można wyhodować duży kryształ metalu – pojedynczy kryształ.
W normalnych warunkach ciało polikrystaliczne powstaje w wyniku tego, że rozpoczęty wzrost wielu kryształów trwa, dopóki nie zetkną się ze sobą, tworząc jedno ciało.
Do polikryształów zaliczają się nie tylko metale. Na przykład kawałek cukru również ma strukturę polikrystaliczną.
Większość krystalicznych ciał stałych to polikryształy, ponieważ składają się z wielu przerośniętych kryształów. Monokryształy - monokryształy mają regularny kształt geometryczny, a ich właściwości różnią się w różnych kierunkach (anizotropia).
???
1. Czy wszystkie ciała krystaliczne są anizotropowe?
2. Drewno jest anizotropowe. Czy jest to ciało krystaliczne?
3. Podaj przykłady ciał stałych monokrystalicznych i polikrystalicznych niewymienionych w tekście.
G.Ya.Myakishev, B.B.Bukhovtsev, N.N.Sotsky, fizyka 10. klasa
Treść lekcji notatki z lekcji ramka wspomagająca prezentację lekcji metody przyspieszania technologie interaktywne Ćwiczyć zadania i ćwiczenia autotest warsztaty, szkolenia, case'y, zadania prace domowe dyskusja pytania retoryczne pytania uczniów Ilustracje pliki audio, wideo i multimedia fotografie, obrazy, grafiki, tabele, diagramy, humor, anegdoty, dowcipy, komiksy, przypowieści, powiedzenia, krzyżówki, cytaty Dodatki streszczenia artykuły sztuczki dla ciekawskich szopki podręczniki podstawowy i dodatkowy słownik terminów inne Udoskonalanie podręczników i lekcjipoprawianie błędów w podręczniku aktualizacja fragmentu podręcznika, elementy innowacji na lekcji, wymiana przestarzałej wiedzy na nową Tylko dla nauczycieli doskonałe lekcje plan kalendarza na rok, zalecenia metodyczne, programy dyskusji Zintegrowane LekcjeJeśli masz uwagi lub sugestie dotyczące tej lekcji,
 Ruch ciał pod wpływem grawitacji
Ruch ciał pod wpływem grawitacji Tropy i figury stylistyczne
Tropy i figury stylistyczne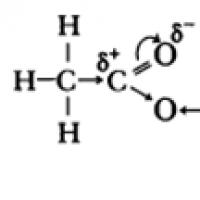 §12. Kwasy karboksylowe. Kwasy karboksylowe: właściwości fizyczne. Sole kwasów karboksylowych Najprostszym kwasem karboksylowym jest kwas mrówkowy
§12. Kwasy karboksylowe. Kwasy karboksylowe: właściwości fizyczne. Sole kwasów karboksylowych Najprostszym kwasem karboksylowym jest kwas mrówkowy Rozmowa z byłą dziewczyną
Rozmowa z byłą dziewczyną Dlaczego marzysz o swoim najlepszym przyjacielu, byłym przyjacielu lub przyjacielu z dzieciństwa?
Dlaczego marzysz o swoim najlepszym przyjacielu, byłym przyjacielu lub przyjacielu z dzieciństwa? Interpretacja snów kobiety w ciąży marzy o dziecku
Interpretacja snów kobiety w ciąży marzy o dziecku Dlaczego marzysz o prądzie iskrowym? Dlaczego śnisz o iskrach? Co piszą w książkach marzeń
Dlaczego marzysz o prądzie iskrowym? Dlaczego śnisz o iskrach? Co piszą w książkach marzeń