§12. Kwasy karboksylowe. Kwasy karboksylowe: właściwości fizyczne. Sole kwasów karboksylowych Najprostszym kwasem karboksylowym jest kwas mrówkowy
DEFINICJA
Nazywa się substancje organiczne, których cząsteczki zawierają jedną lub więcej grup karboksylowych połączonych z rodnikiem węglowodorowym kwasy karboksylowe.
Pierwsi trzej członkowie homologicznej serii kwasów karboksylowych, w tym kwas propionowy, to ciecze o ostrym zapachu i dobrze rozpuszczalne w wodzie. Poniższe homologi, zaczynając od kwasu masłowego, to także ciecze, które mają silny nieprzyjemny zapach, ale są słabo rozpuszczalne w wodzie. Kwasy wyższe, o liczbie atomów węgla 10 i więcej, są stałe, bezwonne, nierozpuszczalne w wodzie. Ogólnie rzecz biorąc, w szeregu homologów wraz ze wzrostem masy cząsteczkowej zmniejsza się rozpuszczalność w wodzie, maleje gęstość i wzrasta temperatura wrzenia (tabela 1).
Tabela 1. Szeregi homologiczne kwasów karboksylowych.
Wytwarzanie kwasów karboksylowych
Kwasy karboksylowe otrzymuje się przez utlenianie nasyconych węglowodorów, alkoholi i aldehydów. Na przykład kwas octowy - poprzez utlenienie etanolu roztworem nadmanganianu potasu w kwaśnym środowisku po podgrzaniu:
Właściwości chemiczne kwasów karboksylowych
Właściwości chemiczne kwasów karboksylowych zależą przede wszystkim od specyfiki ich struktury. Zatem kwasy rozpuszczalne w wodzie mogą dysocjować na jony:
R-COOH↔R-COO - + H + .
Ze względu na obecność jonów H+ w wodzie mają kwaśny smak, potrafią zmieniać kolor wskaźników i przewodzić prąd elektryczny. W roztworze wodnym kwasy te są słabymi elektrolitami.
Kwasy karboksylowe mają właściwości chemiczne charakterystyczne dla roztworów kwasów nieorganicznych, tj. oddziałują z metalami (1), ich tlenkami (2), wodorotlenkami (3) i słabymi solami (4):
2CH 3 -COOh + Zn → (CH 3 COO) 2 Zn + H 2 (1);
2CH 3-COOH + CuO → (CH 3 COO) 2 Cu + H 2 O (2);
R-COOH + KOH → R-COOK + H2O (3);
2CH 3-COOH + NaHCO 3 → CH 3 COONa + H 2 O + CO 2 (4).
Specyficzną właściwością nasyconych i nienasyconych kwasów karboksylowych, objawiającą się grupą funkcyjną, jest oddziaływanie z alkoholami.
Kwasy karboksylowe reagują z alkoholami po podgrzaniu i w obecności stężonego kwasu siarkowego. Na przykład, jeśli do kwasu octowego doda się alkohol etylowy i odrobinę kwasu siarkowego, wówczas po podgrzaniu pojawia się zapach kwasu etylooctowego (octanu etylu):
CH 3-COOH + C 2 H 5 OH ↔ CH 3 -C(O)-O-C 2 H 5 + H 2 O.
Specyficzną właściwością nasyconych kwasów karboksylowych, objawiającą się rodnikiem, jest reakcja halogenowania (chlorowania).

Zastosowanie kwasów karboksylowych
Kwasy karboksylowe służą jako surowiec do produkcji ketonów, halogenków kwasowych, estrów winylowych i innych ważnych klas związków organicznych.
Kwas mrówkowy jest szeroko stosowany do otrzymywania estrów, stosowany w przemyśle perfumeryjnym, skórzanym (garbowanie skór), w przemyśle tekstylnym (jako zaprawa do barwienia), jako rozpuszczalnik i środek konserwujący.
Wodny roztwór (70-80%) kwasu octowego nazywany jest esencją octową, a 3-9% roztwór wodny nazywany jest octem stołowym. Esencję często wykorzystuje się do uzyskania octu w domu poprzez rozcieńczenie.
Przykłady rozwiązywania problemów
PRZYKŁAD 1
| Ćwiczenia | Jakie reakcje chemiczne można zastosować do przeprowadzenia następujących przemian: a) CH 4 → CH 3Cl → CH 3OH → HCHO → HCOOH → HCOOK. Zapisz równania reakcji i wskaż warunki ich wystąpienia. |
| Odpowiedź | a) Chlorowanie metanu w świetle prowadzi do wytworzenia chlorometanu: CH 4 + Cl 2 →CH 3 Cl + HCl. Halogenowe pochodne alkanów ulegają hydrolizie w środowisku wodnym lub zasadowym, tworząc alkohole: CH3Cl + NaOH → CH3OH + NaCl. W wyniku utleniania alkoholi pierwszorzędowych np. dwuchromianem potasu w środowisku kwaśnym w obecności katalizatora (Cu, CuO, Pt, Ag) powstają aldehydy: CH3OH+ [O] →HCHO. Aldehydy łatwo utleniają się do odpowiednich kwasów karboksylowych, na przykład nadmanganianem potasu: HCHO + [O] →HCOOH. Kwasy karboksylowe wykazują wszystkie właściwości właściwe słabym kwasom mineralnym, tj. zdolny do interakcji z aktywnymi metalami, tworząc sole: 2HCOOH+ 2K → 2HCOOK + H 2 . |
PRZYKŁAD 2
| Ćwiczenia | Zapisz równania reakcji pomiędzy następującymi substancjami: a) kwas 2-metylopropanowy i chlor; b) kwas octowy i propanol-2; c) kwas akrylowy i woda bromowa; d) kwas 2-metylobutanowy i chlorek fosforu (V). Określ warunki reakcji. |
| Odpowiedź | a) w wyniku reakcji kwasu 2-metylopropanowego z chlorem następuje wymiana atomu wodoru w rodniku węglowodorowym znajdującym się w pozycji a; Tworzy się kwas 2-metylo-2-chloropropanowy H 3 C-C(CH 3)H-COOH + Cl 2 → H 3 C-C(CH 3)Cl-COOH + HCl (kat = P). b) w wyniku reakcji kwasu octowego z propanolem-2 powstaje ester – ester izopropylowy kwasu octowego. CH 3-COOH + CH 3-C(OH)H-CH 3 → CH 3-C(O)-O-C(CH 3)-CH 3 . c) w wyniku reakcji interakcji kwasu akrylowego z wodą bromową dodanie halogenu w miejscu wiązania podwójnego zgodnie z regułą Markownikowa; Tworzy się kwas 2,3-dibromopropanowy CH2=CH-COOH + Br2 → CH2Br-CHBr-COOH d) w wyniku reakcji kwasu 2-metylobutanowego z chlorkiem fosforu (V) powstaje odpowiedni chlorek kwasowy CH 3 -CH 2 -C(CH 3)H-COOH + PCl 5 →CH 3 -CH 2 -C(CH 3)H-COOCl + POCl 3 + HCl. |
Kwasy karboksylowe- substancje organiczne, których cząsteczki zawierają jedną lub więcej grup karboksylowych.
Grupa karboksylowa (w skrócie COOH) jest grupą funkcyjną kwasów karboksylowych składającą się z grupy karbonylowej i związanej z nią grupy hydroksylowej.
W zależności od liczby grup karboksylowych kwasy karboksylowe dzielą się na jednozasadowe, dwuzasadowe itp.
Ogólny wzór jednozasadowych kwasów karboksylowych to R-COOH. Przykładem kwasu dwuzasadowego jest kwas szczawiowy HOOC-COOH.
W zależności od rodzaju rodnika kwasy karboksylowe dzielą się na nasycone (na przykład kwas octowy CH 3 COOH), nienasycone [na przykład kwas akrylowy CH 2 = CH – COOH, kwas oleinowy CH 3 – (CH 2) 7 – CH =CH-(CH2)7-COOH] i aromatyczny (na przykład benzoesowy C6H5-COOH).
Izomery i homologi
Jednozasadowe nasycone kwasy karboksylowe R-COOH to izomery estrów (w skrócie R”-COOR”) o tej samej liczbie atomów węgla. Ogólny wzór obu to C N H 2 N O2.
| G | HCOOH metan (mrówka) |
||||
| CH3COOH etan (octowy) | HCOOCH 3 ester metylowy kwasu mrówkowego |
||||
| CH3CH2COOH propan (propionowy) |
HCOOCH 2 CH 3 kwas etylomrówkowy |
CH 3 COOCH 3 ester metylowy kwasu octowego | |||
| CH3(CH2)2COOH butan (olej) |
2-metylopropan |
HCOOCH 2 CH 2 CH 3 ester propylowy kwasu mrówkowego |
CH 3 COOCH 2 CH 3 octan etylu |
CH 3 CH 2 COOCH 3 ester metylowy kwasu propionowego |
|
| izomery | |||||
Algorytm tworzenia nazw kwasów karboksylowych
- Znajdź szkielet węglowy - jest to najdłuższy łańcuch atomów węgla, w tym atom węgla grupy karboksylowej.
- Ponumeruj atomy węgla w głównym łańcuchu, zaczynając od karboksylowego atomu węgla.
- Nazwij związek, korzystając z algorytmu dla węglowodorów.
- Na końcu nazwy dodaj przyrostek „-ov”, końcówkę „-aya” i słowo „acid”.
W cząsteczkach kwasów karboksylowych P-elektrony atomów tlenu grupy hydroksylowej oddziałują z elektronami wiązania - grupy karbonylowej, w wyniku czego zwiększa się polarność wiązania O-H, wiązanie - w grupie karbonylowej wzmacnia się, ładunek cząstkowy (+) na atomie węgla maleje, a ładunek cząstkowy (+) na atomie wodoru rośnie.
Ten ostatni sprzyja tworzeniu silnych wiązań wodorowych pomiędzy cząsteczkami kwasu karboksylowego.
Właściwości fizyczne nasyconych jednozasadowych kwasów karboksylowych wynikają w dużej mierze z obecności silnych wiązań wodorowych między cząsteczkami (silniejszych niż między cząsteczkami alkoholu). Dlatego temperatury wrzenia i rozpuszczalność kwasów w wodzie są wyższe niż odpowiednich alkoholi.
Właściwości chemiczne kwasów
Wzmocnienie wiązania - w grupie karbonylowej prowadzi do tego, że reakcje addycji są nietypowe dla kwasów karboksylowych.
- Spalanie:
CH3COOH + 2O 2 2CO 2 + 2H 2 O
- Właściwości kwasowe.
Ze względu na dużą polarność wiązania O-H kwasy karboksylowe w roztworze wodnym zauważalnie dysocjują (a dokładniej reagują z nim odwracalnie):HCOOH HCOO - + H + (dokładniej HCOOH + H 2 O HCOO - + H 3 O +)
Wszystkie kwasy karboksylowe są słabymi elektrolitami. Wraz ze wzrostem liczby atomów węgla zmniejsza się siła kwasów (z powodu zmniejszenia polarności wiązania OH); wręcz przeciwnie, wprowadzenie atomów halogenu do rodnika węglowodorowego prowadzi do wzrostu mocy kwasu. Tak, z rzęduHCOOH CH3COOH C2H5COOH
siła kwasów maleje i szeregowoWzrastający.
Kwasy karboksylowe wykazują wszystkie właściwości właściwe słabym kwasom:
Mg + 2CH 3 COOH (CH 3 COO) 2 Mg + H 2
CaO + 2CH 3 COOH (CH 3 COO) 2 Ca + H 2 O
NaOH + CH3COOH CH3COONa + H2O
K 2 CO 3 + 2CH 3 COOH 2CH 3 GOTOWAĆ + H 2 O + CO 2 - Estryfikacja (reakcja kwasów karboksylowych z alkoholami prowadząca do powstania estru):
Alkohole wielowodorotlenowe, takie jak glicerol, mogą również brać udział w reakcji estryfikacji. Estry utworzone przez glicerol i wyższe kwasy karboksylowe (kwasy tłuszczowe) są tłuszczami.Tłuszcze są mieszaninami trójglicerydów. Nasycone kwasy tłuszczowe (palmitynowy C 15 H 31 COOH, stearynowy C 17 H 35 COOH) tworzą stałe tłuszcze pochodzenia zwierzęcego, a nienasycone kwasy tłuszczowe (oleinowy C 17 H 33 COOH, linolowy C 17 H 31 COOH itp.) tworzą tłuszcze płynne (oleje) pochodzenia roślinnego.
- Podstawienie w rodniku węglowodorowym:
Podstawienie następuje w pozycji -.Osobliwością kwasu mrówkowego HCOOH jest to, że substancja ta jest związkiem dwufunkcyjnym; jest to zarówno kwas karboksylowy, jak i aldehyd:
Dlatego kwas mrówkowy reaguje między innymi z amoniakalnym roztworem tlenku srebra (reakcja srebrnego lustra; reakcja jakościowa):HCOOH + Ag 2 O (roztwór amoniaku) CO 2 + H 2 O + 2Ag
Wytwarzanie kwasów karboksylowych
.
O
//
Grupa atomów -C nazywana jest grupą karboksylową lub karboksylową.
\
OH
Kwasy organiczne zawierające w cząsteczce jedną grupę karboksylową są kwasami jednozasadowymi. Ogólny wzór tych kwasów to RCOOH.
Kwasy karboksylowe zawierające dwie grupy karboksylowe nazywane są dwuzasadowymi. Należą do nich na przykład kwas szczawiowy i bursztynowy.
Istnieją również wielozasadowe kwasy karboksylowe zawierające więcej niż dwie grupy karboksylowe. Należą do nich na przykład trójzasadowy kwas cytrynowy. W zależności od charakteru rodnika węglowodorowego kwasy karboksylowe dzielą się na nasycone, nienasycone i aromatyczne.
Nasyconymi lub nasyconymi kwasami karboksylowymi są na przykład kwas propionowy (propionowy) lub znany już kwas bursztynowy.
Oczywiście nasycone kwasy karboksylowe nie zawierają P-wiązania w rodniku węglowodorowym.
W cząsteczkach nienasyconych kwasów karboksylowych grupa karboksylowa jest połączona z nienasyconym, nienasyconym rodnikiem węglowodorowym, np. w cząsteczkach kwasu akrylowego (propenowego) CH2=CH-COOH lub oleinowego CH3-(CH2)7-CH=CH-(CH2) 7-COOH i inne kwasy.
Jak widać ze wzoru kwasu benzoesowego, jest on aromatyczny, ponieważ zawiera w cząsteczce pierścień aromatyczny (benzen).
Nazewnictwo i izomeria
Rozważaliśmy już ogólne zasady tworzenia nazw kwasów karboksylowych, a także innych związków organicznych. Rozważmy bardziej szczegółowo nomenklaturę jedno- i dwuzasadowych kwasów karboksylowych. Nazwę kwasu karboksylowego tworzy się z nazwy odpowiedniego alkanu (alkanu o tej samej liczbie atomów węgla w cząsteczce) z dodatkiem przyrostka -ov, końcówki -aya i słowa kwas. Numeracja atomów węgla zaczyna się od grupy karboksylowej. Na przykład:
Wiele kwasów ma również historycznie ustalone lub trywialne nazwy (Tabela 6). 
Po naszym pierwszym zapoznaniu się z różnorodnym i interesującym światem kwasów organicznych rozważymy bardziej szczegółowo nasycone jednozasadowe kwasy karboksylowe.
Oczywiste jest, że skład tych kwasów będzie odzwierciedlony ogólnym wzorem C n H 2n O2 lub C n H 2n +1 COOH lub RCOOH.
Właściwości fizyczne nasyconych jednozasadowych kwasów karboksylowych
Niższe kwasy, czyli kwasy o stosunkowo małej masie cząsteczkowej, zawierające do czterech atomów węgla w cząsteczce, to ciecze o charakterystycznym ostrym zapachu (pamiętajcie zapach kwasu octowego). Kwasy zawierające od 4 do 9 atomów węgla są lepkimi oleistymi cieczami o nieprzyjemnym zapachu; zawierające więcej niż 9 atomów węgla w cząsteczce - ciała stałe, które nie rozpuszczają się w wodzie. Temperatury wrzenia nasyconych jednozasadowych kwasów karboksylowych rosną wraz ze wzrostem liczby atomów węgla w cząsteczce, a co za tym idzie ze wzrostem względnej masy cząsteczkowej. Na przykład temperatura wrzenia kwasu mrówkowego wynosi 101°C, kwasu octowego 118°C, a kwasu propionowego 141°C.
Najprostszy kwas karboksylowy, mrówkowy HCOOH, mający małą względną masę cząsteczkową (46), w normalnych warunkach jest cieczą o temperaturze wrzenia 100,8 °C. Jednocześnie butan (MR(C4H10) = 58) w tych samych warunkach jest gazem i ma temperaturę wrzenia -0,5°C. Tę rozbieżność między temperaturami wrzenia a względnymi masami cząsteczkowymi wyjaśnia się tworzeniem dimerów kwasów karboksylowych, w których dwie cząsteczki kwasu są połączone dwoma wiązaniami wodorowymi. Występowanie wiązań wodorowych staje się jasne, gdy weźmiemy pod uwagę strukturę cząsteczek kwasu karboksylowego.
Cząsteczki nasyconych jednozasadowych kwasów karboksylowych zawierają polarną grupę atomów - karboksylową (zastanów się, co powoduje polarność tej grupy funkcyjnej) i praktycznie niepolarny rodnik węglowodorowy. Grupa karboksylowa jest przyciągana do cząsteczek wody, tworząc z nimi wiązania wodorowe.
Kwas mrówkowy i octowy są nieograniczenie rozpuszczalne w wodzie. Oczywiste jest, że wraz ze wzrostem liczby atomów rodnika węglowodorowego zmniejsza się rozpuszczalność kwasów karboksylowych.
Znając skład i strukturę cząsteczek kwasu karboksylowego, nie będzie nam trudno zrozumieć i wyjaśnić właściwości chemiczne tych substancji.
Właściwości chemiczne
Ogólne właściwości charakterystyczne dla klasy kwasów (zarówno organicznych, jak i nieorganicznych) wynikają z obecności w cząsteczkach grupy hydroksylowej zawierającej silnie polarne wiązanie pomiędzy atomami wodoru i tlenu. Te właściwości są Ci dobrze znane. Rozważmy je ponownie na przykładzie rozpuszczalnych w wodzie kwasów organicznych.
1. Dysocjacja z utworzeniem kationów wodoru i anionów reszty kwasowej. Dokładniej proces ten opisuje równanie uwzględniające udział w nim cząsteczek wody.
Równowaga dysocjacji kwasów karboksylowych jest przesunięta w lewo, zdecydowana większość z nich to słabe elektrolity. Niemniej jednak kwaśny smak na przykład kwasu mrówkowego i octowego można wytłumaczyć dysocjacją reszt kwasowych na kationy wodoru i aniony.
Jest oczywiste, że obecność „kwaśnego” wodoru w cząsteczkach kwasów karboksylowych, czyli wodoru grupy karboksylowej, determinuje także inne charakterystyczne właściwości.
2. Oddziaływanie z metalami w zakresie napięć elektrochemicznych do wodoru. W ten sposób żelazo redukuje wodór z kwasu octowego:
2CH3-COOH + Fe -> (CHgCOO)2Fe + H2
3. Oddziaływanie z zasadowymi tlenkami, tworząc sól i wodę:
2R-COOH + CaO -> (R-COO)2Ca + H2O
4. Reakcja z wodorotlenkami metali z wytworzeniem soli i wody (reakcja neutralizacji):
R-COOH + NaOH -> R-COONa + H20 3R-COOH + Ca(OH)2 -> (R-COO)2Ca + 2H20
5. Oddziaływanie z solami słabszych kwasów, z powstawaniem tych ostatnich. Zatem kwas octowy wypiera kwas stearynowy ze stearynianu sodu i kwas węglowy z węglanu potasu.
6. Oddziaływanie kwasów karboksylowych z alkoholami w celu utworzenia estrów to znana już reakcja estryfikacji (jedna z najważniejszych reakcji charakterystycznych dla kwasów karboksylowych). Oddziaływanie kwasów karboksylowych z alkoholami jest katalizowane przez kationy wodoru.
Reakcja estryfikacji jest odwracalna. Równowaga przesuwa się w stronę tworzenia estru w obecności środków odwadniających i usuwania estru z mieszaniny reakcyjnej.
W odwrotnej reakcji estryfikacji, zwanej hydrolizą estrów (reakcja estru z wodą), powstaje kwas i alkohol. Jest oczywiste, że alkohole wielowodorotlenowe, na przykład glicerol, mogą również reagować z kwasami karboksylowymi, czyli wchodzić w reakcję estryfikacji: 
Wszystkie kwasy karboksylowe (z wyjątkiem kwasu mrówkowego) wraz z grupą karboksylową zawierają w swoich cząsteczkach resztę węglowodorową. Oczywiście nie może to nie wpłynąć na właściwości kwasów, które są określone przez charakter reszty węglowodorowej.
7. Reakcje addycji przy wiązaniu wielokrotnym - wchodzą do nich nienasycone kwasy karboksylowe; na przykład reakcją dodawania wodoru jest uwodornienie. Podczas uwodornienia kwasu oleinowego powstaje nasycony kwas stearynowy.
Nienasycone kwasy karboksylowe, podobnie jak inne związki nienasycone, dodają halogeny poprzez podwójne wiązanie. Na przykład kwas akrylowy odbarwia wodę bromową.
8. Reakcje podstawienia (halogenami) - mogą do niego wchodzić nasycone kwasy karboksylowe; na przykład w reakcji kwasu octowego z chlorem można otrzymać różne chlorowane kwasy:

Podczas halogenowania kwasów karboksylowych zawierających więcej niż jeden atom węgla w reszcie węglowodorowej możliwe jest tworzenie produktów o różnych pozycjach halogenu w cząsteczce. Gdy reakcja zachodzi poprzez mechanizm wolnorodnikowy, dowolne atomy wodoru w reszcie węglowodorowej można zastąpić. Jeżeli reakcję prowadzi się w obecności niewielkich ilości czerwonego fosforu, wówczas przebiega ona selektywnie – wodór zastępuje się jedynie w A-pozycja (przy atomie węgla najbliższym grupie funkcyjnej) w cząsteczce kwasu. Powody tej selektywności poznasz studiując chemię na uczelni wyższej.
Kwasy karboksylowe tworzą różne pochodne funkcjonalne podczas zastąpienia grupy hydroksylowej. Kiedy te pochodne ulegają hydrolizie, ponownie tworzy się kwas karboksylowy.
Chlorek kwasu karboksylowego można otrzymać w reakcji chlorku fosforu(III) lub chlorku tionylu (SOCl2) z kwasem. Bezwodniki kwasów karboksylowych wytwarza się w reakcji bezwodników chloru z solami kwasów karboksylowych. Estry powstają w wyniku estryfikacji kwasów karboksylowych alkoholami. Estryfikacja jest katalizowana przez kwasy nieorganiczne.
Reakcję tę inicjuje protonowanie grupy karboksylowej – oddziaływanie kationu wodoru (protonu) z wolną parą elektronów atomu tlenu. Protonowanie grupy karboksylowej pociąga za sobą wzrost ładunku dodatniego na znajdującym się w niej atomie węgla:

Metody uzyskiwania
Kwasy karboksylowe można otrzymać przez utlenianie pierwszorzędowych alkoholi i aldehydów.
Aromatyczne kwasy karboksylowe powstają w wyniku utleniania homologów benzenu.
Hydroliza różnych pochodnych kwasów karboksylowych powoduje również powstawanie kwasów. Zatem hydroliza estru daje alkohol i kwas karboksylowy. Jak wspomniano powyżej, katalizowane kwasem reakcje estryfikacji i hydrolizy są odwracalne. Hydroliza estru pod wpływem wodnego roztworu zasady przebiega nieodwracalnie, w tym przypadku z estru powstaje nie kwas, ale jego sól. Podczas hydrolizy nitryli najpierw tworzą się amidy, które następnie przekształcają się w kwasy. Kwasy karboksylowe powstają w wyniku oddziaływania organicznych związków magnezu z tlenkiem węgla (IV).
Poszczególni przedstawiciele kwasów karboksylowych i ich znaczenie
Kwas mrówkowy (metanowy) HCOOH jest cieczą o ostrym zapachu i temperaturze wrzenia 100,8°C, dobrze rozpuszczalną w wodzie. Kwas mrówkowy jest trujący i powoduje oparzenia w przypadku kontaktu ze skórą! Kwas ten zawiera parzący płyn wydzielany przez mrówki. Kwas mrówkowy ma właściwości dezynfekujące, dlatego znajduje zastosowanie w przemyśle spożywczym, skórzanym, farmaceutycznym i medycynie. Stosowany jest także do barwienia tkanin i papieru.
Kwas octowy (etanowy) CH3COOH jest bezbarwną cieczą o charakterystycznym ostrym zapachu, mieszalną z wodą w dowolnym stosunku. Wodne roztwory kwasu octowego sprzedawane są pod nazwą ocet (roztwór 3-5%) i esencja octowa (roztwór 70-80%) i znajdują szerokie zastosowanie w przemyśle spożywczym. Kwas octowy jest dobrym rozpuszczalnikiem wielu substancji organicznych i dlatego jest stosowany w farbiarstwie, garbarstwie oraz w przemyśle farb i lakierów. Ponadto kwas octowy jest surowcem do produkcji wielu ważnych technicznie związków organicznych: pozyskuje się z niego m.in. substancje stosowane do zwalczania chwastów – herbicydy. 
Kwas octowy jest głównym składnikiem octu winnego, któremu zawdzięcza charakterystyczny zapach. Jest produktem utleniania etanolu i powstaje z niego podczas przechowywania wina w powietrzu.
Najważniejszymi przedstawicielami wyższych nasyconych kwasów jednozasadowych są kwasy palmitynowy C15H31COOH i stearynowy C17H35COOH. W przeciwieństwie do niższych kwasów, substancje te są stałe i słabo rozpuszczalne w wodzie.
Jednak ich sole – stearyniany i palmityniany – są dobrze rozpuszczalne i mają działanie detergentowe, dlatego nazywane są również mydłami. Wiadomo, że substancje te produkowane są na dużą skalę.
Spośród nienasyconych wyższych kwasów karboksylowych największe znaczenie ma kwas oleinowy C17H33COOH, czyli (CH2)7COOH. Jest to ciecz przypominająca olej, bez smaku i zapachu. Jego sole znajdują szerokie zastosowanie w technice.
Najprostszym przedstawicielem dwuzasadowych kwasów karboksylowych jest kwas szczawiowy (etanodiowy) HOOC-COOH, którego sole występują w wielu roślinach, na przykład szczawiu i szczawiu. Kwas szczawiowy jest bezbarwną substancją krystaliczną, dobrze rozpuszczalną w wodzie. Stosowany jest do polerowania metali, w przemyśle drzewnym i skórzanym.
1. Nienasycony kwas elaidynowy C17H33COOH jest izomerem trans kwasu oleinowego. Zapisz wzór strukturalny tej substancji.
2. Napisz równanie reakcji uwodornienia kwasu oleinowego. Nazwij produkt tej reakcji.
3. Napisz równanie reakcji spalania kwasu stearynowego. Jaka objętość tlenu i powietrza (nie dotyczy) będzie potrzebna do spalenia 568 g kwasu stearynowego?
4. Mieszanka stałych kwasów tłuszczowych - palmitynowego i stearynowego - nazywa się stearyną (z tego powstają czopki stearynowe). Jaka objętość powietrza (nie dotyczy) będzie potrzebna do spalenia dwustugramowej świecy stearynowej, jeśli stearyna zawiera równe masy kwasu palmitynowego i stearynowego? Jaka objętość dwutlenku węgla (n.o.) i masa wody powstają w tym przypadku?
5. Rozwiąż poprzednie zadanie pod warunkiem, że świeca zawiera równe ilości (tą samą liczbę moli) kwasu stearynowego i palmitynowego.
6. Aby usunąć plamy rdzy, potraktuj je roztworem kwasu octowego. Ułóż równania molekularne i jonowe dla reakcji zachodzących w tym przypadku, biorąc pod uwagę, że rdza zawiera tlenek i wodorotlenek żelaza(III) - Fe2O3 i Fe(OH)3. Dlaczego takich plam nie można usunąć wodą? Dlaczego znikają po potraktowaniu roztworem kwasu?
7. Sodę oczyszczoną NaHC03 dodaną do ciasta bezdrożdżowego najpierw „gasi się” kwasem octowym. Wykonaj tę reakcję w domu i napisz jej równanie, wiedząc, że kwas węglowy jest słabszy od kwasu octowego. Wyjaśnij powstawanie piany.
8. Wiedząc, że chlor jest bardziej elektroujemny niż węgiel, uporządkuj kwasy: octowy, propionowy, chlorooctowy, dichlorooctowy i trichlorooctowy według rosnących właściwości kwasowych. Uzasadnij swój wynik.
9. Jak możemy wyjaśnić, że kwas mrówkowy reaguje w reakcji „srebrnego lustra”? Napisz równanie tej reakcji. Jaki gaz może zostać uwolniony w tym przypadku?
10. Gdy 3 g nasyconego jednozasadowego kwasu karboksylowego przereagowało z nadmiarem magnezu, uwolniło się 560 ml (n.s.) wodoru. Określ wzór kwasu.
11. Podaj równania reakcji, którymi można opisać właściwości chemiczne kwasu octowego. Nazwij produkty tych reakcji.
12. Zaproponuj prostą metodę laboratoryjną, dzięki której można rozpoznać kwas propanowy i akrylowy.
13. Napisz równanie reakcji wytwarzania mrówczanu metylu – estru metanolu i kwasu mrówkowego. W jakich warunkach należy przeprowadzić tę reakcję?
14. Utwórz wzory strukturalne substancji o składzie C3H602. Na jakie klasy substancji można je podzielić? Podaj równania reakcji charakterystyczne dla każdego z nich.
15. Substancja A – izomer kwasu octowego – jest nierozpuszczalna w wodzie, ale może ulegać hydrolizie. Jaki jest wzór strukturalny substancji A? Nazwij produkty jego hydrolizy.
16. Ułóż wzory strukturalne następujących substancji:
a) octan metylu;
b) kwas szczawiowy;
c) kwas mrówkowy;
d) kwas dichlorooctowy;
e) octan magnezu;
f) octan etylu;
g) mrówczan etylu;
h) kwas akrylowy.
17*. Próbkę nasyconego jednozasadowego kwasu organicznego o masie 3,7 g zobojętniono wodnym roztworem wodorowęglanu sodu. Po przepuszczeniu wydzielonego gazu przez wodę wapienną otrzymano 5,0 g osadu. Jaki kwas został pobrany i jaka objętość wydzielonego gazu?
Kwasy karboksylowe w przyrodzie
Kwasy karboksylowe są bardzo powszechne w przyrodzie. Występują w owocach i roślinach. Występują w igłach, pocie, moczu i soku z pokrzywy. Wiesz, okazuje się, że większość kwasów tworzy estry, które mają zapach. Tym samym zapach kwasu mlekowego zawarty w ludzkim pocie przyciąga komary, które wyczuwają je z dość dużej odległości. Dlatego bez względu na to, jak bardzo będziesz próbował odeprzeć irytującego komara, nadal dobrze czuje swoją ofiarę. Oprócz ludzkiego potu kwas mlekowy znajduje się w piklach i kiszonej kapuście.
A samice małp, aby zwabić samca, wydzielają kwas octowy i propionowy. Wrażliwy nos psa wyczuwa kwas masłowy, którego stężenie wynosi 10–18 g/cm3.
Wiele gatunków roślin jest zdolnych do wytwarzania kwasu octowego i masłowego. Niektóre chwasty wykorzystują to i uwalniając substancje, eliminują swoich konkurentów, hamując ich wzrost, a czasami powodując ich śmierć.
Indianie również używali kwasu. Aby zniszczyć wroga, namoczyli strzały śmiercionośną trucizną, która okazała się pochodną kwasu octowego.
I tu pojawia się naturalne pytanie: czy kwasy stanowią zagrożenie dla zdrowia człowieka? Przecież kwas szczawiowy, który jest szeroko rozpowszechniony w przyrodzie i występuje w szczawiu, pomarańczach, porzeczkach i malinach, z jakiegoś powodu nie znalazł zastosowania w przemyśle spożywczym. Okazuje się, że kwas szczawiowy jest dwieście razy silniejszy od kwasu octowego i może nawet powodować korozję naczyń, a jego sole gromadząc się w organizmie człowieka tworzą kamienie.
Kwasy znalazły szerokie zastosowanie we wszystkich sferach życia człowieka. Znajdują zastosowanie w medycynie, kosmetyce, przemyśle spożywczym, rolnictwie oraz na potrzeby gospodarstwa domowego.
Do celów medycznych stosuje się kwasy organiczne, takie jak mlekowy, winowy i askorbinowy. Zapewne każdy z Was stosował witaminę C na wzmocnienie organizmu – jest to właśnie kwas askorbinowy. Nie tylko pomaga wzmocnić układ odpornościowy, ale także ma zdolność usuwania substancji rakotwórczych i toksyn z organizmu. Do kauteryzacji stosuje się kwas mlekowy, ponieważ jest wysoce higroskopijny. Ale kwas winowy działa jako łagodny środek przeczyszczający, jako antidotum na zatrucie alkaliami i jako składnik niezbędny do przygotowania osocza do transfuzji krwi.
Ale miłośnicy zabiegów kosmetycznych powinni wiedzieć, że kwasy owocowe zawarte w owocach cytrusowych korzystnie wpływają na skórę, gdyż wnikając w głąb, mogą przyspieszyć proces odnowy skóry. Ponadto zapach owoców cytrusowych działa tonizująco na układ nerwowy.
Czy zauważyłeś, że jagody takie jak żurawina i borówka amerykańska są przechowywane przez długi czas i pozostają świeże. Wiesz dlaczego? Okazuje się, że zawierają kwas benzoesowy, który jest doskonałym konserwantem.
Ale w rolnictwie kwas bursztynowy znalazł szerokie zastosowanie, ponieważ można go wykorzystać do zwiększenia produktywności roślin uprawnych. Może także stymulować wzrost roślin i przyspieszać ich rozwój.
1.Kwasy karboksylowe – są to substancje organiczne zawierające tlen, których cząsteczki zawierają jedną lub więcej grup karboksylowych
(-C OOH ), połączony z rodnikiem węgla lub atomem wodoru.
Grupa karboksylowa zawiera dwie grupy funkcyjne - karbonylową >C=O i hydroksylową -OH, bezpośrednio ze sobą związane:
2. Klasyfikacja
A) Przez liczbę grup karboksylowych w cząsteczce
|
Nazwa |
Przykłady |
|
1) Jednozasadowy |
Metan nowy , kwas mrówkowy Etan nowy , kwas octowy |
|
2) Dwuzasadowy |
HOOC-COOH Kwas szczawiowy |
|
3) Wielozasadowy |
B) Ze względu na charakter rodnika węglowodorowego
|
Nazwa |
Przykłady |
|
1) Limit (nasycony) |
HCOOH Metan nowy , kwas mrówkowy CH3COOH Etan nowy , kwas octowy |
|
2) Nieograniczona |
Kwas akrylowy CH2 = CHCOOH Kwas krotonowy CH3 –CH=CH–COOH Oleinowy CH 3 –(CH 2) 7 –CH=CH–(CH 2) 7 –COOH Linolowy CH 3 –(CH 2) 4 –(CH=CH–CH 2) 2 –(CH 2) 6 –COOH Linolenowy CH 3 –CH 2 –(CH=CH–CH 2) 3 –(CH 2) 6 –COOH |
|
3) Aromatyczny |
C 6 H 5 COOH – kwas benzoesowy NOOS–C 6H 4 –COOH Para-kwas tereftalowy |
3. Izomeria i nazewnictwo
I . Strukturalny
A) Izomeria szkieletu węglowego (począwszy od C 4 )
B) Międzyklasowe z estrami R - CO – O - R 1 (zaczynając od C 2)
Na przykład: dla C 3 H 6 O 2
Kwas propionowy CH3-CH2-COOH
Z Ester metylowy kwasu octowego H3-CO-OCH3
II . Przestrzenny
A) Optyczny
Na przykład:
B) Izomeria cis-trans dla kwasów nienasyconych
Przykład:
4. Nazewnictwo kwasów karboksylowych
Nazwy systematyczne kwasów podaje się nazwą odpowiedniego węglowodoru z dodatkiem przyrostka -nowy i słowa kwas.
Aby wskazać pozycję podstawnika (lub rodnika), numeracja łańcucha węglowego rozpoczyna się od atomu węgla grupy karboksylowej. Na przykład związek o rozgałęzionym łańcuchu węglowym (CH 3) 2 CH-CH 2 -COOH nazywa się Kwas 3-metylobutanowy. Nazwy trywialne są również szeroko stosowane w przypadku kwasów organicznych, które zwykle odzwierciedlają naturalne źródło, w którym po raz pierwszy odkryto te związki.
Niektóre kwasy jednozasadowe
|
Formuła |
Nazwa kwasu R-COOH |
Nazwa pozostałości RCOO - |
|
|
systematyczny |
trywialny |
||
|
HCOOH |
metan |
Mrówka |
mrówczan |
|
CH3COOH |
etan |
ocet |
octan |
|
C2H5COOH |
propan |
propionowy |
propionian |
|
C3H7COOH |
butan |
olej |
maślan |
|
C4H9COOH |
pentan |
waleriana |
walerować |
|
C5H11COOH |
heksan |
nylon |
kaprat |
|
C15H31COOH |
heksadekan |
palmitynowy |
palmitynian |
|
C17H35COOH |
oktadekan |
stearynowy |
stearynian |
|
C6H5COOH |
benzenowęglowy |
benzoes |
benzoesan |
|
CH2=CH-COOH |
propen |
akryl |
akrylan |
W przypadku kwasów wielozasadowych stosuje się przyrostki -diowaja, -triowaja itp.
Na przykład:
HOOC-COOH- kwas etanodiowy (szczawiowy);
HOOC-CH2-COOH- kwas propanodiowy (malonowy).
OGRANICZAJ JEDNOZASADOWE KWASY KARBOKSYLOWE
CnH 2 N +1 - COOHLubCnH 2 NO 2
Szereg homologiczny
|
Nazwa |
Formuła kwasy |
t mł. |
kip. |
ρ |
|
|
kwasy |
|||||
|
Mrówka |
metan |
HCOOH |
100,5 |
1,22 |
|
|
ocet |
etan |
CH3COOH |
16,8 |
1,05 |
|
|
propionowy |
propan |
CH3CH2COOH |
0,99 |
||
|
olej |
butan |
CH3(CH2)2COOH |
0,96 |
||
Struktura grupy karboksylowej
Grupa karboksylowa łączy w sobie dwie grupy funkcyjne – karbonylową >C=O i hydroksylową –OH, które wzajemnie na siebie wpływają:
Kwasowe właściwości kwasów karboksylowych wynikają z przesunięcia gęstości elektronów na tlen karbonylowy i wynikającej z tego dodatkowej (w porównaniu do alkoholi) polaryzacji wiązania O–H.
W roztworze wodnym kwasy karboksylowe dysocjują na jony:
Rozpuszczalność w wodzie i wysokie temperatury wrzenia kwasów wynikają z tworzenia międzycząsteczkowych wiązań wodorowych.
Wraz ze wzrostem masy cząsteczkowej rozpuszczalność kwasów w wodzie maleje.
Właściwości fizyczne nasyconych kwasów jednozasadowych
Dolne elementy tej serii w normalnych warunkach są cieczami o charakterystycznym ostrym zapachu. Na przykład kwas etanowy (octowy) ma charakterystyczny „octowy” zapach. Bezwodny kwas octowy jest cieczą w temperaturze pokojowej; w temperaturze 17°C zamarza, zamieniając się w lodowatą substancję zwaną „lodowatym” kwasem octowym. Środkowi przedstawiciele tej homologicznej serii to lepkie, „oleiste” ciecze; począwszy od C 10 - ciała stałe.
Najprostszy kwas aromatyczny - kwas benzoesowy C 6 H 5 COOH (t.t. 122,4 ° C) - łatwo sublimuje, tj. przechodzi w stan gazowy z pominięciem stanu ciekłego. Po ochłodzeniu jego opary sublimują w kryształy. Ta właściwość służy do oczyszczania substancji z zanieczyszczeń.
DEFINICJA
Kwasy karboksylowe– związki organiczne, których cząsteczki zawierają jedną lub więcej funkcyjnych grup karboksylowych – COOH, związanych z rodnikiem węglowodorowym.
Grupa karboksylowa składa się z grupy karbonylowej > C= O i związana z nią grupa hydroksylowa –OH.
Ogólny wzór kwasów karboksylowych to R – COOH.
Kwasowe właściwości kwasów karboksylowych wynikają z przesunięcia gęstości elektronów w stronę tlenu karbonylowego, co powoduje pojawienie się na atomie częściowego ładunku dodatniego.
W efekcie zwiększa się polarność wiązania O–H i możliwy staje się proces dysocjacji:
Powstały anion jest stabilizowany w wyniku delokalizacji ładunku:

Niższe kwasy karboksylowe zawierające do 3 atomów węgla to bezbarwna ciecz o charakterystycznym ostrym zapachu, mieszająca się z wodą w dowolnym stosunku. Większość kwasów zawierających 4–9 atomów to oleiste ciecze o nieprzyjemnym zapachu. Kwasy zawierające więcej niż 10 atomów wodoru to ciała stałe nierozpuszczalne w wodzie.
Rozpuszczalność kwasów karboksylowych w wodzie i wysokie temperatury wrzenia są związane z powstawaniem międzycząsteczkowych wiązań wodorowych. W stanie stałym kwasy karboksylowe występują głównie w postaci cyklicznych dimerów, w stanie ciekłym występuje także liniowe asocjacja:
Rodzaje kwasów karboksylowych
W zależności od budowy rodnika węglowodorowego kwasy karboksylowe dzielą się na:
- aromatyczny (kwas benzoesowy)
- alifatyczne (nasycone (kwas kapronowy) i nienasycone (kwas akrylowy))
- alicykliczny (kwas chinowy)
- heterocykliczny (kwas nikotynowy).
Ze względu na liczbę grup karboksylowych kwasy karboksylowe dzielą się na:
- jednozasadowy()
- dwuzasadowy (kwas szczawiowy)
- wielozasadowy (kwas cytrynowy).
Kiedy do cząsteczki kwasu wprowadza się inne grupy funkcyjne (–OH, =CO, –NH2 itp.), powstają inne klasy związków: hydroksy, ketokwasy itp.
Ogólny wzór nasyconych jednozasadowych kwasów karboksylowych:
Z N H2nO2 (N= 1,2,3...) lub CnH2n+1COOH (N = 0,1,2…)
Ogólny wzór nienasyconych jednozasadowych kwasów karboksylowych:
Z N H 2 N –2 O 2 (N= 1,2,3...) lub CnH 2 N –1 COOH (N = 0,1,2…)
Ogólny wzór nasyconych dwuzasadowych kwasów karboksylowych:
C n H 2n–2 O 4 (N = 2,3…)
Nazwy i wzory niektórych kwasów karboksylowych
|
Formuła kwasu karboksylowego |
nazwa IUPAC |
Trywialna nazwa |
|---|---|---|
|
Nasycone jednozasadowe kwasy karboksylowe |
||
|
Nienasycone jednozasadowe kwasy karboksylowe |
||
|
Dwuzasadowe kwasy karboksylowe |
||
Przykłady rozwiązywania problemów
PRZYKŁAD 1
| Ćwiczenia | Trzy identyczne probówki bez sygnatur zawierają trzy kwasy: mrówkowy, octowy i solny. Jak na podstawie różnic we właściwościach chemicznych określić, który kwas znajduje się w każdej probówce? |
| Rozwiązanie | Kwas mrówkowy również wykazuje pewne właściwości (redukcyjne). Można więc oznaczyć to np. poprzez reakcję z wodorotlenkiem miedzi(II), w przypadku kwasu mrówkowego powstaje czerwony tlenek miedzi(I): Pozostałe kwasy można rozróżnić w reakcji z azotanem srebra. W przypadku kwasu solnego wytrąca się biały osad chlorku srebra: Octan srebra rozpuszcza się w wodzie, więc w probówce nie zajdą żadne zmiany. Zatem pozostała probówka zawiera kwas octowy. |
PRZYKŁAD 2
| Ćwiczenia | Określ, czy w wyniku hydrolizy próbki o masie 2,64 g wydziela się 1,38 g alkoholu i 1,8 g jednozasadowego kwasu karboksylowego. |
| Rozwiązanie | Ogólny wzór estru składającego się z alkoholu i kwasu o różnej liczbie atomów węgla to: Zatem wzór alkoholu to: a wzór kwasu to: Zapiszmy równanie hydrolizy estrów: Zgodnie z prawem zachowania masy substancji masa produktów reakcji jest równa masie substancji wyjściowych. Obliczmy masę: M(kwas) + m(alkohol) – m(eter) g Obliczmy ilość substancji wodnej: Zgodnie z równaniem reakcji n(kwas) = n(alkohol) mol |
 Ruch ciał pod wpływem grawitacji
Ruch ciał pod wpływem grawitacji Tropy i figury stylistyczne
Tropy i figury stylistyczne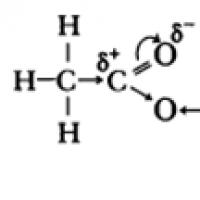 §12. Kwasy karboksylowe. Kwasy karboksylowe: właściwości fizyczne. Sole kwasów karboksylowych Najprostszym kwasem karboksylowym jest kwas mrówkowy
§12. Kwasy karboksylowe. Kwasy karboksylowe: właściwości fizyczne. Sole kwasów karboksylowych Najprostszym kwasem karboksylowym jest kwas mrówkowy Rozmowa z byłą dziewczyną
Rozmowa z byłą dziewczyną Dlaczego marzysz o swoim najlepszym przyjacielu, byłym przyjacielu lub przyjacielu z dzieciństwa?
Dlaczego marzysz o swoim najlepszym przyjacielu, byłym przyjacielu lub przyjacielu z dzieciństwa? Interpretacja snów kobiety w ciąży marzy o dziecku
Interpretacja snów kobiety w ciąży marzy o dziecku Dlaczego marzysz o prądzie iskrowym? Dlaczego śnisz o iskrach? Co piszą w książkach marzeń
Dlaczego marzysz o prądzie iskrowym? Dlaczego śnisz o iskrach? Co piszą w książkach marzeń