§12. Karboksüülhapped. Karboksüülhapped: füüsikalised omadused. Karboksüülhapete soolad Lihtsaim karboksüülhape on sipelghape
MÄÄRATLUS
Nimetatakse orgaanilisi aineid, mille molekulid sisaldavad ühte või mitut süsivesinikradikaaliga seotud karboksüülrühma karboksüülhapped.
Karboksüülhapete homoloogse seeria kolm esimest liiget, sealhulgas propioonhape, on terava lõhnaga ja vees hästi lahustuvad vedelikud. Järgmised homoloogid, alustades võihappest, on samuti tugeva ebameeldiva lõhnaga, kuid vees halvasti lahustuvad vedelikud. Kõrgemad happed süsinikuaatomite arvuga 10 või rohkem on tahked, lõhnatud, vees lahustumatud. Üldiselt väheneb homoloogide seerias molekulmassi suurenemisega lahustuvus vees, tihedus väheneb ja keemistemperatuur tõuseb (tabel 1).
Tabel 1. Karboksüülhapete homoloogsed seeriad.
Karboksüülhapete valmistamine
Karboksüülhapped saadakse küllastunud süsivesinike, alkoholide ja aldehüüdide oksüdeerimisel. Näiteks äädikhape - oksüdeerides etanooli kuumutamisel happelises keskkonnas kaaliumpermanganaadi lahusega:
Karboksüülhapete keemilised omadused
Karboksüülhapete keemilised omadused määravad eelkõige nende struktuuri iseärasused. Seega võivad vees lahustuvad happed dissotsieeruda ioonideks:
R-COOH↔R-COO - + H + .
H + ioonide olemasolu tõttu vees on neil hapu maitse, nad on võimelised muutma indikaatorite värvi ja juhtima elektrivoolu. Vesilahuses on need happed nõrgad elektrolüüdid.
Karboksüülhapetel on anorgaaniliste hapete lahustele iseloomulikud keemilised omadused, s.t. interakteeruvad metallidega (1), nende oksiididega (2), hüdroksiididega (3) ja nõrkade sooladega (4):
2CH3-COOh + Zn → (CH3COO)2Zn + H2 (1);
2CH3-COOH + CuO→ (CH3COO)2Cu + H20 (2);
R-COOH + KOH → R-COOK + H2O (3);
2CH 3 -COOH + NaHCO 3 → CH 3 COONa + H 2 O + CO 2 (4).
Küllastunud ja küllastumata karboksüülhapete spetsiifiline omadus, mis väljendub funktsionaalrühmas, on interaktsioon alkoholidega.
Karboksüülhapped reageerivad kuumutamisel ja kontsentreeritud väävelhappe juuresolekul alkoholidega. Näiteks kui äädikhappele lisatakse etüülalkoholi ja veidi väävelhapet, siis kuumutamisel ilmub etüüläädikhappe (etüülatsetaadi) lõhn:
CH 3 -COOH + C 2 H 5 OH ↔CH 3 -C(O)-O-C 2 H 5 + H 2 O.
Küllastunud karboksüülhapete spetsiifiline omadus, mis avaldub radikaalis, on halogeenimis- (kloorimis) reaktsioon.

Karboksüülhapete rakendamine
Karboksüülhapped on lähteaineks ketoonide, happehalogeniidide, vinüülestrite ja muude oluliste orgaaniliste ühendite klasside tootmisel.
Sipelghapet kasutatakse laialdaselt parfümeerias, nahatööstuses (nahaparkimine), tekstiilitööstuses (värvimise peitsina), lahusti ja säilitusainena kasutatavate estrite saamiseks.
Äädikhappe vesilahust (70-80%) nimetatakse äädika essentsiks ja 3-9% vesilahust lauaäädikaks. Essentsi kasutatakse sageli äädika saamiseks kodus lahjendamise teel.
Näited probleemide lahendamisest
NÄIDE 1
| Harjutus | Milliseid keemilisi reaktsioone saab kasutada järgmiste transformatsioonide läbiviimiseks: a) CH4 → CH3Cl → CH3OH → HCHO → HCOOH → HCOOK. Kirjutage reaktsioonivõrrandid ja märkige nende esinemise tingimused. |
| Vastus | a) Metaani kloorimine valguses põhjustab klorometaani tootmist: CH4 + Cl2 → CH3CI + HCl. Alkaanide halogeenderivaadid hüdrolüüsivad vesi- või aluselises keskkonnas, moodustades alkoholid: CH 3 Cl + NaOH → CH 3 OH + NaCl. Primaarsete alkoholide oksüdeerimisel, näiteks kaaliumdikromaadiga happelises keskkonnas katalüsaatori (Cu, CuO, Pt, Ag) juuresolekul, tekivad aldehüüdid: CH3OH+ [O] →HCHO. Aldehüüdid oksüdeeritakse kergesti vastavateks karboksüülhapeteks, näiteks kaaliumpermanganaadiga: HCHO + [O] → HCOOH. Karboksüülhapetel on kõik nõrkadele mineraalhapetele omased omadused, st. võimelised suhtlema aktiivsete metallidega soolade moodustamiseks: 2HCOOH+ 2K→2HCOOK + H2. |
NÄIDE 2
| Harjutus | Kirjutage reaktsioonivõrrandid järgmiste ainete vahel: a) 2-metüülpropaanhape ja kloor; b) äädikhape ja propanool-2; c) akrüülhape ja broomvesi; d) 2-metüülbutaanhape ja fosfor(V)kloriid. Täpsustage reaktsioonitingimused. |
| Vastus | a) 2-metüülpropaanhappe ja kloori vahelise reaktsiooni tulemusena asendub vesinikuaatom a-asendis paiknevas süsivesinikradikaalis; Tekib 2-metüül-2-kloropropaanhape H3C-C(CH3)H-COOH + Cl2 → H3C-C(CH3)Cl-COOH + HCl (kat = P). b) äädikhappe ja propanool-2 vahelise reaktsiooni tulemusena moodustub ester - äädikhappe isopropüülester. CH3-COOH + CH3-C(OH)H-CH3 → CH3-C(O)-O-C(CH3)-CH3. c) akrüülhappe ja broomivee interaktsioonireaktsiooni tulemusena kaksiksideme kohas halogeeni lisamine vastavalt Markovnikovi reeglile; Tekib 2,3-dibromopropaanhape CH2 =CH-COOH + Br2 → CH2Br-CHBr-COOH d) 2-metüülbutaanhappe ja fosfor(V)kloriidi vahelise reaktsiooni tulemusena tekib vastav happekloriid CH3-CH2-C(CH3)H-COOH + PCl5 →CH3-CH2-C(CH3)H-COOCl + POCl3 + HCl. |
Karboksüülhapped- orgaanilised ained, mille molekulid sisaldavad ühte või mitut karboksüülrühma.
Karboksüülrühm (lühendatult COOH) on karboksüülhapete funktsionaalne rühm ja koosneb karbonüülrühmast ja sellega seotud hüdroksüülrühmast.
Karboksüülrühmade arvu alusel jagatakse karboksüülhapped ühealuselisteks, kahealuselisteks jne.
Ühealuseliste karboksüülhapete üldvalem on R-COOH. Kahealuselise happe näide on oksaalhape HOOC-COOH.
Sõltuvalt radikaali tüübist jaotatakse karboksüülhapped küllastunud (näiteks äädikhape CH 3 COOH), küllastumata [näiteks akrüülhape CH 2 =CH-COOH, oleiinhape CH 3 - (CH 2) 7 -CH =CH—(CH2)7-COOH] ja aromaatne (näiteks bensoe C6H5-COOH).
Isomeerid ja homoloogid
Ühealuselised küllastunud karboksüülhapped R-COOH on estrite (lühendatult R"-COOR") isomeerid, millel on sama arv süsinikuaatomeid. Mõlema üldvalem on C n H 2 n O2.
| G | HCOOH metaan (sipelgas) |
||||
| CH3COOH etaan (äädikhape) | HOOCH 3 sipelghappe metüülester |
||||
| CH3CH2COOH propaan (propioonhape) |
HCOOCH 2 CH 3 etüülsipelghape |
CH 3 COOCH 3 äädikhappe metüülester | |||
| CH3(CH2)2COOH butaan (õli) |
2-metüülpropaan |
HCOOCH 2 CH 2 CH 3 sipelghappe propüülester |
CH 3 COOCH 2 CH 3 etüülatsetaat |
CH 3 CH 2 COOCH 3 propioonhappe metüülester |
|
| isomeerid | |||||
Algoritm karboksüülhapete nimetuste koostamiseks
- Leidke süsiniku selgroog – see on pikim süsinikuaatomite ahel, sealhulgas karboksüülrühma süsinikuaatom.
- Nummerdage peaahela süsinikuaatomid, alustades karboksüüli süsinikuaatomist.
- Nimetage ühend, kasutades süsivesinike algoritmi.
- Nime lõppu lisage järelliide "-ov", lõpp "-aya" ja sõna "hape".
Karboksüülhapete molekulides lk-hüdroksüülrühma hapnikuaatomite elektronid interakteeruvad karbonüülrühma -sideme elektronidega, mille tulemusena suureneb O-H sideme polaarsus, tugevneb -side karbonüülrühmas, osalaeng (+) süsinikuaatomil väheneb ja vesinikuaatomi osalaeng (+) suureneb .
Viimane soodustab tugevate vesiniksidemete teket karboksüülhappemolekulide vahel.
Küllastunud ühealuseliste karboksüülhapete füüsikalised omadused on suuresti tingitud tugevate vesiniksidemete olemasolust molekulide vahel (tugevamad kui alkoholimolekulide vahel). Seetõttu on hapete keemistemperatuurid ja lahustuvus vees kõrgemad kui vastavatel alkoholidel.
Hapete keemilised omadused
-sideme tugevdamine karbonüülrühmas toob kaasa asjaolu, et liitumisreaktsioonid ei ole karboksüülhapetele iseloomulikud.
- Põlemine:
CH3COOH + 2O22CO2 + 2H2O
- Happelised omadused.
OH-sideme kõrge polaarsuse tõttu dissotsieeruvad vesilahuses olevad karboksüülhapped märgatavalt (täpsemalt reageerivad sellega pöörduvalt):HCOOH HCOO - + H + (täpsemalt HCOOH + H 2 O HCOO - + H 3 O +)
Kõik karboksüülhapped on nõrgad elektrolüüdid. Süsinikuaatomite arvu suurenedes hapete tugevus väheneb (O-H sideme polaarsuse vähenemise tõttu); vastupidi, halogeeni aatomite viimine süsivesiniku radikaali toob kaasa happe tugevuse suurenemise. Jah, järjestHCOOH CH 3 COOH C 2 H 5 COOH
hapete tugevus väheneb ja seeriasKasvav.
Karboksüülhapetel on kõik nõrkadele hapetele omased omadused:
Mg + 2CH 3 COOH (CH 3 COO) 2 Mg + H 2
CaO + 2CH 3 COOH (CH 3 COO) 2 Ca + H 2 O
NaOH + CH 3 COOH CH 3 COONa + H 2 O
K 2 CO 3 + 2CH 3 COOH 2CH 3 COOK + H 2 O + CO 2 - Esterdamine (karboksüülhapete reaktsioon alkoholidega, mille tulemusena moodustub ester):
Esterdamisreaktsioonis võivad osaleda ka mitmehüdroksüülsed alkoholid, nagu glütserool. Glütseroolist ja kõrgematest karboksüülhapetest (rasvhapetest) moodustunud estrid on rasvad.Rasvad on triglütseriidide segud. Küllastunud rasvhapped (palmitiin C 15 H 31 COOH, steariin C 17 H 35 COOH) moodustavad loomset päritolu tahkeid rasvu ja küllastumata rasvhapped (oleiinhape C 17 H 33 COOH, linoolhape C 17 H 31 COOH jt) vedelaid rasvu. (õlid) taimset päritolu.
- Asendamine süsivesiniku radikaalis:
Asendamine toimub asendis -.Sipelghappe HCOOH eripära on see, et see aine on bifunktsionaalne ühend, see on nii karboksüülhape kui ka aldehüüd:
Seetõttu reageerib sipelghape muu hulgas hõbeoksiidi ammoniaagilahusega (hõbepeegli reaktsioon; kvalitatiivne reaktsioon):HCOOH + Ag 2 O (ammoniaagilahus) CO 2 + H 2 O + 2Ag
Karboksüülhapete valmistamine
.
O
//
-C aatomite rühma nimetatakse karboksüülrühmaks või karboksüülrühmaks.
\
Oh
Orgaanilised happed, mis sisaldavad molekulis ühte karboksüülrühma, on ühealuselised. Nende hapete üldvalem on RCOOH.
Karboksüülhappeid, mis sisaldavad kahte karboksüülrühma, nimetatakse kahealuselisteks. Nende hulka kuuluvad näiteks oksaal- ja merevaikhape.
On ka mitmealuselisi karboksüülhappeid, mis sisaldavad rohkem kui kahte karboksüülrühma. Nende hulka kuuluvad näiteks kolmealuseline sidrunhape. Sõltuvalt süsivesinikradikaali olemusest jagatakse karboksüülhapped küllastunud, küllastumata ja aromaatseks.
Küllastunud ehk küllastunud karboksüülhapeteks on näiteks propaanhape (propioonhape) või juba tuttav merevaikhape.
Ilmselgelt küllastunud karboksüülhapped ei sisalda P-sidemed süsivesinikradikaalis.
Küllastumata karboksüülhapete molekulides on karboksüülrühm seotud küllastumata, küllastumata süsivesinikradikaaliga, näiteks akrüül- (propeen-) CH2=CH-COOH või oleiin-CH3-(CH2)7-CH=CH-(CH2) molekulides. 7-COOH ja muud happed.
Nagu bensoehappe valemist näha, on see aromaatne, kuna sisaldab molekulis aromaatset (benseeni) ringi.
Nomenklatuur ja isomeeria
Karboksüülhapete, aga ka teiste orgaaniliste ühendite nimetuste moodustamise üldpõhimõtteid oleme juba käsitlenud. Vaatleme üksikasjalikumalt ühe- ja kahealuseliste karboksüülhapete nomenklatuuri. Karboksüülhappe nimetus moodustatakse vastava alkaani (molekulis sama arvu süsinikuaatomite arvuga alkaani) nimest, millele on lisatud järelliide -ov, lõpp -aya ja sõna hape. Süsinikuaatomite nummerdamine algab karboksüülrühmast. Näiteks:
Paljudel hapetel on ka ajalooliselt väljakujunenud või triviaalsed nimed (tabel 6). 
Pärast esimest tutvust orgaaniliste hapete mitmekesise ja huvitava maailmaga käsitleme üksikasjalikumalt küllastunud ühealuselisi karboksüülhappeid.
On selge, et nende hapete koostist kajastab üldvalem C n H 2n O2 või C n H 2n +1 COOH või RCOOH.
Küllastunud ühealuseliste karboksüülhapete füüsikalised omadused
Madalamad happed, s.o suhteliselt väikese molekulmassiga happed, mis sisaldavad kuni nelja süsinikuaatomit molekuli kohta, on iseloomuliku terava lõhnaga vedelikud (pidage meeles äädikhappe lõhna). 4–9 süsinikuaatomit sisaldavad happed on viskoossed õlised vedelikud, millel on ebameeldiv lõhn; mis sisaldavad rohkem kui 9 süsinikuaatomit molekuli kohta – tahked ained, mis ei lahustu vees. Küllastunud ühealuseliste karboksüülhapete keemistemperatuurid tõusevad koos süsinikuaatomite arvu suurenemisega molekulis ja sellest tulenevalt suhtelise molekulmassi suurenemisega. Näiteks sipelghappe keemistemperatuur on 101 °C, äädikhappe 118 °C ja propioonhappe 141 °C.
Lihtsaim karboksüülhape, sipelghape HCOOH, millel on väike suhteline molekulmass (46), on tavatingimustes vedelik, mille keemistemperatuur on 100,8 °C. Samal ajal on butaan (MR(C4H10) = 58) samadel tingimustel gaasiline ja selle keemistemperatuur on -0,5 °C. Seda keemispunktide ja suhteliste molekulmasside lahknevust seletatakse karboksüülhappe dimeeride moodustumisega, milles kaks happemolekuli on seotud kahe vesiniksidemega. Vesiniksidemete esinemine saab selgeks karboksüülhappemolekulide struktuuri arvestades.
Küllastunud ühealuseliste karboksüülhapete molekulid sisaldavad polaarset aatomirühma - karboksüülrühma (mõelge sellele, mis põhjustab selle funktsionaalrühma polaarsuse) ja praktiliselt mittepolaarset süsivesinikradikaali. Karboksüülrühm tõmbab veemolekule, moodustades nendega vesiniksidemeid.
Sipelg- ja äädikhape lahustuvad vees piiramatult. On ilmne, et süsivesinikradikaali aatomite arvu suurenemisega karboksüülhapete lahustuvus väheneb.
Teades karboksüülhappemolekulide koostist ja struktuuri, ei ole meil raske mõista ja selgitada nende ainete keemilisi omadusi.
Keemilised omadused
Hapete klassile (nii orgaanilistele kui anorgaanilistele) iseloomulikud üldised omadused tulenevad hüdroksüülrühma olemasolust molekulides, mis sisaldab väga polaarset sidet vesiniku ja hapniku aatomite vahel. Need omadused on teile hästi teada. Vaatleme neid uuesti vees lahustuvate orgaaniliste hapete näitel.
1. Dissotsiatsioon happejäägi vesinikkatioonide ja anioonide moodustumisega. Täpsemalt kirjeldab seda protsessi võrrand, mis võtab arvesse veemolekulide osalemist selles.
Karboksüülhapete dissotsiatsioonitasakaal nihkub vasakule, valdav enamus neist on nõrgad elektrolüüdid. Sellest hoolimata on näiteks sipelg- ja äädikhappe hapu maitse seletatav happejääkide dissotsieerumisega vesinikkatioonideks ja anioonideks.
On ilmne, et "happelise" vesiniku olemasolu karboksüülhapete molekulides, st karboksüülrühma vesinik, määrab ka muud iseloomulikud omadused.
2. Koostoime metallidega elektrokeemilises pingevahemikus kuni vesinik. Seega redutseerib raud äädikhappest vesinikku:
2CH3-COOH + Fe -> (CHgCOO)2Fe + H2
3. Koostoime aluseliste oksiididega soola ja vee moodustumisel:
2R-COOH + CaO -> (R-COO)2Ca + H20
4. Reaktsioon metallihüdroksiididega soola ja vee moodustumiseks (neutraliseerimisreaktsioon):
R-COOH + NaOH -> R-COONa + H20 3R-COOH + Ca(OH)2 -> (R-COO)2Ca + 2H20
5. Koostoime nõrgemate hapete sooladega, viimaste moodustumisega. Seega tõrjub äädikhape välja steariinhappe naatriumstearaadist ja süsihappe kaaliumkarbonaadist.
6. Karboksüülhapete interaktsioon alkoholidega estrite moodustamiseks on teile juba tuntud esterdamisreaktsioon (üks olulisemaid karboksüülhapetele iseloomulikke reaktsioone). Karboksüülhapete koostoimet alkoholidega katalüüsivad vesiniku katioonid.
Esterdamisreaktsioon on pöörduv. Tasakaal nihkub estri moodustumise suunas veetustajate juuresolekul ja estri eemaldamise suunas reaktsioonisegust.
Esterdamise pöördreaktsioonis, mida nimetatakse estri hüdrolüüsiks (estri reageerimine veega), moodustuvad hape ja alkohol. On ilmne, et mitmehüdroksüülsed alkoholid, näiteks glütserool, võivad samuti reageerida karboksüülhapetega, st esterdada: 
Kõik karboksüülhapped (välja arvatud sipelghape) koos karboksüülrühmaga sisaldavad oma molekulides süsivesinike jääke. Loomulikult ei saa see muud kui mõjutada hapete omadusi, mille määrab süsivesinike jäägi olemus.
7. Liitmisreaktsioonid mitmiksideme juures - neisse sisenevad küllastumata karboksüülhapped; näiteks vesiniku lisamise reaktsioon on hüdrogeenimine. Oleiinhappe hüdrogeenimisel moodustub küllastunud steariinhape.
Küllastumata karboksüülhapped, nagu ka teised küllastumata ühendid, lisavad halogeene kaksiksideme kaudu. Näiteks muudab akrüülhape broomivee värvi.
8. Asendusreaktsioonid (halogeenidega) - sinna võivad siseneda küllastunud karboksüülhapped; Näiteks äädikhappe reageerimisel klooriga võib saada erinevaid klooritud happeid:

Süsivesiniku jäägis rohkem kui ühte süsinikuaatomit sisaldavate karboksüülhapete halogeenimisel on võimalik molekulis halogeeni erineva positsiooniga produktide moodustumine. Kui reaktsioon toimub vabade radikaalide mehhanismi kaudu, saab süsivesiniku jäägis asendada kõik vesinikuaatomid. Kui reaktsioon viiakse läbi väikese koguse punase fosfori juuresolekul, kulgeb see selektiivselt - vesinik asendatakse ainult A-asend (funktsionaalsele rühmale lähimal süsinikuaatomil) happemolekulis. Selle selektiivsuse põhjuseid saad teada kõrgkoolis keemiat õppides.
Karboksüülhapped moodustavad hüdroksüülrühma asendamisel mitmesuguseid funktsionaalseid derivaate. Kui need derivaadid hüdrolüüsitakse, moodustub uuesti karboksüülhape.
Karboksüülhappekloriidi saab valmistada fosfor(III)kloriidi või tionüülkloriidi (SOCl2) reageerimisel happega. Karboksüülhappe anhüdriidid valmistatakse kloorianhüdriidide reageerimisel karboksüülhappe sooladega. Estrid tekivad karboksüülhapete esterdamisel alkoholidega. Esterdamist katalüüsivad anorgaanilised happed.
Selle reaktsiooni käivitab karboksüülrühma protoneerimine – vesinikkatiooni (prootoni) interaktsioon hapnikuaatomi üksiku elektronpaariga. Karboksüülrühma protoneerimine toob kaasa selles sisalduva süsinikuaatomi positiivse laengu suurenemise:

Omandamise meetodid
Karboksüülhappeid saab saada primaarsete alkoholide ja aldehüüdide oksüdeerimisel.
Aromaatsed karboksüülhapped tekivad benseeni homoloogide oksüdeerumisel.
Erinevate karboksüülhappe derivaatide hüdrolüüsil tekivad ka happed. Seega tekib estri hüdrolüüsil alkohol ja karboksüülhape. Nagu eespool mainitud, on happega katalüüsitud esterdamis- ja hüdrolüüsireaktsioonid pöörduvad. Estri hüdrolüüs leelise vesilahuse mõjul kulgeb pöördumatult; sel juhul ei moodustu estrist mitte hape, vaid selle sool. Nitriilide hüdrolüüsi käigus tekivad esmalt amiidid, mis seejärel muudetakse hapeteks. Karboksüülhapped tekivad orgaaniliste magneesiumiühendite vastasmõjul süsinikmonooksiidiga (IV).
Karboksüülhapete üksikud esindajad ja nende tähendus
Sipelghape (metaan) HCOOH on terava lõhnaga vedelik, mille keemistemperatuur on 100,8 °C, vees hästi lahustuv. Sipelghape on mürgine ja põhjustab nahale sattudes põletusi! Sipelgate eritatav nõelamisvedelik sisaldab seda hapet. Sipelghappel on desinfitseerivad omadused ja seetõttu kasutatakse seda toiduainete-, naha- ja farmaatsiatööstuses ning meditsiinis. Seda kasutatakse ka kangaste ja paberi värvimisel.
Äädikhape (etaanhape) CH3COOH on iseloomuliku terava lõhnaga värvitu vedelik, mis seguneb veega mis tahes vahekorras. Äädikhappe vesilahuseid turustatakse äädika (3-5% lahus) ja äädikaessentsi (70-80% lahus) nimetuse all ning neid kasutatakse laialdaselt toiduainetööstuses. Äädikhape on hea lahusti paljudele orgaanilistele ainetele ja seetõttu kasutatakse seda värvimisel, parkimisel ning värvi- ja lakitööstuses. Lisaks on äädikhape tooraine paljude tehniliselt oluliste orgaaniliste ühendite tootmiseks: sellest saadakse näiteks umbrohutõrjeks kasutatavaid aineid – herbitsiidid. 
Äädikhape on veiniäädika põhikomponent, mille iseloomulik lõhn tuleneb sellest. See on etanooli oksüdatsiooni produkt ja tekib sellest veini õhu käes hoidmisel.
Kõrgemate küllastunud ühealuseliste hapete olulisemad esindajad on palmitiinhape C15H31COOH ja steariinhape C17H35COOH. Erinevalt madalamatest hapetest on need ained tahked ja vees halvasti lahustuvad.
Nende soolad – stearaadid ja palmitaadid – on aga hästi lahustuvad ja peseva toimega, mistõttu neid nimetatakse ka seepideks. On selge, et neid aineid toodetakse suures mahus.
Küllastumata kõrgematest karboksüülhapetest on oleiinhape C17H33COOH või (CH2)7COOH kõige olulisem. See on õlitaoline vedelik, millel pole maitset ega lõhna. Selle sooli kasutatakse tehnoloogias laialdaselt.
Kahealuseliste karboksüülhapete lihtsaim esindaja on oksaal- (etaandioe)hape HOOC-COOH, mille sooli leidub paljudes taimedes, näiteks hapuoblikas ja hapuoblikas. Oksaalhape on värvitu kristalne aine, mis lahustub vees hästi. Seda kasutatakse metallide poleerimiseks, puidu- ja nahatööstuses.
1. Küllastumata elaidiinhape C17H33COOH on oleiinhappe trans-isomeer. Kirjutage selle aine struktuurivalem.
2. Kirjutage oleiinhappe hüdrogeenimisreaktsiooni võrrand. Nimetage selle reaktsiooni saadus.
3. Kirjutage steariinhappe põlemisreaktsiooni võrrand. Kui suur hulk hapnikku ja õhku (n.a.) on vaja 568 g steariinhappe põletamiseks?
4. Tahkete rasvhapete – palmitiin- ja steariinhapete – segu nimetatakse steariiniks (sellest valmistatakse steariini ravimküünlad). Kui palju õhku (n.a.) on vaja kahesajagrammise steariinküünla põletamiseks, kui steariin sisaldab võrdses koguses palmitiin- ja steariinhapet? Millise mahuga süsihappegaasi (n.o.) ja vee massi moodustub sel juhul?
5. Lahendage eelnev ülesanne tingimusel, et küünal sisaldab võrdses koguses (sama moolide arvu) steariin- ja palmitiinhapet.
6. Roosteplekkide eemaldamiseks töödelge neid äädikhappe lahusega. Koostage sel juhul toimuvate reaktsioonide jaoks molekulaar- ja ioonvõrrandid, võttes arvesse, et rooste sisaldab raud(III)oksiidi ja hüdroksiidi - Fe2O3 ja Fe(OH)3. Miks selliseid plekke veega ei eemaldata? Miks need happelahusega töötlemisel kaovad?
7. Pärmivabale taignale lisatud söögisoodat “kustutatakse” esmalt äädikhappega. Tehke see reaktsioon kodus ja kirjutage selle võrrand, teades, et süsihape on nõrgem kui äädikhape. Selgitage vahu teket.
8. Teades, et kloor on elektronegatiivsem kui süsinik, järjesta happeliste omaduste suurenemise järjekorras järgmised happed: äädik-, propioon-, kloroäädik-, dikloroäädik- ja trikloroäädikhape. Põhjendage oma tulemust.
9. Kuidas seletada, et sipelghape reageerib “hõbepeegli” reaktsioonis? Kirjutage selle reaktsiooni võrrand. Millist gaasi saab sel juhul vabastada?
10. Kui 3 g küllastunud ühealuselist karboksüülhapet reageeris magneesiumi liiaga, vabanes 560 ml (n.s.) vesinikku. Määrake happe valem.
11. Esitage reaktsioonivõrrandid, mille abil saab kirjeldada äädikhappe keemilisi omadusi. Nimetage nende reaktsioonide produktid.
12. Soovitage välja mõni lihtne laborimeetod, mille järgi tunnete ära propaan- ja akrüülhapped.
13. Kirjutage metüülformiaadi - metanooli ja sipelghappe estri - moodustumise reaktsiooni võrrand. Millistel tingimustel tuleks see reaktsioon läbi viia?
14. Koostage ainete struktuurivalemid koostisega C3H602. Millistesse ainete klassidesse saab neid liigitada? Esitage igale neist iseloomulikud reaktsioonivõrrandid.
15. Aine A – äädikhappe isomeer – ei lahustu vees, kuid võib läbida hüdrolüüsi. Mis on aine A struktuurivalem? Nimetage selle hüdrolüüsi saadused.
16. Koostage järgmiste ainete struktuurivalemid:
a) metüülatsetaat;
b) oksaalhape;
c) sipelghape;
d) dikloroäädikhape;
e) magneesiumatsetaat;
f) etüülatsetaat;
g) etüülformiaat;
h) akrüülhape.
17*. 3,7 g kaaluv küllastunud ühealuselise orgaanilise happe proov neutraliseeriti naatriumvesinikkarbonaadi vesilahusega. Vabanenud gaasi läbi lubjavee juhtimisel saadi 5,0 g setet. Millist hapet võeti ja kui palju gaasi eraldus?
Karboksüülhapped looduses
Karboksüülhapped on looduses väga levinud. Neid leidub puuviljades ja taimedes. Neid leidub nõelates, higis, uriinis ja nõgesemahlas. Teate, selgub, et suurem osa hapetest moodustavad estreid, millel on lõhn. Seega tõmbab inimese higis sisalduv piimhappe lõhn sääski ligi, nad tajuvad seda üsna kaugelt. Seega, ükskõik kui palju sa ka ei üritaks tüütut sääske minema ajada, tunneb ta end oma ohvrina siiski hästi. Piimhapet leidub lisaks inimese higile hapukurgis ja hapukapsas.
Ja emased ahvid eritavad isase meelitamiseks äädik- ja propioonhapet. Koera tundlik nina tunneb võihappe lõhna, mille kontsentratsioon on 10–18 g/cm3.
Paljud taimeliigid on võimelised tootma äädik- ja võihapet. Ja mõned umbrohud kasutavad seda ära ja kõrvaldavad aineid vabastades oma konkurendid, pärssides nende kasvu ja mõnikord põhjustades nende surma.
Indiaanlased kasutasid ka hapet. Vaenlase hävitamiseks leotasid nad nooled surmava mürgiga, mis osutus äädikhappe derivaadiks.
Ja siin tekib loomulik küsimus: kas happed kujutavad endast ohtu inimeste tervisele? Looduses laialt levinud oblikhape, mida leidub hapuoblikas, apelsinides, sõstardes ja vaarikates, pole ju millegipärast toiduainetööstuses rakendust leidnud. Selgub, et oksaalhape on kakssada korda tugevam kui äädikhape ja võib isegi nõusid söövitada ning selle soolad, mis kogunevad inimkehasse, moodustavad kive.
Happed on leidnud laialdast rakendust kõigis inimelu valdkondades. Neid kasutatakse meditsiinis, kosmetoloogias, toiduainetööstuses, põllumajanduses ja majapidamises.
Meditsiinilistel eesmärkidel kasutatakse orgaanilisi happeid, nagu piim-, viin- ja askorbiinhape. Tõenäoliselt kasutas igaüks teist keha tugevdamiseks C-vitamiini – see on just askorbiinhape. See mitte ainult ei aita tugevdada immuunsüsteemi, vaid sellel on ka võime eemaldada kehast kantserogeene ja toksiine. Piimhapet kasutatakse kauteriseerimiseks, kuna see on väga hügroskoopne. Kuid viinhape toimib kerge lahtistina, leelisemürgistuse vastumürgina ja komponendina, mis on vajalik plasma ettevalmistamiseks vereülekandeks.
Kuid kosmeetiliste protseduuride fännid peaksid teadma, et tsitrusviljades sisalduvatel puuviljahapetel on nahale kasulik mõju, kuna sügavale tungides võivad need kiirendada naha uuenemisprotsessi. Lisaks on tsitrusviljade lõhnal toniseeriv mõju närvisüsteemile.
Kas olete märganud, et marjad nagu jõhvikad ja pohlad säilivad kaua ja püsivad värskena. Kas sa tead, miks? Selgub, et need sisaldavad bensoehapet, mis on suurepärane säilitusaine.
Kuid põllumajanduses on merevaikhapet laialdaselt kasutatud, kuna seda saab kasutada kultuurtaimede tootlikkuse suurendamiseks. Samuti võib see stimuleerida taimede kasvu ja kiirendada nende arengut.
1.Karboksüülhapped – need on hapnikku sisaldavad orgaanilised ained, mille molekulid sisaldavad ühte või mitut karboksüülrühma
(-C OOH ), mis on ühendatud süsinikuradikaali või vesinikuaatomiga.
Karboksüülrühm sisaldab kahte funktsionaalset rühma - karbonüül>C=O ja hüdroksüül-OH, mis on üksteisega vahetult seotud:
2. Klassifikatsioon
A) Molekulis olevate karboksüülrühmade arvu järgi
|
Nimi |
Näited |
|
1) Ühealuseline |
metaan uus , sipelghape Etaan uus , äädikhape |
|
2) Kahealuseline |
HOOC-COOH Oksaalhape |
|
3) Polübaasiline |
B) Süsivesinikradikaali olemuse järgi
|
Nimi |
Näited |
|
1) Piirang (küllastunud) |
HCOOH metaan uus , sipelghape CH3COOH Etaan uus , äädikhape |
|
2) Piiramatu |
Akrüülhape CH2 = CHCOOH Kroonhape CH 3 –CH=CH–COOH oleiinhape CH 3 – (CH 2) 7 –CH=CH– (CH 2) 7 –COOH Linoolhape CH 3 – (CH 2) 4 – (CH=CH–CH 2) 2 – (CH 2) 6 –COOH Linoleen CH 3 –CH 2 – (CH=CH–CH 2) 3 – (CH 2) 6 –COOH |
|
3) aromaatne |
C 6 H 5 COOH – bensoehape NOOS-C6H4-COOH Paari- tereftaalhape |
3. Isomerism ja nomenklatuur
I . Struktuurne
A) Süsiniku skeleti isomeeria (alates C 4 )
B) Interclass estritega R - CO - O - R 1 (alates C 2-st)
Näiteks: C3H6O2 jaoks
CH3-CH2-COOH propioonhape
KOOS äädikhappe H3-CO-OCH3-metüülester
II . Ruumiline
A) Optiline
Näiteks:
B) Küllastumata hapete cis-trans-isomeeria
Näide:
4. Karboksüülhapete nomenklatuur
Hapete süstemaatilised nimetused antakse vastava süsivesiniku nimetuse järgi, millele on lisatud järelliide - uus ja sõnad hape.
Asendaja (või radikaali) asukoha näitamiseks algab süsinikuahela nummerdamine karboksüülrühma süsinikuaatomist. Näiteks hargnenud süsinikuahelaga (CH 3) 2 CH-CH 2 -COOH ühendit nimetatakse 3-metüülbutaanhape. Orgaaniliste hapete kohta kasutatakse laialdaselt ka triviaalseid nimetusi, mis tavaliselt peegeldavad looduslikku allikat, kust ühendid esmakordselt avastati.
Mõned ühealuselised happed
|
Valem |
Happe nimetus R-COOH |
Jäägi nimi RCOO - |
|
|
süstemaatiline |
triviaalne |
||
|
HCOOH |
metaan |
ant |
formiaat |
|
CH3COOH |
etaan |
äädikas |
atsetaat |
|
C2H5COOH |
propaan |
propioonhape |
propionaat |
|
C3H7COOH |
butaan |
õli |
butüraat |
|
C4H9COOH |
pentaan |
palderjan |
valeraat |
|
C5H11COOH |
heksaan |
nailon |
kaprat |
|
C15H31COOH |
heksadekaan |
palmiitne |
palmitaat |
|
C17H35COOH |
oktadekaan |
steariin |
stearaat |
|
C6H5COOH |
benseensüsinik |
bensoe |
bensoaat |
|
CH2=CH-COOH |
propeen |
akrüül |
akrülaat |
Mitmealuseliste hapete puhul kasutatakse järelliiteid -diovaya, -triovaya jne.
Näiteks:
HOOC-COOH- etaandiohape (oksaalhape);
HOOC-CH 2 -COOH - propaandiohape (maloonhape).
PIIRITA MONOBAASI KARBOKSÜÜLHAPETE SUHTES
CnH 2 n +1 - COOHvõiCnH 2 nO 2
Homoloogne seeria
|
Nimi |
Valem happed |
t pl. |
t kip. |
ρ |
|
|
happed |
|||||
|
ant |
metaan |
HCOOH |
100,5 |
1,22 |
|
|
äädikas |
etaan |
CH3COOH |
16,8 |
1,05 |
|
|
propioonhape |
propaan |
CH3CH2COOH |
0,99 |
||
|
õli |
butaan |
CH3(CH2)2COOH |
0,96 |
||
Karboksüülrühma struktuur
Karboksüülrühm ühendab kaks funktsionaalset rühma - karbonüül>C = O ja hüdroksüül-OH, mis mõjutavad üksteist vastastikku:
Karboksüülhapete happelised omadused on tingitud elektronide tiheduse nihkest karbonüülhapnikuks ja sellest tulenevast O-H sideme täiendavast (võrreldes alkoholidega) polarisatsioonist.
Vesilahuses dissotsieeruvad karboksüülhapped ioonideks:
Vees lahustuvus ja hapete kõrge keemistemperatuur on tingitud molekulidevaheliste vesiniksidemete moodustumisest.
Molekulmassi suurenemisega väheneb hapete lahustuvus vees.
Küllastunud ühealuseliste hapete füüsikalised omadused
Selle seeria alumised liikmed on tavatingimustes iseloomuliku terava lõhnaga vedelikud. Näiteks etaanhappel (äädikhappel) on iseloomulik "äädikhappeline" lõhn. Veevaba äädikhape on toatemperatuuril vedelik; 17 °C juures külmub, muutudes jäiseks aineks, mida nimetatakse jää-äädikhappeks. Selle homoloogse seeria keskmised esindajad on viskoossed, “õlised” vedelikud; alates C 10 - tahked ained.
Lihtsaim aromaatne hape - bensoehape C 6 H 5 COOH (mp 122,4 ° C) - sublimeerub kergesti, s.t. muutub vedelast olekust mööda minnes gaasiliseks. Jahtumisel sublimeeruvad selle aurud kristallideks. Seda omadust kasutatakse aine puhastamiseks lisanditest.
MÄÄRATLUS
Karboksüülhapped– orgaanilised ühendid, mille molekulid sisaldavad ühte või mitut funktsionaalset karboksüülrühma – COOH, mis on seotud süsivesinikradikaaliga.
Karboksüülrühm koosneb karbonüülrühmast > C= O ja sellega seotud hüdroksüülrühm –OH.
Karboksüülhapete üldvalem on R-COOH.
Karboksüülhapete happelised omadused tulenevad elektrontiheduse nihkest karbonüülhapniku suhtes, mis põhjustab aatomile osalise positiivse laengu ilmnemise.
Selle tulemusena suureneb O-H sideme polaarsus ja dissotsiatsiooniprotsess muutub võimalikuks:
Saadud anioon stabiliseerub laengu ümberpaigutamise tõttu:

Madalamad karboksüülhapped, mis sisaldavad kuni 3 süsinikuaatomit, on iseloomuliku terava lõhnaga värvitud vedelikud, mis segunevad veega mis tahes vahekorras. Enamik 4–9 aatomit sisaldavaid happeid on ebameeldiva lõhnaga õlised vedelikud. Rohkem kui 10 vesinikuaatomit sisaldavad happed on vees lahustumatud tahked ained.
Karboksüülhapete lahustuvus vees ja kõrged keemistemperatuurid on seotud molekulidevaheliste vesiniksidemete tekkega. Tahkes olekus esinevad karboksüülhapped peamiselt tsükliliste dimeeride kujul ja vedelas olekus toimub ka lineaarne seos:
Karboksüülhapete tüübid
Sõltuvalt süsivesinikradikaali struktuurist jaotatakse karboksüülhapped:
- aromaatne (bensoehape)
- alifaatsed (küllastunud (kaproonhape) ja küllastumata (akrüülhape))
- alitsükliline (kiinhape)
- heterotsükliline (nikotiinhape).
Karboksüülrühmade arvu järgi jagatakse karboksüülhapped järgmisteks osadeks:
- monobase ()
- kahealuseline (oksaalhape)
- mitmealuseline (sidrunhape).
Teiste funktsionaalrühmade (–OH, =CO, –NH2 jt) viimisel happemolekuli tekivad teised ühendite klassid: hüdroksü-, ketohapped jne.
Küllastunud ühealuseliste karboksüülhapete üldvalem:
KOOS n H2nO2 (n= 1,2,3...) või Cn H 2n+1 COOH (n = 0,1,2…)
Küllastumata ühealuseliste karboksüülhapete üldvalem:
KOOS n H 2 n –2 O 2 (n= 1,2,3...) või CnH 2 n –1 COOH (n = 0,1,2…)
Küllastunud kahealuseliste karboksüülhapete üldvalem:
C n H 2n–2 O 4 (n = 2,3…)
Mõnede karboksüülhapete nimetused ja valemid
|
Karboksüülhappe valem |
IUPAC nimi |
Triviaalne nimi |
|---|---|---|
|
Küllastunud ühealuselised karboksüülhapped |
||
|
Küllastumata ühealuselised karboksüülhapped |
||
|
Kahealuselised karboksüülhapped |
||
Näited probleemide lahendamisest
NÄIDE 1
| Harjutus | Kolm identset katseklaasi ilma allkirjadeta sisaldavad kolme hapet: sipelghapet, äädikhapet ja vesinikkloriidhapet. Kuidas saate nende keemiliste omaduste erinevuste põhjal kindlaks teha, milline hape on igas katseklaasis? |
| Lahendus | Sipelghappel on ka mõned omadused (redutseeriv). Seetõttu saab seda määrata näiteks reaktsioonil vask(II)hüdroksiidiga, sipelghappe puhul tekib punane vask(I)oksiid: Ülejäänud happeid saab eristada reaktsiooniga hõbenitraadiga. Vesinikkloriidhappe puhul sadestub valge hõbekloriidi sade: Hõbedaatsetaat lahustub vees, mistõttu katseklaasis muutusi ei toimu. Seega sisaldab järelejäänud katseklaas äädikhapet. |
NÄIDE 2
| Harjutus | Määrata, kas 2,64 g kaaluva proovi hüdrolüüsil eraldub 1,38 g alkoholi ja 1,8 g ühealuselist karboksüülhapet. |
| Lahendus | Erineva arvu süsinikuaatomitega alkoholist ja happest koosneva estri üldvalem on: Seega on alkoholi valem järgmine: ja happe valem on: Kirjutame estri hüdrolüüsi võrrandi: Vastavalt ainete massi jäävuse seadusele on reaktsioonisaaduste mass võrdne lähteainete massiga. Arvutame massi: M(hape) + m(alkohol) – m(eeter) g Arvutame veekoguse: Vastavalt reaktsioonivõrrandile n(hape) = n(alkohol) mol |
 Kehade liikumine gravitatsiooni mõjul
Kehade liikumine gravitatsiooni mõjul Troobid ja stiilifiguurid
Troobid ja stiilifiguurid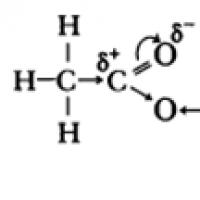 §12. Karboksüülhapped. Karboksüülhapped: füüsikalised omadused. Karboksüülhapete soolad Lihtsaim karboksüülhape on sipelghape
§12. Karboksüülhapped. Karboksüülhapped: füüsikalised omadused. Karboksüülhapete soolad Lihtsaim karboksüülhape on sipelghape Vestlus endise tüdruksõbraga
Vestlus endise tüdruksõbraga Miks sa unistad oma parimast sõbrast, endisest sõbrast või lapsepõlvesõbrast?
Miks sa unistad oma parimast sõbrast, endisest sõbrast või lapsepõlvesõbrast? Raseda naise unenägude tõlgendus unistab lapsest
Raseda naise unenägude tõlgendus unistab lapsest Miks unistad sädevoolust? Miks sa unistad sädemetest? Mida nad unenägude raamatutes kirjutavad
Miks unistad sädevoolust? Miks sa unistad sädemetest? Mida nad unenägude raamatutes kirjutavad