§12. Carbonsäuren. Carbonsäuren: physikalische Eigenschaften. Salze von Carbonsäuren Die einfachste Carbonsäure ist Ameisensäure
DEFINITION
Als organische Stoffe werden organische Stoffe bezeichnet, deren Moleküle eine oder mehrere Carboxylgruppen verbunden mit einem Kohlenwasserstoffrest enthalten Carbonsäuren.
Die ersten drei Mitglieder der homologen Reihe von Carbonsäuren, einschließlich Propionsäure, sind Flüssigkeiten mit stechendem Geruch und gut wasserlöslich. Die folgenden Homologen, beginnend mit Buttersäure, sind ebenfalls Flüssigkeiten, die einen starken unangenehmen Geruch haben, aber in Wasser schlecht löslich sind. Höhere Säuren mit einer Kohlenstoffzahl von 10 oder mehr sind fest, geruchlos und wasserunlöslich. Im Allgemeinen nimmt bei einer Reihe von Homologen mit zunehmendem Molekulargewicht die Löslichkeit in Wasser ab, die Dichte nimmt ab und der Siedepunkt steigt (Tabelle 1).
Tabelle 1. Homologe Reihe von Carbonsäuren.
Herstellung von Carbonsäuren
Carbonsäuren werden durch Oxidation gesättigter Kohlenwasserstoffe, Alkohole und Aldehyde gewonnen. Zum Beispiel Essigsäure – durch Oxidation von Ethanol mit einer Kaliumpermanganatlösung in einer sauren Umgebung beim Erhitzen:
Chemische Eigenschaften von Carbonsäuren
Die chemischen Eigenschaften von Carbonsäuren werden in erster Linie durch die Besonderheiten ihrer Struktur bestimmt. So können wasserlösliche Säuren in Ionen dissoziieren:
R-COOH↔R-COO - + H + .
Aufgrund des Vorhandenseins von H + -Ionen im Wasser haben sie einen säuerlichen Geschmack, können die Farbe von Indikatoren ändern und elektrischen Strom leiten. In wässriger Lösung sind diese Säuren schwache Elektrolyte.
Carbonsäuren haben chemische Eigenschaften, die für Lösungen anorganischer Säuren charakteristisch sind, d.h. interagieren mit Metallen (1), ihren Oxiden (2), Hydroxiden (3) und schwachen Salzen (4):
2CH 3 -COOh + Zn → (CH 3 COO) 2 Zn + H 2 (1);
2CH 3 -COOH + CuO→ (CH 3 COO) 2 Cu + H 2 O (2);
R-COOH + KOH → R-COOK + H 2 O (3);
2CH 3 -COOH + NaHCO 3 → CH 3 COONa + H 2 O + CO 2 (4).
Eine spezifische Eigenschaft gesättigter und ungesättigter Carbonsäuren, die sich in der funktionellen Gruppe manifestiert, ist die Wechselwirkung mit Alkoholen.
Carbonsäuren reagieren mit Alkoholen beim Erhitzen und in Gegenwart von konzentrierter Schwefelsäure. Wenn der Essigsäure beispielsweise Ethylalkohol und etwas Schwefelsäure zugesetzt werden, entsteht beim Erhitzen der Geruch von Ethylessigsäure (Ethylacetat):
CH 3 -COOH + C 2 H 5 OH ↔CH 3 -C(O)-O-C 2 H 5 + H 2 O.
Eine besondere Eigenschaft gesättigter Carbonsäuren, die sich im Radikal manifestiert, ist die Halogenierungsreaktion (Chlorierung).

Anwendung von Carbonsäuren
Carbonsäuren dienen als Ausgangsstoff für die Herstellung von Ketonen, Säurehalogeniden, Vinylestern und anderen wichtigen Klassen organischer Verbindungen.
Ameisensäure wird häufig zur Gewinnung von Estern verwendet, die in der Parfümerie, in der Lederindustrie (Berben von Leder), in der Textilindustrie (als Beizmittel zum Färben), als Lösungsmittel und Konservierungsmittel verwendet werden.
Eine wässrige Lösung (70–80 %) Essigsäure wird Essigessenz genannt, eine 3–9 %ige wässrige Lösung wird Tafelessig genannt. Die Essenz wird oft verwendet, um durch Verdünnung Essig zu Hause herzustellen.
Beispiele für Problemlösungen
BEISPIEL 1
| Übung | Mit welchen chemischen Reaktionen können folgende Umwandlungen durchgeführt werden: a) CH 4 → CH 3 Cl → CH 3 OH → HCHO → HCOOH → HCOOK. Schreiben Sie die Reaktionsgleichungen auf und geben Sie die Bedingungen für ihr Auftreten an. |
| Antwort | a) Die Chlorierung von Methan im Licht führt zur Bildung von Chlormethan: CH 4 + Cl 2 →CH 3 Cl + HCl. Halogenderivate von Alkanen hydrolysieren in wässrigem oder alkalischem Medium zu Alkoholen: CH 3 Cl + NaOH → CH 3 OH + NaCl. Durch die Oxidation primärer Alkohole, beispielsweise mit Kaliumdichromat in saurer Umgebung in Gegenwart eines Katalysators (Cu, CuO, Pt, Ag), entstehen Aldehyde: CH 3 OH+ [O] →HCHO. Aldehyde lassen sich beispielsweise mit Kaliumpermanganat leicht zu den entsprechenden Carbonsäuren oxidieren: HCHO + [O] →HCOOH. Carbonsäuren weisen alle Eigenschaften schwacher Mineralsäuren auf, d. h. kann mit aktiven Metallen unter Bildung von Salzen interagieren: 2HCOOH+ 2K→2HCOOK + H 2 . |
BEISPIEL 2
| Übung | Schreiben Sie die Reaktionsgleichungen zwischen den folgenden Stoffen: a) 2-Methylpropansäure und Chlor; b) Essigsäure und Propanol-2; c) Acrylsäure und Bromwasser; d) 2-Methylbutansäure und Phosphor(V)chlorid. Geben Sie die Reaktionsbedingungen an. |
| Antwort | a) durch die Reaktion zwischen 2-Methylpropansäure und Chlor wird das Wasserstoffatom im in a-Position befindlichen Kohlenwasserstoffrest ersetzt; Es entsteht 2-Methyl-2-chlorpropansäure H 3 C-C(CH 3)H-COOH + Cl 2 → H 3 C-C(CH 3)Cl-COOH + HCl (kat = P). b) Durch die Reaktion zwischen Essigsäure und Propanol-2 entsteht ein Ester – Isopropylester der Essigsäure. CH 3 -COOH + CH 3 -C(OH)H-CH 3 → CH 3 -C(O)-O-C(CH 3)-CH 3 . c) als Ergebnis der Wechselwirkungsreaktion zwischen Acrylsäure und Bromwasser erfolgt die Addition eines Halogens an der Stelle der Doppelbindung gemäß der Markownikow-Regel; Es entsteht 2,3-Dibrompropansäure CH 2 =CH-COOH + Br 2 → CH 2 Br-CHBr-COOH d) Durch die Reaktion zwischen 2-Methylbutansäure und Phosphor(V)chlorid entsteht das entsprechende Säurechlorid CH 3 -CH 2 -C(CH 3)H-COOH + PCl 5 →CH 3 -CH 2 -C(CH 3)H-COOCl + POCl 3 + HCl. |
Carbonsäuren- organische Stoffe, deren Moleküle eine oder mehrere Carboxylgruppen enthalten.
Die Carboxylgruppe (abgekürzt COOH) ist eine funktionelle Gruppe von Carbonsäuren und besteht aus einer Carbonylgruppe und einer zugehörigen Hydroxylgruppe.
Basierend auf der Anzahl der Carboxylgruppen werden Carbonsäuren in einbasische, zweibasische usw. unterteilt.
Die allgemeine Formel einbasiger Carbonsäuren lautet R-COOH. Ein Beispiel für eine zweibasische Säure ist Oxalsäure HOOC-COOH.
Basierend auf der Art des Radikals werden Carbonsäuren in gesättigte (z. B. Essigsäure CH 3 COOH), ungesättigte [z. B. Acrylsäure CH 2 =CH-COOH, Ölsäure CH 3 -(CH 2) 7 -CH =CH-(CH 2) 7 -COOH] und aromatisch (zum Beispiel Benzoesäure C 6 H 5 -COOH).
Isomere und Homologe
Einbasige gesättigte Carbonsäuren R-COOH sind Isomere von Estern (abgekürzt R"-COOR") mit der gleichen Anzahl an Kohlenstoffatomen. Die allgemeine Formel für beide lautet C N H 2 N O2.
| G | HCOOH Methan (Ameise) |
||||
| CH3COOH Ethan (Essigsäure) | HCOOCH 3 Ameisensäuremethylester |
||||
| CH3CH2COOH Propan (Propionsäure) |
HCOOCH 2 CH 3 Ethylameisensäure |
CH 3 COOCH 3 Essigsäuremethylester | |||
| CH3(CH2)2COOH Butan (Öl) |
2-Methylpropan |
HCOOCH 2 CH 2 CH 3 Propylester der Ameisensäure |
CH 3 COOCH 2 CH 3 Ethylacetat |
CH 3 CH 2 COOCH 3 Propionsäuremethylester |
|
| Isomere | |||||
Algorithmus zum Zusammensetzen der Namen von Carbonsäuren
- Finden Sie das Kohlenstoffrückgrat – dies ist die längste Kette von Kohlenstoffatomen, einschließlich des Kohlenstoffatoms der Carboxylgruppe.
- Nummerieren Sie die Kohlenstoffatome in der Hauptkette, beginnend mit dem Carboxyl-Kohlenstoffatom.
- Benennen Sie die Verbindung mit dem Algorithmus für Kohlenwasserstoffe.
- Fügen Sie am Ende des Namens das Suffix „-ov“, die Endung „-aya“ und das Wort „acid“ hinzu.
In Molekülen von Carbonsäuren P-Elektronen der Sauerstoffatome der Hydroxylgruppe interagieren mit Elektronen der -Bindung der Carbonylgruppe, wodurch die Polarität der O-H-Bindung zunimmt, die -Bindung in der Carbonylgruppe stärker wird, die Teilladung (+) am Kohlenstoffatom nimmt ab und die Teilladung (+) am Wasserstoffatom nimmt zu.
Letzteres fördert die Bildung starker Wasserstoffbrückenbindungen zwischen Carbonsäuremolekülen.
Die physikalischen Eigenschaften gesättigter einbasiger Carbonsäuren beruhen größtenteils auf dem Vorhandensein starker Wasserstoffbrückenbindungen zwischen Molekülen (stärker als zwischen Alkoholmolekülen). Daher sind die Siedepunkte und die Löslichkeit von Säuren in Wasser höher als die der entsprechenden Alkohole.
Chemische Eigenschaften von Säuren
Die Stärkung der -Bindung in der Carbonylgruppe führt dazu, dass Additionsreaktionen für Carbonsäuren uncharakteristisch sind.
- Verbrennung:
CH 3 COOH + 2O 2 2CO 2 + 2H 2 O
- Saure Eigenschaften.
Aufgrund der hohen Polarität der O-H-Bindung dissoziieren Carbonsäuren in wässriger Lösung merklich (genauer gesagt reagieren sie reversibel damit):HCOOH HCOO - + H + (genauer HCOOH + H 2 O HCOO - + H 3 O +)
Alle Carbonsäuren sind schwache Elektrolyte. Mit zunehmender Zahl der Kohlenstoffatome nimmt die Stärke der Säuren ab (aufgrund einer Abnahme der Polarität der O-H-Bindung); im Gegenteil, die Einführung von Halogenatomen in den Kohlenwasserstoffrest führt zu einer Erhöhung der Säurestärke. Ja, hintereinanderHCOOH CH 3 COOH C 2 H 5 COOH
die Stärke der Säuren nimmt ab, und zwar in der ReiheZunehmend.
Carbonsäuren weisen alle Eigenschaften schwacher Säuren auf:
Mg + 2CH 3 COOH (CH 3 COO) 2 Mg + H 2
CaO + 2CH 3 COOH (CH 3 COO) 2 Ca + H 2 O
NaOH + CH 3 COOH CH 3 COONa + H 2 O
K 2 CO 3 + 2CH 3 COOH 2CH 3 COOK + H 2 O + CO 2 - Veresterung (Reaktion von Carbonsäuren mit Alkoholen unter Bildung eines Esters):
An der Veresterungsreaktion können auch mehrwertige Alkohole wie Glycerin beteiligt sein. Ester aus Glycerin und höheren Carbonsäuren (Fettsäuren) sind Fette.Fette sind Gemische aus Triglyceriden. Gesättigte Fettsäuren (Palmitinsäure C 15 H 31 COOH, Stearinsäure C 17 H 35 COOH) bilden feste Fette tierischen Ursprungs und ungesättigte Fettsäuren (Ölsäure C 17 H 33 COOH, Linolsäure C 17 H 31 COOH usw.) bilden flüssige Fette (Öle) pflanzlichen Ursprungs.
- Substitution in einem Kohlenwasserstoffrest:
Die Substitution erfolgt in der --Position.Die Besonderheit von Ameisensäure HCOOH besteht darin, dass es sich bei dieser Substanz um eine bifunktionelle Verbindung handelt; sie ist sowohl eine Carbonsäure als auch ein Aldehyd:
Daher reagiert unter anderem Ameisensäure mit einer Ammoniaklösung von Silberoxid (Silberspiegelreaktion; qualitative Reaktion):HCOOH + Ag 2 O (Ammoniaklösung) CO 2 + H 2 O + 2Ag
Herstellung von Carbonsäuren
.
Ö
//
Die Gruppe der -C-Atome wird Carboxylgruppe oder Carboxyl genannt.
\
OH
Organische Säuren, die eine Carboxylgruppe im Molekül enthalten, sind einbasisch. Die allgemeine Formel dieser Säuren ist RCOOH.
Carbonsäuren, die zwei Carboxylgruppen enthalten, werden als zweibasig bezeichnet. Hierzu zählen beispielsweise Oxal- und Bernsteinsäure.
Es gibt auch mehrbasische Carbonsäuren mit mehr als zwei Carboxylgruppen. Hierzu zählt beispielsweise die dreibasische Zitronensäure. Abhängig von der Art des Kohlenwasserstoffrests werden Carbonsäuren in gesättigte, ungesättigte und aromatische Carbonsäuren unterteilt.
Gesättigte bzw. gesättigte Carbonsäuren sind beispielsweise Propansäure (Propionsäure) oder die bereits bekannte Bernsteinsäure.
Gesättigte Carbonsäuren sind offensichtlich nicht enthalten P-Bindungen in einem Kohlenwasserstoffrest.
In Molekülen ungesättigter Carbonsäuren ist die Carboxylgruppe mit einem ungesättigten, ungesättigten Kohlenwasserstoffrest verbunden, beispielsweise in Molekülen von Acrylsäure (Propensäure) CH2=CH-COOH oder Ölsäure CH3-(CH2)7-CH=CH-(CH2). 7-COOH und andere Säuren.
Wie aus der Formel der Benzoesäure hervorgeht, ist sie aromatisch, da sie einen aromatischen (Benzol-)Ring im Molekül enthält.
Nomenklatur und Isomerie
Wir haben bereits die allgemeinen Prinzipien der Namensbildung von Carbonsäuren sowie anderen organischen Verbindungen betrachtet. Lassen Sie uns näher auf die Nomenklatur ein- und zweibasiger Carbonsäuren eingehen. Der Name einer Carbonsäure wird aus dem Namen des entsprechenden Alkans (Alkan mit der gleichen Anzahl an Kohlenstoffatomen im Molekül) unter Hinzufügung des Suffixes -ov, der Endung -aya und dem Wort Säure gebildet. Die Nummerierung der Kohlenstoffatome beginnt mit der Carboxylgruppe. Zum Beispiel:
Viele Säuren haben auch historisch etablierte oder triviale Namen (Tabelle 6). 
Nach unserer ersten Bekanntschaft mit der vielfältigen und interessanten Welt der organischen Säuren werden wir die gesättigten einbasischen Carbonsäuren genauer betrachten.
Es ist klar, dass die Zusammensetzung dieser Säuren durch die allgemeine Formel C n H 2n O2 oder C n H 2n +1 COOH oder RCOOH widergespiegelt wird.
Physikalische Eigenschaften gesättigter einbasiger Carbonsäuren
Niedere Säuren, also Säuren mit relativ geringem Molekulargewicht und bis zu vier Kohlenstoffatomen pro Molekül, sind Flüssigkeiten mit einem charakteristischen stechenden Geruch (denken Sie an den Geruch von Essigsäure). Säuren mit 4 bis 9 Kohlenstoffatomen sind viskose, ölige Flüssigkeiten mit unangenehmem Geruch; mit mehr als 9 Kohlenstoffatomen pro Molekül – Feststoffe, die sich nicht in Wasser lösen. Die Siedepunkte gesättigter einbasiger Carbonsäuren steigen mit zunehmender Anzahl von Kohlenstoffatomen im Molekül und folglich mit zunehmendem relativen Molekulargewicht. Beispielsweise beträgt der Siedepunkt von Ameisensäure 101 °C, von Essigsäure 118 °C und von Propionsäure 141 °C.
Die einfachste Carbonsäure, Ameisensäure HCOOH, hat ein kleines relatives Molekulargewicht (46) und ist unter normalen Bedingungen eine Flüssigkeit mit einem Siedepunkt von 100,8 °C. Gleichzeitig ist Butan (MR(C4H10) = 58) unter gleichen Bedingungen gasförmig und hat einen Siedepunkt von -0,5 °C. Diese Diskrepanz zwischen Siedepunkten und relativen Molekulargewichten wird durch die Bildung von Carbonsäuredimeren erklärt, bei denen zwei Säuremoleküle durch zwei Wasserstoffbrückenbindungen verbunden sind. Das Vorkommen von Wasserstoffbrückenbindungen wird deutlich, wenn man die Struktur von Carbonsäuremolekülen betrachtet.
Moleküle gesättigter einbasiger Carbonsäuren enthalten eine polare Atomgruppe – Carboxyl (denken Sie darüber nach, was die Polarität dieser funktionellen Gruppe verursacht) und einen praktisch unpolaren Kohlenwasserstoffrest. Die Carboxylgruppe wird von Wassermolekülen angezogen und bildet mit ihnen Wasserstoffbrückenbindungen.
Ameisen- und Essigsäure sind in Wasser unbegrenzt löslich. Es ist offensichtlich, dass mit zunehmender Anzahl von Atomen in einem Kohlenwasserstoffrest die Löslichkeit von Carbonsäuren abnimmt.
Da wir die Zusammensetzung und Struktur von Carbonsäuremolekülen kennen, wird es uns nicht schwer fallen, die chemischen Eigenschaften dieser Stoffe zu verstehen und zu erklären.
Chemische Eigenschaften
Die allgemeinen Eigenschaften, die für die Klasse der Säuren (sowohl organische als auch anorganische) charakteristisch sind, sind auf das Vorhandensein einer Hydroxylgruppe in den Molekülen zurückzuführen, die eine hochpolare Bindung zwischen Wasserstoff- und Sauerstoffatomen enthält. Diese Eigenschaften sind Ihnen wohlbekannt. Betrachten wir sie noch einmal am Beispiel wasserlöslicher organischer Säuren.
1. Dissoziation unter Bildung von Wasserstoffkationen und Anionen des Säurerestes. Genauer gesagt wird dieser Prozess durch eine Gleichung beschrieben, die die Beteiligung von Wassermolekülen daran berücksichtigt.
Das Dissoziationsgleichgewicht der Carbonsäuren ist nach links verschoben, die überwiegende Mehrheit davon sind schwache Elektrolyte. Dennoch erklärt sich der saure Geschmack von beispielsweise Ameisen- und Essigsäure durch die Dissoziation saurer Reste in Wasserstoffkationen und Anionen.
Es liegt auf der Hand, dass das Vorhandensein von „saurem“ Wasserstoff in den Molekülen von Carbonsäuren, also dem Wasserstoff der Carboxylgruppe, auch andere charakteristische Eigenschaften bestimmt.
2. Wechselwirkung mit Metallen im elektrochemischen Spannungsbereich bis hin zu Wasserstoff. So reduziert Eisen Wasserstoff aus Essigsäure:
2CH3-COOH + Fe -> (CHgCOO)2Fe + H2
3. Wechselwirkung mit basischen Oxiden unter Bildung von Salz und Wasser:
2R-COOH + CaO -> (R-COO)2Ca + H20
4. Reaktion mit Metallhydroxiden zu Salz und Wasser (Neutralisationsreaktion):
R-COOH + NaOH -> R-COONa + H20 3R-COOH + Ca(OH)2 -> (R-COO)2Ca + 2H20
5. Wechselwirkung mit Salzen schwächerer Säuren unter deren Bildung. So verdrängt Essigsäure Stearinsäure aus Natriumstearat und Kohlensäure aus Kaliumcarbonat.
6. Die Wechselwirkung von Carbonsäuren mit Alkoholen unter Bildung von Estern ist die Ihnen bereits bekannte Veresterungsreaktion (eine der wichtigsten für Carbonsäuren charakteristischen Reaktionen). Die Wechselwirkung von Carbonsäuren mit Alkoholen wird durch Wasserstoffkationen katalysiert.
Die Veresterungsreaktion ist reversibel. Das Gleichgewicht verschiebt sich in Richtung der Bildung des Esters in Gegenwart von Entwässerungsmitteln und der Entfernung des Esters aus der Reaktionsmischung.
Bei der Rückreaktion der Veresterung, der sogenannten Esterhydrolyse (Reaktion eines Esters mit Wasser), entstehen eine Säure und ein Alkohol. Es liegt auf der Hand, dass auch mehrwertige Alkohole, beispielsweise Glycerin, mit Carbonsäuren reagieren, also eine Veresterungsreaktion eingehen können: 
Alle Carbonsäuren (außer Ameisensäure) enthalten neben der Carboxylgruppe einen Kohlenwasserstoffrest in ihren Molekülen. Dies kann natürlich nur Auswirkungen auf die Eigenschaften von Säuren haben, die durch die Art des Kohlenwasserstoffrückstands bestimmt werden.
7. Additionsreaktionen an einer Mehrfachbindung – in sie gehen ungesättigte Carbonsäuren ein; Beispielsweise ist die Reaktion der Wasserstoffaddition eine Hydrierung. Bei der Hydrierung von Ölsäure entsteht gesättigte Stearinsäure.
Ungesättigte Carbonsäuren addieren wie andere ungesättigte Verbindungen Halogene über eine Doppelbindung. Acrylsäure verfärbt beispielsweise Bromwasser.
8. Substitutionsreaktionen (mit Halogenen) – darin können gesättigte Carbonsäuren eintreten; Durch die Reaktion von Essigsäure mit Chlor können beispielsweise verschiedene chlorierte Säuren erhalten werden:

Bei der Halogenierung von Carbonsäuren mit mehr als einem Kohlenstoffatom im Kohlenwasserstoffrest ist die Bildung von Produkten mit unterschiedlichen Positionen des Halogens im Molekül möglich. Wenn eine Reaktion über einen Mechanismus freier Radikale abläuft, können alle Wasserstoffatome im Kohlenwasserstoffrest ersetzt werden. Wird die Reaktion in Gegenwart geringer Mengen roten Phosphors durchgeführt, verläuft sie selektiv – Wasserstoff wird nur in ersetzt A-Position (am Kohlenstoffatom, das der funktionellen Gruppe am nächsten liegt) im Säuremolekül. Die Gründe für diese Selektivität erfahren Sie im Studium der Chemie an einer Hochschule.
Carbonsäuren bilden beim Austausch der Hydroxylgruppe verschiedene funktionelle Derivate. Bei der Hydrolyse dieser Derivate entsteht erneut Carbonsäure.
Carbonsäurechlorid kann durch Reaktion von Phosphor(III)-chlorid oder Thionylchlorid (SOCl 2) mit Säure hergestellt werden. Carbonsäureanhydride werden durch Reaktion von Chloranhydriden mit Carbonsäuresalzen hergestellt. Ester entstehen durch die Veresterung von Carbonsäuren mit Alkoholen. Die Veresterung wird durch anorganische Säuren katalysiert.
Diese Reaktion wird durch Protonierung der Carboxylgruppe eingeleitet – die Wechselwirkung eines Wasserstoffkations (Proton) mit dem freien Elektronenpaar des Sauerstoffatoms. Die Protonierung einer Carboxylgruppe führt zu einer Erhöhung der positiven Ladung des darin enthaltenen Kohlenstoffatoms:

Methoden zur Beschaffung
Carbonsäuren können durch Oxidation primärer Alkohole und Aldehyde gewonnen werden.
Aromatische Carbonsäuren entstehen durch Oxidation von Benzolhomologen.
Auch bei der Hydrolyse verschiedener Carbonsäurederivate entstehen Säuren. Somit entstehen bei der Hydrolyse eines Esters ein Alkohol und eine Carbonsäure. Wie oben erwähnt, sind säurekatalysierte Veresterungs- und Hydrolysereaktionen reversibel. Die Hydrolyse des Esters unter dem Einfluss einer wässrigen Alkalilösung verläuft irreversibel; in diesem Fall entsteht aus dem Ester keine Säure, sondern deren Salz. Bei der Hydrolyse von Nitrilen entstehen zunächst Amide, die dann in Säuren umgewandelt werden. Carbonsäuren entstehen durch die Wechselwirkung organischer Magnesiumverbindungen mit Kohlenmonoxid (IV).
Einzelne Vertreter der Carbonsäuren und ihre Bedeutung
Ameisensäure (Methan) HCOOH ist eine Flüssigkeit mit stechendem Geruch und einem Siedepunkt von 100,8 °C, die gut wasserlöslich ist. Ameisensäure ist giftig und verursacht bei Hautkontakt Verätzungen! Die von Ameisen abgesonderte Brennflüssigkeit enthält diese Säure. Ameisensäure hat desinfizierende Eigenschaften und findet daher Verwendung in der Lebensmittel-, Leder- und Pharmaindustrie sowie in der Medizin. Es wird auch zum Färben von Stoffen und Papier verwendet.
Essigsäure (Ethansäure) CH3COOH ist eine farblose Flüssigkeit mit einem charakteristischen stechenden Geruch, die in jedem Verhältnis mit Wasser mischbar ist. Wässrige Essigsäurelösungen werden unter den Bezeichnungen Essig (3-5 %ige Lösung) und Essigessenz (70-80 %ige Lösung) vermarktet und in der Lebensmittelindustrie häufig eingesetzt. Essigsäure ist ein gutes Lösungsmittel für viele organische Stoffe und wird daher in der Färberei, Gerberei sowie in der Farben- und Lackindustrie eingesetzt. Darüber hinaus ist Essigsäure ein Rohstoff für die Herstellung vieler technisch wichtiger organischer Verbindungen: So werden beispielsweise Wirkstoffe zur Unkrautbekämpfung – Herbizide – daraus gewonnen. 
Essigsäure ist der Hauptbestandteil des Weinessigs, der ihm seinen charakteristischen Geruch verdankt. Es ist ein Produkt der Ethanoloxidation und entsteht daraus, wenn Wein an der Luft gelagert wird.
Die wichtigsten Vertreter der höher gesättigten einbasigen Säuren sind die Palmitinsäure C15H31COOH und die Stearinsäure C17H35COOH. Im Gegensatz zu niederen Säuren sind diese Stoffe fest und in Wasser schlecht löslich.
Ihre Salze – Stearate und Palmitate – sind jedoch gut löslich und haben eine reinigende Wirkung, weshalb sie auch Seifen genannt werden. Es ist klar, dass diese Stoffe in großem Maßstab hergestellt werden.
Von den ungesättigten höheren Carbonsäuren ist die Ölsäure C17H33COOH oder (CH2)7COOH von größter Bedeutung. Es ist eine ölartige Flüssigkeit ohne Geschmack und Geruch. Seine Salze werden in der Technik häufig eingesetzt.
Der einfachste Vertreter der zweibasischen Carbonsäuren ist die Oxalsäure (Ethandisäure) HOOC-COOH, deren Salze in vielen Pflanzen, beispielsweise Sauerampfer und Sauerampfer, vorkommen. Oxalsäure ist eine farblose kristalline Substanz, die in Wasser gut löslich ist. Es wird zum Polieren von Metallen in der Holz- und Lederindustrie verwendet.
1. Ungesättigte Elaidinsäure C17H33COOH ist ein trans-Isomer der Ölsäure. Schreiben Sie die Strukturformel dieser Substanz.
2. Schreiben Sie eine Gleichung für die Hydrierungsreaktion von Ölsäure. Nennen Sie das Produkt dieser Reaktion.
3. Schreiben Sie eine Gleichung für die Verbrennungsreaktion von Stearinsäure. Welche Menge Sauerstoff und Luft (n.a.) wird benötigt, um 568 g Stearinsäure zu verbrennen?
4. Eine Mischung aus festen Fettsäuren – Palmitinsäure und Stearinsäure – wird Stearin genannt (aus dieser werden Stearin-Zäpfchen hergestellt). Welches Luftvolumen (n.a.) ist erforderlich, um eine 200-Gramm-Stearinkerze zu verbrennen, wenn Stearin gleiche Massen an Palmitin- und Stearinsäure enthält? Welche Menge Kohlendioxid (n.o.) und welche Masse Wasser entstehen dabei?
5. Lösen Sie das vorherige Problem unter der Voraussetzung, dass die Kerze gleiche Mengen (gleiche Molzahl) Stearin- und Palmitinsäure enthält.
6. Um Rostflecken zu entfernen, behandeln Sie diese mit einer Essigsäurelösung. Stellen Sie molekulare und ionische Gleichungen für die in diesem Fall ablaufenden Reaktionen auf und berücksichtigen Sie dabei, dass Rost Eisen(III)-oxid und -hydroxid – Fe2O3 und Fe(OH)3 – enthält. Warum werden solche Flecken nicht mit Wasser entfernt? Warum verschwinden sie, wenn sie mit einer Säurelösung behandelt werden?
7. Dem hefefreien Teig zugesetztes Natron NaHC03 wird zunächst mit Essigsäure „abgeschreckt“. Führen Sie diese Reaktion zu Hause durch und schreiben Sie die Gleichung auf, wobei Sie wissen, dass Kohlensäure schwächer als Essigsäure ist. Erklären Sie die Schaumbildung.
8. Da Chlor elektronegativer als Kohlenstoff ist, ordnen Sie die folgenden Säuren an: Essigsäure, Propionsäure, Chloressigsäure, Dichloressigsäure und Trichloressigsäure in der Reihenfolge zunehmender saurer Eigenschaften. Begründen Sie Ihr Ergebnis.
9. Wie können wir erklären, dass Ameisensäure in einer „Silberspiegel“-Reaktion reagiert? Schreiben Sie eine Gleichung für diese Reaktion. Welches Gas kann in diesem Fall freigesetzt werden?
10. Bei der Reaktion von 3 g gesättigter einbasiger Carbonsäure mit überschüssigem Magnesium wurden 560 ml (n.s.) Wasserstoff freigesetzt. Bestimmen Sie die Formel der Säure.
11. Geben Sie Reaktionsgleichungen an, mit denen sich die chemischen Eigenschaften von Essigsäure beschreiben lassen. Nennen Sie die Produkte dieser Reaktionen.
12. Schlagen Sie eine einfache Labormethode vor, mit der Sie Propan- und Acrylsäure erkennen können.
13. Schreiben Sie eine Gleichung für die Reaktion zur Herstellung von Methylformiat – einem Ester aus Methanol und Ameisensäure. Unter welchen Bedingungen sollte diese Reaktion durchgeführt werden?
14. Bilden Sie Strukturformeln von Stoffen mit der Zusammensetzung C3H602. In welche Stoffklassen können sie eingeteilt werden? Geben Sie die für jeden von ihnen charakteristischen Reaktionsgleichungen an.
15. Substanz A – ein Isomer der Essigsäure – ist in Wasser unlöslich, kann aber hydrolysieren. Wie lautet die Strukturformel der Substanz A? Nennen Sie die Produkte seiner Hydrolyse.
16. Stellen Sie die Strukturformeln der folgenden Stoffe auf:
a) Methylacetat;
b) Oxalsäure;
c) Ameisensäure;
d) Dichloressigsäure;
e) Magnesiumacetat;
f) Ethylacetat;
g) Ethylformiat;
h) Acrylsäure.
17*. Eine Probe gesättigter einbasiger organischer Säure mit einem Gewicht von 3,7 g wurde mit einer wässrigen Natriumbicarbonatlösung neutralisiert. Durch Durchleiten des freigesetzten Gases durch Kalkwasser wurden 5,0 g Sediment erhalten. Welche Säure wurde entnommen und wie viel Gas wurde freigesetzt?
Carbonsäuren in der Natur
Carbonsäuren kommen in der Natur sehr häufig vor. Sie kommen in Früchten und Pflanzen vor. Sie kommen in Nadeln, Schweiß, Urin und Brennnesselsaft vor. Wissen Sie, es stellt sich heraus, dass der Großteil der Säuren Ester bildet, die Gerüche haben. So lockt der Geruch von Milchsäure, die im menschlichen Schweiß enthalten ist, Mücken an, die ihn schon aus großer Entfernung wahrnehmen. Egal wie sehr Sie versuchen, die lästige Mücke zu vertreiben, sie fühlt sich dennoch wohl bei ihrem Opfer. Milchsäure kommt neben menschlichem Schweiß auch in Gurken und Sauerkraut vor.
Und weibliche Affen scheiden Essig- und Propionsäure aus, um ein Männchen anzulocken. Die empfindliche Nase eines Hundes kann Buttersäure riechen, die eine Konzentration von 10–18 g/cm3 hat.
Viele Pflanzenarten sind in der Lage, Essig- und Buttersäure zu produzieren. Und einige Unkräuter machen sich dies zunutze und vernichten durch die Freisetzung von Substanzen ihre Konkurrenten, unterdrücken ihr Wachstum und führen manchmal zu ihrem Tod.
Auch die Indianer verwendeten Säure. Um den Feind zu vernichten, tränkten sie die Pfeile mit einem tödlichen Gift, das sich als Essigsäurederivat herausstellte.
Und hier stellt sich natürlich die Frage: Stellen Säuren eine Gefahr für die menschliche Gesundheit dar? Schließlich hat Oxalsäure, die in der Natur weit verbreitet ist und in Sauerampfer, Orangen, Johannisbeeren und Himbeeren vorkommt, aus irgendeinem Grund keine Anwendung in der Lebensmittelindustrie gefunden. Es stellt sich heraus, dass Oxalsäure zweihundertmal stärker ist als Essigsäure und sogar Geschirr angreifen kann und ihre Salze, die sich im menschlichen Körper ansammeln, Steine bilden.
Säuren haben in allen Bereichen des menschlichen Lebens breite Anwendung gefunden. Sie werden in der Medizin, Kosmetik, Lebensmittelindustrie, Landwirtschaft und für den Haushaltsbedarf eingesetzt.
Für medizinische Zwecke werden organische Säuren wie Milchsäure, Weinsäure und Ascorbinsäure verwendet. Wahrscheinlich hat jeder von Ihnen Vitamin C zur Stärkung des Körpers verwendet – genau das ist Ascorbinsäure. Es stärkt nicht nur das Immunsystem, sondern hat auch die Fähigkeit, Karzinogene und Giftstoffe aus dem Körper zu entfernen. Zur Kauterisation wird Milchsäure verwendet, da diese stark hygroskopisch ist. Weinsäure wirkt jedoch als mildes Abführmittel, als Gegenmittel bei Alkalivergiftungen und als notwendiger Bestandteil für die Plasmavorbereitung für Bluttransfusionen.
Fans kosmetischer Eingriffe sollten jedoch wissen, dass die in Zitrusfrüchten enthaltenen Fruchtsäuren eine wohltuende Wirkung auf die Haut haben, da sie tief eindringen und den Prozess der Hauterneuerung beschleunigen können. Darüber hinaus wirkt der Duft von Zitrusfrüchten tonisierend auf das Nervensystem.
Ist Ihnen aufgefallen, dass Beeren wie Preiselbeeren und Preiselbeeren lange gelagert werden und frisch bleiben? Weißt du, warum? Es stellt sich heraus, dass sie Benzoesäure enthalten, die ein ausgezeichnetes Konservierungsmittel ist.
Aber auch in der Landwirtschaft hat Bernsteinsäure breite Anwendung gefunden, da sie zur Steigerung der Produktivität von Kulturpflanzen eingesetzt werden kann. Es kann auch das Pflanzenwachstum stimulieren und ihre Entwicklung beschleunigen.
1.Carbonsäuren – dabei handelt es sich um sauerstoffhaltige organische Stoffe, deren Moleküle eine oder mehrere Carboxylgruppen enthalten
(-COOH ), verbunden mit einem Kohlenstoffradikal oder Wasserstoffatom.
Die Carboxylgruppe enthält zwei funktionelle Gruppen – Carbonyl >C=O und Hydroxyl –OH, die direkt aneinander gebunden sind:
2. Klassifizierung
A) Durch die Anzahl der Carboxylgruppen im Molekül
|
Name |
Beispiele |
|
1) Monobasisch |
Methan neu , Ameisensäure Ethan neu , Essigsäure |
|
2) Dibasisch |
HOOC-COOH Oxalsäure |
|
3) Polybasisch |
B) Durch die Natur des Kohlenwasserstoffrestes
|
Name |
Beispiele |
|
1) Grenzwert (gesättigt) |
HCOOH Methan neu , Ameisensäure CH3COOH Ethan neu , Essigsäure |
|
2) Unbegrenzt |
Acrylsäure CH 2 = CHCOOH Crotonsäure CH 3 –CH=CH–COOH Ölsäure CH 3 –(CH 2) 7 –CH=CH–(CH 2) 7 –COOH Linolsäure CH 3 –(CH 2) 4 –(CH=CH–CH 2) 2 –(CH 2) 6 –COOH Linolensäure CH 3 –CH 2 –(CH=CH–CH 2) 3 –(CH 2) 6 –COOH |
|
3) Aromatisch |
C 6 H 5 COOH – Benzoesäure NOOS–C 6 H 4 –COOH Paar-Terephthalsäure |
3. Isomerie und Nomenklatur
ICH . Strukturell
A) Isomerie des Kohlenstoffgerüsts (ausgehend von C 4 )
B) Interklasse mit Estern R - CO – O - R 1 (ausgehend von C 2)
Zum Beispiel: für C 3 H 6 O 2
CH 3 -CH 2 -COOH-Propionsäure
MIT H 3 -CO -OCH 3 Methylester der Essigsäure
II . Räumlich
A) Optisch
Zum Beispiel:
B) Cis-trans-Isomerie für ungesättigte Säuren
Beispiel:
4. Nomenklatur der Carbonsäuren
Systematische Säurenamen werden durch den Namen des entsprechenden Kohlenwasserstoffs mit Zusatz eines Suffixes angegeben -neu und Worte Säure.
Um die Position des Substituenten (oder Radikals) anzuzeigen, beginnt die Nummerierung der Kohlenstoffkette beim Kohlenstoffatom der Carboxylgruppe. Beispielsweise wird eine Verbindung mit einer verzweigten Kohlenstoffkette (CH 3) 2 CH-CH 2 -COOH genannt 3-Methylbutansäure. Auch für organische Säuren werden häufig Trivialnamen verwendet, die in der Regel die natürliche Quelle widerspiegeln, aus der die Verbindungen erstmals entdeckt wurden.
Einige einbasige Säuren
|
Formel |
Säurename R-COOH |
Rückstandsname RCOO - |
|
|
systematisch |
trivial |
||
|
HCOOH |
Methan |
Ameise |
formatieren |
|
CH3COOH |
Ethan |
Essig |
Acetat |
|
C2H5COOH |
Propan |
Propionsäure |
Propionat |
|
C3H7COOH |
Butan |
Öl |
Butyrat |
|
C4H9COOH |
Pentan |
Baldrian |
wertschätzen |
|
C5H11COOH |
Hexan |
Nylon |
caprat |
|
C15H31COOH |
Hexadecan |
palmitisch |
palmitieren |
|
C17H35COOH |
Octadecan |
Stearinsäure |
Stearat |
|
C6H5COOH |
Benzolkohlensäure |
Benzoe |
Benzoat |
|
CH 2 =CH-COOH |
Propen |
Acryl |
Acrylat |
Für mehrbasische Säuren werden Suffixe verwendet -diovaya, -triovaya usw.
Zum Beispiel:
HOOC-COOH- Ethandisäure (Oxalsäure);
HOOC-CH 2 -COOH - Propandisäure (Malonsäure).
Begrenzen Sie monobasische Carbonsäuren
CnH 2 N +1 - COOHoderCnH 2 NÖ 2
Homologe serie
|
Name |
Formel Säuren |
t pl. |
Ich kippe nicht. |
ρ |
|
|
Säuren |
|||||
|
Ameise |
Methan |
HCOOH |
100,5 |
1,22 |
|
|
Essig |
Ethan |
CH3COOH |
16,8 |
1,05 |
|
|
Propionsäure |
Propan |
CH3CH2COOH |
0,99 |
||
|
Öl |
Butan |
CH3(CH2)2COOH |
0,96 |
||
Die Struktur der Carboxylgruppe
Die Carboxylgruppe vereint zwei funktionelle Gruppen – Carbonyl >C = O und Hydroxyl –OH, die sich gegenseitig beeinflussen:
Die sauren Eigenschaften von Carbonsäuren beruhen auf einer Verschiebung der Elektronendichte zum Carbonylsauerstoff und der daraus resultierenden (im Vergleich zu Alkoholen) zusätzlichen Polarisierung der O-H-Bindung.
In einer wässrigen Lösung dissoziieren Carbonsäuren in Ionen:
Die Wasserlöslichkeit und der hohe Siedepunkt von Säuren sind auf die Bildung intermolekularer Wasserstoffbrückenbindungen zurückzuführen.
Mit zunehmendem Molekulargewicht nimmt die Löslichkeit von Säuren in Wasser ab.
Physikalische Eigenschaften gesättigter einbasiger Säuren
Die unteren Vertreter dieser Reihe sind unter normalen Bedingungen Flüssigkeiten mit einem charakteristischen stechenden Geruch. Beispielsweise hat Essigsäure (Essigsäure) einen charakteristischen „Essigsäure“-Geruch. Wasserfreie Essigsäure ist bei Raumtemperatur eine Flüssigkeit; Bei 17 °C gefriert es und verwandelt sich in eine eisige Substanz namens „Eisessig“. Die mittleren Vertreter dieser homologen Reihe sind viskose, „ölige“ Flüssigkeiten; ausgehend von C 10 - Feststoffe.
Die einfachste aromatische Säure – Benzoesäure C 6 H 5 COOH (Fp. 122,4 °C) – sublimiert leicht, d.h. geht unter Umgehung des flüssigen Zustands in einen gasförmigen Zustand über. Beim Abkühlen sublimieren seine Dämpfe zu Kristallen. Diese Eigenschaft wird genutzt, um einen Stoff von Verunreinigungen zu reinigen.
DEFINITION
Carbonsäuren– organische Verbindungen, deren Moleküle eine oder mehrere funktionelle Carboxylgruppen – COOH, verbunden mit einem Kohlenwasserstoffrest enthalten.
Die Carboxylgruppe besteht aus einer Carbonylgruppe > C= Ö und die zugehörige Hydroxylgruppe –OH.
Die allgemeine Formel der Carbonsäuren lautet R–COOH.
Die sauren Eigenschaften von Carbonsäuren beruhen auf einer Verschiebung der Elektronendichte zum Carbonylsauerstoff, die das Auftreten einer teilweise positiven Ladung am Atom verursacht.
Dadurch erhöht sich die Polarität der O-H-Bindung und der Dissoziationsprozess wird möglich:
Das resultierende Anion wird durch Ladungsdelokalisierung stabilisiert:

Niedere Carbonsäuren mit bis zu 3 Kohlenstoffatomen sind farblose Flüssigkeiten mit einem charakteristischen stechenden Geruch, die in jedem Verhältnis mit Wasser mischbar sind. Die meisten Säuren mit 4–9 Kohlenstoffatomen sind ölige Flüssigkeiten mit unangenehmem Geruch. Säuren mit mehr als 10 Wasserstoffatomen sind wasserunlösliche Feststoffe.
Die Löslichkeit von Carbonsäuren in Wasser und hohe Siedepunkte sind mit der Bildung intermolekularer Wasserstoffbrücken verbunden. Im festen Zustand liegen Carbonsäuren hauptsächlich in Form zyklischer Dimere vor, im flüssigen Zustand kommt es auch zu linearer Assoziation:
Arten von Carbonsäuren
Abhängig von der Struktur des Kohlenwasserstoffrests werden Carbonsäuren unterteilt in:
- aromatisch (Benzoesäure)
- aliphatisch (gesättigt (Capronsäure) und ungesättigt (Acrylsäure))
- alicyclisch (Chinasäure)
- heterozyklisch (Nikotinsäure).
Basierend auf der Anzahl der Carboxylgruppen werden Carbonsäuren unterteilt in:
- Monobase()
- zweibasisch (Oxalsäure)
- mehrbasisch (Zitronensäure).
Wenn andere funktionelle Gruppen (–OH, =CO, –NH2 usw.) in das Säuremolekül eingeführt werden, entstehen andere Verbindungsklassen: Hydroxy-, Ketosäuren usw.
Allgemeine Formel gesättigter einbasiger Carbonsäuren:
MIT N H2nO2 (N= 1,2,3...) oder Cn H 2n+1 COOH (N = 0,1,2…)
Allgemeine Formel ungesättigter einbasiger Carbonsäuren:
MIT N H 2 N –2 Ö 2 (N= 1,2,3...) oder CnH 2 N –1 COOH (N = 0,1,2…)
Allgemeine Formel gesättigter zweibasiger Carbonsäuren:
C n H 2n–2 O 4 (N = 2,3…)
Namen und Formeln einiger Carbonsäuren
|
Carbonsäureformel |
IUPAC-Name |
Trivialname |
|---|---|---|
|
Gesättigte einbasige Carbonsäuren |
||
|
Ungesättigte einbasige Carbonsäuren |
||
|
Dibasische Carbonsäuren |
||
Beispiele für Problemlösungen
BEISPIEL 1
| Übung | Drei identische Reagenzgläser ohne Signatur enthalten drei Säuren: Ameisensäure, Essigsäure und Salzsäure. Wie kann man anhand der unterschiedlichen chemischen Eigenschaften feststellen, welche Säure sich in den einzelnen Reagenzgläsern befindet? |
| Lösung | Ameisensäure weist auch einige Eigenschaften auf (reduktiv). So lässt sich beispielsweise durch die Reaktion mit Kupfer(II)-hydroxid ermitteln, bei Ameisensäure entsteht rotes Kupfer(I)-oxid: Die übrigen Säuren können durch Reaktion mit Silbernitrat unterschieden werden. Bei Salzsäure fällt ein weißer Niederschlag aus Silberchlorid aus: Silberacetat löst sich in Wasser auf, sodass im Reagenzglas keine Veränderungen auftreten. Somit enthält das verbleibende Reagenzglas Essigsäure. |
BEISPIEL 2
| Übung | Bestimmen Sie, ob bei der Hydrolyse einer Probe mit einem Gewicht von 2,64 g 1,38 g Alkohol und 1,8 g einbasige Carbonsäure freigesetzt werden. |
| Lösung | Die allgemeine Formel eines Esters, bestehend aus einem Alkohol und einer Säure mit unterschiedlicher Anzahl an Kohlenstoffatomen, lautet: Somit lautet die Alkoholformel: und die Formel der Säure lautet: Schreiben wir die Gleichung für die Esterhydrolyse: Gemäß dem Massenerhaltungssatz von Stoffen ist die Masse der Reaktionsprodukte gleich der Masse der Ausgangsstoffe. Berechnen wir die Masse: M(Säure) + m(Alkohol) – m(Äther) g Berechnen wir die Menge an Wassersubstanz: Nach der Reaktionsgleichung n(Säure) = n(Alkohol) mol |
 Bewegung von Körpern unter dem Einfluss der Schwerkraft
Bewegung von Körpern unter dem Einfluss der Schwerkraft Tropen und Stilfiguren
Tropen und Stilfiguren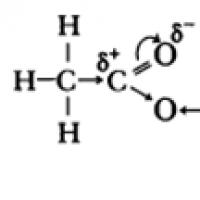 §12. Carbonsäuren. Carbonsäuren: physikalische Eigenschaften. Salze von Carbonsäuren Die einfachste Carbonsäure ist Ameisensäure
§12. Carbonsäuren. Carbonsäuren: physikalische Eigenschaften. Salze von Carbonsäuren Die einfachste Carbonsäure ist Ameisensäure Gespräch mit Ex-Freundin
Gespräch mit Ex-Freundin Warum träumst du von deinem besten Freund, Ex-Freund oder Jugendfreund?
Warum träumst du von deinem besten Freund, Ex-Freund oder Jugendfreund? Traumdeutung: Eine schwangere Frau träumt von einem Kind
Traumdeutung: Eine schwangere Frau träumt von einem Kind Warum träumen Sie von Funkenstrom? Warum träumst du von Funken? Was schreiben sie in Traumbücher?
Warum träumen Sie von Funkenstrom? Warum träumst du von Funken? Was schreiben sie in Traumbücher?