§12. Карбонові кислоти. Карбонові кислоти: фізичні властивості. Солі карбонових кислот Найпростіша карбонова кислота мурашина
ВИЗНАЧЕННЯ
Органічні речовини, молекули яких містять одну або кілька карбоксильних груп, з'єднаних із вуглеводневим радикалом, називають карбоновими кислотами.
Перші три члени гомологічного ряду карбонових кислот, включаючи пропіонову кислоту, - рідини, що мають різкий запах, добре розчиняються у воді. Наступні гомологи, починаючи з масляної кислоти, - також рідини, що мають різкий неприємний запах, але погано розчиняються у воді. Вищі кислоти, з числом атомів вуглецю 10 і більше, є твердими речовинами, без запаху, нерозчинними у воді. Загалом, у ряді гомологів зі збільшенням молекулярної маси зменшується розчинність у воді, зменшується щільність та зростає температура кипіння (табл. 1).
Таблиця 1. Гомологічний ряд карбонових кислот.
Одержання карбонових кислот
Карбонові кислоти отримують окисленням граничних вуглеводнів, спиртів, альдегідів. Наприклад, оцтову кислоту - окисленням етанолу розчином перманганату калію в кислому середовищі при нагріванні:
Хімічні властивості карбонових кислот
Хімічні властивості карбонових кислот зумовлені насамперед особливостями їхньої будови. Так, розчинні у воді кислоти здатні дисоціювати на іони:
R-COOH↔R-COO - + H + .
Завдяки наявності у воді іона H+ вони мають кислий смак, здатні змінювати забарвлення індикаторів та проводити електричний струм. У водному розчині ці кислоти – слабкі електроліти.
Карбонові кислоти мають хімічні властивості, характерні для розчинів неорганічних кислот, тобто. взаємодіють з металами (1), їх оксидами (2), гідроксидами (3) та слабкими солями (4):
2CH 3 -COOh + Zn → (CH 3 COO) 2 Zn + H 2 (1);
2CH 3 -COOH + CuO→ (CH 3 COO) 2 Cu + H 2 O (2);
R-COOH + KOH → R-COOK + H 2 O(3);
2CH 3 -COOH + NaHCO 3 → CH 3 COONa + H 2 O + CO 2 (4).
Специфічна властивість граничних, а також ненасичених карбонових кислот, що виявляється за рахунок функціональної групи, - взаємодія зі спиртами.
Карбонові кислоти взаємодіють зі спиртами при нагріванні та у присутності концентрованої сірчаної кислоти. Наприклад, якщо до оцтової кислоти прилити етиловий спирт і трохи сірчаної кислоти, то при нагріванні з'являється запах етилового ефіру оцтової кислоти (етилацетату):
CH 3 -COOH + C 2 H 5 OH ↔CH 3 -C(O)-O-C 2 H 5 + H 2 O.
Специфічна властивість граничних карбонових кислот, що виявляється за рахунок радикалу, - реакція галогенування (хлорування).

Застосування карбонових кислот
Карбонові кислоти є вихідною сировиною для отримання кетонів, галогенангідридів, вінілових ефірів та інших важливих класів органічних сполук.
Мурашина кислота широко застосовується для отримання складних ефірів, що використовуються в парфумерії, у шкіряній справі (дублення шкір), текстильної промисловості (як протрава при фарбуванні), як розчинник і консервант.
Водний розчин (70-80%-ний) оцтової кислоти називається оцтовою есенцією, а 3-9%-ний водний розчин - столовим оцтом. Есенція нерідко використовується для отримання оцту в домашніх умовах шляхом розведення.
Приклади розв'язання задач
ПРИКЛАД 1
| Завдання | За допомогою яких хімічних реакцій можна здійснити такі перетворення: а) CH 4 → CH 3 Cl → CH 3 OH → HCHO → HCOOH → HCOOK. Напишіть рівняння реакцій, вкажіть умови їхнього протікання. |
| Відповідь | а) Хлорування метану на світлі призводить до одержання хлорметану: CH 4 + Cl 2 →CH 3 Cl + HCl. Галогенпохідні алканів піддаються гідролізу у водному або лужному середовищі з утворенням спиртів: CH 3 Cl + NaOH→CH 3 OH + NaCl. В результаті окислення первинних спиртів, наприклад, дихроматом калію в кислому середовищі у присутності каталізатора (Cu, CuO, Pt, Ag) утворюються альдегіди: CH 3 OH+ [O] →HCHO. Альдегіди легко окислюються до відповідних карбонових кислот, наприклад, перманганатом калію: HCHO + [O] →HCOOH. Карбонові кислоти, виявляють всі властивості, властиві слабким мінеральним кислотам, тобто. здатні взаємодіяти з активними металами з утворенням солей: 2HCOOH+ 2K→2HCOOK + H 2 . |
ПРИКЛАД 2
| Завдання | Напишіть рівняння реакцій між такими речовинами: а) 2-метилпропанової кислоти та хлору; б) оцтовою кислотою та пропанолом-2; в) акриловою кислотою та бромною водою; г) 2-метилбутановою кислотою та хлоридом фосфору (V). Вкажіть умови перебігу реакцій. |
| Відповідь | а) в результаті реакції взаємодії між 2-метилпропанової кислоти і хлором відбувається заміщення атома водню у вуглеводневому радикалі, що знаходиться в a-положення; утворюється 2-метил-2-хлорпропанова кислота H 3 C-C(CH 3)H-COOH + Cl 2 → H 3 C-C(CH 3)Cl-COOH + HCl (kat = P). б) в результаті реакції взаємодії між оцтовою кислотою та пропанолом-2 відбувається утворення складного ефіру - ізопропіловий ефір оцтової кислоти. CH 3 -COOH + CH 3 -C(OH)H-CH 3 → CH 3 -C(O)-O-C(CH 3)-CH 3 . в) внаслідок реакції взаємодії між акриловою кислотою та бромною водою приєднання галогену за місцем подвійного зв'язку відповідно до правила Марковникова; утворюється 2,3-дибромпропанова кислота CH 2 = CH-COOH + Br 2 → CH 2 Br-CHBr-COOH г) в результаті реакції взаємодії між 2-метилбутановою кислотою та хлоридом фосфору (V) утворюється відповідний хлорангідрид CH 3 -CH 2 -C(CH 3)H-COOH + PCl 5 →CH 3 -CH 2 -C(CH 3)H-COOCl + POCl 3 + HCl. |
Карбонові кислоти- Органічні речовини, молекули яких містять одну або кілька карбоксильних груп.
Карбоксильна група (скорочено COOH) - функціональна група карбонових кислот - складається з карбонільної групи і пов'язаної з нею гідроксильної групи.
За кількістю карбоксильних груп карбонові кислоти поділяються на одноосновні, двоосновні і т.д.
Загальна формула одноосновних карбонових кислот R-COOH. Приклад двоосновної кислоти – щавлева кислота HOOC-COOH.
За типом радикалу карбонові кислоти діляться на граничні (наприклад, оцтова кислота CH 3 COOH), ненасичені [наприклад, акрилова кислота CH 2 =CH—COOH , олеїнова CH 3 —(CH 2) 7 —CH=CH—(CH 2) 7 -COOH] та ароматичні (наприклад, бензойна C 6 H 5 -COOH).
Ізоміри та гомологи
Одноосновні граничні карбонові кислоти R-COOH є ізомерами складних ефірів (скорочено R"-COOR") з тим самим числом атомів вуглецю. Загальна формула і тих, і інших C n H 2 n O 2 .
| г | HCOOH метанова (мурашина) |
||||
| CH 3 COOH етанова (оцтова) | HCOOCH 3 метиловий ефір мурашиної кислоти |
||||
| CH 3 CH 2 COOH пропанова (пропіонова) |
HCOOCH 2 CH 3 етиловий ефір мурашиної кислоти |
CH 3 COOCH 3 метиловий ефір оцтової кислоти | |||
| CH 3 (CH 2) 2 COOH бутанова (олійна) |
2-метилпропанова |
HCOOCH 2 CH 2 CH 3 пропіловий ефір мурашиної кислоти |
CH 3 COOCH 2 CH 3 етиловий ефір оцтової кислоти |
CH 3 CH 2 COOCH 3 метиловий ефір пропіонової кислоти |
|
| і з о м е ри | |||||
Алгоритм складання назв карбонових кислот
- Знайдіть головний вуглецевий ланцюг - це найдовший ланцюг атомів вуглецю, що включає атом вуглецю карбоксильної групи.
- Пронумеруйте атоми вуглецю в головному ланцюзі, починаючи з атома вуглецю карбоксильної групи.
- Назвіть з'єднання за алгоритмом для вуглеводнів.
- В кінці назви допишіть суфікс "-ів", закінчення "а" і слово "кислота".
У молекулах карбонових кислот p-електрони атомів кисню гідроксильної групи взаємодіють з електронами -зв'язку карбонільної групи, внаслідок чого зростає полярність зв'язку O-H, зміцнюється -зв'язок у карбонільній групі, зменшується частковий заряд (+) на атомі вуглецю і збільшується частковий заряд (+) на атомі водню .
Остання сприяє утворенню міцних водневих зв'язків між молекулами карбонових кислот.
Фізичні властивості граничних одноосновних карбонових кислот значною мірою зумовлені наявністю між молекулами міцних водневих зв'язків (міцніших, ніж між молекулами спиртів). Тому температури кипіння та розчинність у воді у кислот більше, ніж у відповідних спиртів.
Хімічні властивості кислот
Зміцнення зв'язку в карбонільній групі призводить до того, що реакції приєднання для карбонових кислот нехарактерні.
- Горіння:
CH 3 COOH + 2O 2 2CO 2 + 2H 2 O
- Кислотні властивості.
Через високу полярність зв'язку O-H карбонові кислоти у водному розчині помітно дисоціюють (точніше, оборотно з нею реагують):HCOOH HCOO - + H + (точніше HCOOH + H 2 O HCOO - + H 3 O +)
Усі карбонові кислоти – слабкі електроліти. Зі збільшенням числа атомів вуглецю сила кислот зменшується (через зниження полярності зв'язку O-H); навпаки, введення атомів галогену у вуглеводневий радикал призводить до зростання сили кислоти. Так, у рядуHCOOH CH 3 COOH C 2 H 5 COOH
сила кислот знижується, а в рядіЗростає.
Карбонові кислоти виявляють всі властивості, властиві слабким кислотам:
Mg + 2CH 3 COOH (CH 3 COO) 2 Mg + H 2
CaO + 2CH 3 COOH (CH 3 COO) 2 Ca + H 2 O
NaOH + CH 3 COOH CH 3 COONa + H 2 O
K 2 CO 3 + 2CH 3 COOH 2CH 3 COOK + H 2 O + CO 2 - Етерифікація (реакція карбонових кислот зі спиртами, що веде до утворення складного ефіру):
У реакцію етерифікації можуть вступати багатоатомні спирти, наприклад, гліцерин. Складні ефіри, утворені гліцерином та вищими карбоновими кислотами (жирними кислотами) – це жири.Жири є сумішшю тригліцеридів. Граничні жирні кислоти (пальмітинова C 15 H 31 COOH, стеаринова C 17 H 35 COOH) утворюють тверді жири тваринного походження, а ненасичені (олеїнова C 17 H 33 COOH, лінолева C 17 H 31 COOH та ін) - рідкі жири (олії) рослинного походження.
- Заміщення у вуглеводневому радикалі:
Заміщення протікає в положення.Особливість мурашиної кислоти HCOOH полягає в тому, що ця речовина - двофункціональна сполука, вона одночасно є і карбоновою кислотою, і альдегідом:
Тому мурашина кислота також реагує і з аміачним розчином оксиду срібла (реакція срібного дзеркала; якісна реакція):HCOOH + Ag 2 O(аміачний розчин) CO 2 + H 2 O + 2Ag
Одержання карбонових кислот
.
O
//
Група атомів -З називається карбоксильною групою або карбоксилом.
\
OH
Органічні кислоти, що містять у молекулі одну карбоксильну групу, є одноосновними. Загальна формула цих кислот RCOOН.
Карбонові кислоти, що містять дві карбоксильні групи, називаються двоосновними. До них відносяться, наприклад, щавлева та янтарна кислоти.
Існують і багатоосновні карбонові кислоти, що містять більше двох карбоксильних груп. До них належить, наприклад, триосновна лимонна кислота. Залежно від природи вуглеводневого радикалу карбонові кислоти поділяються на граничні, ненасичені, ароматичні.
Граничними або насиченими карбоновими кислотами є, наприклад, пропанова (пропіонова) кислота або вже знайома нам янтарна кислота.
Очевидно, що граничні карбонові кислоти не містять п-зв'язків у вуглеводневому радикалі
У молекулах ненасичених карбонових кислот карбоксильна група пов'язана з ненасиченим, ненасиченим вуглеводневим радикалом, наприклад в молекулах акрилової (пропенової) СН2=СН-СООН або олеїнової СН3-(СН2)7-СН= СН-(СН2)7-СООН та інших кислот.
Як видно з формули бензойної кислоти, вона є ароматичною, оскільки містить у молекулі ароматичну (бензольну) кільце.
Номенклатура та ізомерія
Загальні принципи утворення назв карбонових кислот, як та інших органічних сполук, ми вже розглядали. Зупинимося докладніше на номенклатурі одно- та двоосновних карбонових кислот. Назва карбонової кислоти утворюється від назви відповідного алкану (алкану з тим самим числом атомів вуглецю в молекулі) з додаванням суфікса -ів, закінчення -ая та слова кислота. Нумерація атомів вуглецю починається з карбоксильної групи. Наприклад:
Багато кислот мають і історично сформовані, чи тривіальні, назви (табл. 6). 
Після першого знайомства з різноманітним і цікавим світом органічних кислот розглянемо докладніше граничні одноосновні карбонові кислоти.
Зрозуміло, що склад цих кислот буде відображатися загальною формулою З n Н 2n O2, або З n Н 2n +1 COОН, або RСООН.
Фізичні властивості граничних одноосновних карбонових кислот
Нижчі кислоти, тобто кислоти з відносно невеликою молекулярною масою, що містять у молекулі до чотирьох атомів вуглецю, - рідини з характерним різким запахом (згадайте запах оцтової кислоти). Кислоти, що містять від 4 до 9 атомів вуглецю, - в'язкі маслянисті рідини з неприємним запахом; містять більше 9 атомів вуглецю в молекулі - тверді речовини, які не розчиняються у воді. Температури кипіння граничних одноосновних карбонових кислот збільшуються зі зростанням числа атомів вуглецю в молекулі і, отже, зі зростанням відносної молекулярної маси. Так, наприклад, температура кипіння мурашиної кислоти дорівнює 101 °С, оцтової – 118 °С, пропіонової – 141 °С.
Найпростіша карбонова кислота – мурашина НСООН, маючи невелику відносну молекулярну масу (46), за звичайних умов є рідиною з температурою кипіння 100,8 °С. У той самий час бутан (МR(С4Н10) = 58) у тих-таки умовах газоподібний і має температуру кипіння -0,5 °З. Ця невідповідність температур кипіння та відносних молекулярних мас пояснюється утворенням димерів карбонових кислот, у яких дві молекули кислоти пов'язані двома водневими зв'язками. Виникнення водневих зв'язків стає зрозумілим під час розгляду будови молекул карбонових кислот.
Молекули граничних одноосновних карбонових кислот містять полярну групу атомів - карбоксил (подумайте чим викликана полярність цієї функціональної групи) і практично неполярний вуглеводневий радикал. Карбоксильна група притягується молекулами води, утворюючи з ними водневі зв'язки.
Мурашина та оцтова кислоти розчиняються у воді необмежено. Очевидно, що зі збільшенням числа атомів у вуглеводневому радикалі розчинність карбонових кислот знижується.
Знаючи склад і будову молекул карбонових кислот, нам неважко зрозуміти та пояснити хімічні властивості цих речовин.
Хімічні властивості
Загальні властивості, характерні для класу кислот (як органічних, так і неорганічних), обумовлені наявністю в молекулах гідроксильної групи, що містить полярний зв'язок між атомами водню і кисню. Ці властивості добре відомі. Розглянемо їх ще раз на прикладі розчинних у воді органічних кислот.
1. Дисоціація з утворенням катіонів водню та аніонів кислотного залишку. Більше точно цей процес визначає рівняння, що враховує участь у ньому молекул води.
Рівновагу дисоціації карбонових кислот зміщено вліво, переважна більшість їх – слабкі електроліти. Проте кислий смак, наприклад, мурашиної та оцтової кислот пояснюється дисоціацією на катіони водню та аніони кислотних залишків.
Вочевидь, що у молекулах карбонових кислот «кислого» водню, т. е. водню карбоксильної групи, зумовлені й інші характерні властивості.
2. Взаємодія з металами, що стоять в електрохімічному ряду напруги до водню. Так, залізо відновлює водень з оцтової кислоти:
2СН3-СООН + Fe -> (CHgCOO)2Fe + Н2
3. Взаємодія з основними оксидами з утворенням солі та води:
2R-СООН + СаО -> (R-СОО)2Са + Н20
4. Взаємодія з гідроксидами металів з утворенням солі та води (реакція нейтралізації):
R-СООН + NaOH -> R-COONa + Н20 3R-СООН + Са(ОН)2 -> (R-СОО)2Са + 2Н20
5. Взаємодія із солями слабших кислот, з утворенням останніх. Так, оцтова кислота витісняє стеаринову з натрію стеарату і вугільну з карбонату калію.
6. Взаємодія карбонових кислот зі спиртами з утворенням складних ефірів - вже відома вам реакція етерифікації (одна з найбільш важливих реакцій, характерних для карбонових кислот). Взаємодія карбонових кислот із спиртами каталізується катіонами водню.
Реакція етерифікації оборотна. Рівнавага зміщується у бік утворення складного ефіру в присутності водовіднімних засобів і видаленні ефіру з реакційної суміші.
У реакції, зворотній етерифікації, яка називається гідролізом складного ефіру (взаємодія складного ефіру з водою), утворюються кислота та спирт. Очевидно, що реагувати з карбоновими кислотами, тобто вступати в реакцію етерифікації можуть і багатоатомні спирти, наприклад гліцерин: 
Всі карбонові кислоти (крім мурашиної) поряд з карбоксильною групою містять в молекулах вуглеводневий залишок. Безумовно, це може не позначитися на властивостях кислот, які визначаються характером вуглеводневого залишку.
7. Реакції приєднання по кратному зв'язку - у них вступають ненасичені карбонові кислоти; наприклад, реакція приєднання водню - гідрування. При гідруванні олеїнової кислоти утворюється гранична стеаринова кислота.
Ненасичені карбонові кислоти, як і інші ненасичені сполуки, приєднують галогени по подвійному зв'язку. Так, наприклад, акрилова кислота знебарвлює бромну воду.
8. Реакції заміщення (з галогенами) - до неї здатні вступати граничні карбонові кислоти; наприклад, при взаємодії оцтової кислоти з хлором можуть бути отримані різні хлорпохідні кислоти:

При галогенуванні карбонових кислот, що містять більше одного атома вуглецю у вуглеводневому залишку, можливе утворення продуктів з різним становищем галогену в молекулі. При протіканні реакції вільнорадикального механізму можуть заміщатися будь-які атоми водню у вуглеводневому залишку. Якщо ж реакцію проводити в присутності невеликих кількостей червоного фосфору, то вона йде селективно - водень заміщається лише в а-положенні (ближчим до функціональної групи атома вуглецю) в молекулі кислоти. Причини такої селективності ви дізнаєтесь щодо хімії у вищому навчальному закладі.
Карбонові кислоти утворюють різні функціональні похідні при заміщенні гідроксильної групи. При гідролізі цих похідних їх знову утворюється карбонова кислота.
Хлорангідрид карбонової кислоти можна отримати дією на кислоту хлориду фосфору (ІІІ) або тіонілхлориду (SОСl 2). Ангідриди карбонових кислот отримують взаємодією хлорангідридів з солями карбонових кислот. Складні ефіри утворюються внаслідок етерифікації карбонових кислот спиртами. Етерифікація каталізується неорганічними кислотами.
Цю реакцію ініціює протонування карбоксильної групи – взаємодія катіону водню (протону) з неподіленою електронною парою атома кисню. Протонування карбоксильної групи тягне у себе збільшення позитивного заряду на атомі вуглецю у ній:

Способи отримання
Карбонові кислоти можуть бути отримані окисленням первинних спиртів та альдегідів.
Ароматичні карбонові кислоти утворюються при окисленні гомологів бензолу.
Гідроліз різних похідних карбонових кислот також призводить до одержання кислот. Так, при гідролізі складного ефіру утворюються спирт та карбонова кислота. Як уже говорилося вище, реакції етерифікації та гідролізу, що катарилізуються кислотою, оборотні. Гідроліз складного ефіру під впливом водного розчину лугу протікає незворотно, у разі зі складного ефіру утворюється не кислота, та її сіль. При гідролізі нітрилів спочатку утворюються аміди, які потім перетворюються на кислоти. Карбонові кислоти утворюються при взаємодії магній-органічних сполук з оксидом вуглецю (IV).
Окремі представники карбонових кислот та їх значення
Мурашина (метанова) кислота НСООН - рідина з різким запахом і температурою кипіння 100,8 ° С, добре розчинна у воді. Мурашина кислота отруйна, при попаданні на шкіру викликає опіки! Жалюча рідина, що виділяється мурахами, містить цю кислоту. Мурашина кислота має дезінфікуючу властивість і тому знаходить своє застосування в харчовій, шкіряній та фармацевтичній промисловості, медицині. Вона також використовується при фарбуванні тканин та паперу.
Оцтова (етанова) кислота СН3СООН - безбарвна рідина з характерним різким запахом, що змішується з водою в будь-яких відносинах. Водні розчини оцтової кислоти надходять у продаж під назвою оцту (3-5%-ний розчин) та оцтової есенції (70-80%-ний розчин) і широко використовуються в харчовій промисловості. Оцтова кислота - добрий розчинник багатьох органічних речовин і тому використовується при фарбуванні, у шкіряному виробництві, в лакофарбовій промисловості. Крім цього, оцтова кислота є сировиною для отримання багатьох важливих в технічному відношенні органічних сполук: наприклад, на її основі одержують речовини, що використовуються для боротьби з бур'янами - гербіциди. 
Оцтова кислота є основним компонентом винного оцту, характерний запах якого зумовлений саме ним. Вона є продуктом окислення етанолу і утворюється з нього при зберіганні вина на повітрі.
Найважливішими представниками вищих граничних одноосновних кислот є пальмітинова С15Н31СООН та стеаринова С17Н35СООН кислоти. На відміну від нижчих кислот, ці речовини тверді, погано розчинні у воді.
Однак їх солі - стеарати і пальмітати - добре розчинні і мають миючу дію, тому їх ще називають милами. Зрозуміло, що ці речовини виробляють у великих масштабах.
З ненасичених вищих карбонових кислот найбільше значення має олеїнова кислота С17Н33СООН, або (СН2)7СООН. Це маслоподібна рідина без смаку і запаху. Широке застосування у техніці знаходять її солі.
Найпростішим представником двоосновних карбонових кислот є щавлева (етандіова) кислота НООС-СООН, солі якої зустрічаються в багатьох рослинах, наприклад, у щавлі та кислиці. Щавлева кислота - це безбарвна кристалічна речовина, що добре розчиняється у воді. Вона застосовується при поліруванні металів, в деревообробній та шкіряній промисловості.
1. Ненасичена елаїдинова кислота С17Н33СООН є транс-ізомером олеїнової кислоти. Складіть структурну формулу цієї речовини.
2. Складіть рівняння реакції гідрування олеїнової кислоти. Назвіть продукт цієї реакції.
3. Складіть рівняння реакції горіння стеаринової кислоти. Який обсяг кисню та повітря (н. у.) знадобиться для спалювання 568 г стеаринової кислоти?
4. Суміш твердих жирних кислот – пальмітинової та стеаринової – називають стеарином (саме з нього виготовляють стеаринові свічки). Який обсяг повітря (н. у.) буде потрібний для спалювання двосотграмової стеаринової свічки, якщо стеарин містить рівні маси пальмітинової та стеаринової кислот? Який обсяг вуглекислого газу (н. у.) та маса води утворюються при цьому?
5. Розв'яжіть попереднє завдання за умови, що свічка містить рівні кількості (однакове число молів) стеаринової та пальмітинової кислот.
6. Для видалення плям іржі їх обробляють розчином оцтової кислоти. Складіть молекулярні та іонні рівняння реакцій, що відбуваються при цьому, враховуючи, що іржа містить оксид і гідроксид заліза(III) - Fе2O3 і Fе(ОН)3. Чому такі плями не видаляються водою? Чому вони зникають під час обробки розчином кислоти?
7. Додаємо в бездрожжеве тісто харчову (питну) соду МаНС03 попередньо «гасять» оцтовою кислотою. Виконайте вдома цю реакцію і складіть її рівняння, знаючи, що вугільна кислота слабша за оцтову. Поясніть утворення піни.
8. Знаючи, що хлор більш електронегативний, ніж вуглець, розташуйте наступні кислоти: оцтову, пропіонову, хлороцтову, дихлороцтову і трихлороцтову кислоти в порядку посилення кислотних властивостей. Обґрунтуйте свій результат.
9. Чим можна пояснити, що мурашина кислота входить у реакцію «срібного дзеркала»? Складіть рівняння цієї реакції. Який газ може виділятись при цьому?
10. При взаємодії 3 г граничної одноосновної карбонової кислоти з надлишком магнію виділилося 560 мл (н. у.) водню. Визначте формулу кислоти.
11. Наведіть рівняння реакції, за допомогою яких можна описати хімічні властивості оцтової кислоти. Назвіть продукти цих реакцій.
12. Запропонуйте нескладний лабораторний спосіб, за допомогою якого можна розпізнати пропанову та акрилову кислоти.
13. Складіть рівняння реакції отримання метилформіату - складного ефіру метанолу та мурашиної кислоти. За яких умов слід проводити цю реакцію?
14. Складіть структурні формули речовин, що мають склад С3Н602. До яких класів речовин їх можна віднести? Наведіть рівняння реакцій, притаманних кожного з них.
15. Речовина А – ізомер оцтової кислоти – не розчиняється у воді, проте може піддаватися гідролізу. Яка структурна формула речовини А? Назвіть продукти його гідролізу.
16. Складіть структурні формули наступних речовин:
а) метилацетат;
б) щавлева кислота;
в) мурашина кислота;
г) дихлороцтова кислота;
д) ацетат магнію;
е) етилацетат;
ж) етилформіат;
з) акрилова кислота.
17 *. Зразок граничної одноосновної органічної кислоти 3,7 г масою нейтралізували водним розчином гідрокарбонату натрію. При пропущенні газу, що виділився, через вапняну воду було отримано 5,0 г осаду. Яка кислота була взята і який обсяг газу, що виділився?
Карбонові кислоти у природі
Карбонові кислоти дуже часто зустрічаються в природі. Вони містяться у фруктах та рослинах. Вони присутні у хвої, поті, сечі та соку кропиви. Ви знаєте, виявляється, що основна маса кислот утворюють складні ефіри, які мають запахи. Так запах молочної кислоти, яка міститься в поті людини, приваблює комарів, вони її відчувають на значній відстані. Тому скільки б ви не намагалися відігнати настирливого комара, він все одно добре відчуває свою жертву. Крім людського поту, молочна кислота міститься в солоних огірках та квашеній капусті.
А самки мавп, щоб привернути до себе самця, виділяє оцтову та пропіонову кислоту. Чутливий, собачий ніс здатний почути запах олійної кислоти, яка має концентрацію 10-18 г/см3.
Багато видів рослин здатні виділяти виділяють оцтову та олійну кислоту. А деякі бур'яни цим користуються і виділяючи речовини, усувають своїх конкурентів, пригнічуючи їх зростання, а іноді викликаючи їх загибель.
Кислотою користувалися і індіанці. Щоб знищити ворога, вони змочували стріли смертельною отрутою, яка виявилася похідною від оцтової кислоти.
І тут виникає закономірне питання, чи становлять кислоти небезпеку здоров'ю людини? Адже широко поширена в природі щавлева кислота, яка міститься в щавлі, апельсинах, смородині та малині, чомусь не знайшла застосування у харчовій промисловості. Виявляється, щавлева кислота в двісті разів сильніша за оцтову кислоту, і здатна навіть роз'їдати посуд, а її солі, накопичуючись в організмі людини, утворювати камені.
Кислоти знайшли широке застосування у всіх сферах людського життя. Їх застосовують у медицині, косметології, харчовій промисловості, сільському господарстві та використовують для побутових потреб.
З медичною метою використовуються такі органічні кислоти, як молочна, винна, аскорбінова. Напевно, кожен із вас вживав для зміцнення організму вітамін С – це якраз і є аскорбінова кислота. Вона не тільки допомагає зміцнити імунітет, але і має здатність виводити з організму канцерогени та токсини. Молочну кислоту використовують для припікання, оскільки вона має високу гігроскопічність. А ось винна кислота діє як легка проносна, як протиотрута при отруєннях лугами і як компонент, необхідний для приготування плазми при переливанні крові.
А ось шанувальникам косметичних процедур, слід знати, що фруктові кислоти, що містяться в цитрусових фруктах, сприятливо впливають на шкіру, так як проникаючи вглиб, вони здатні прискорювати процес оновлення шкіри. Крім цього, запах цитрусових має тонізуючий вплив на нервову систему.
Чи помічали ви, що такі ягоди, як журавлина та брусниця, довго зберігаються і залишаються свіжими. А чи знаєте чому? Виявляється, у них міститься бензойна кислота, яка є чудовим консервантом.
А ось у сільському господарстві широке застосування знайшла янтарна кислота, оскільки за її допомогою можна підвищити врожайність культурних рослин. Також вона здатна стимулювати зростання рослин та прискорювати їх розвиток.
1.Карбонові кислоти - це органічні кисневмісні речовини, молекули яких містять одну або кілька карбоксильних груп
(-З OOH ), з'єднаних з вуглецевим радикалом або водневим атомом.
Карбоксильна група містить дві функціональні групи – карбоніл >С=О та гідроксил -OH, безпосередньо пов'язані один з одним:
2. Класифікація
А) За кількістю карбоксильних груп у молекулі
|
Назва |
Приклади |
|
1) Одноосновні |
Метан ова , мурашина кислота Етан ова , оцтова кислота |
|
2) Двоосновні |
HOOC – COOH Щавелева кислота |
|
3) Багатоосновні |
Б) За природою вуглеводневого радикалу
|
Назва |
Приклади |
|
1) Граничні (насичені) |
HCOOH Метан ова , мурашина кислота CH 3 COOH Етан ова , оцтова кислота |
|
2) Ненасичені |
Акрилова кислота СН 2 = СНСООН Кротонова кислота СН 3 -СН = СН-СООН Олеїнова СН 3 –(СН 2) 7 –СН=СН–(СН 2) 7 –СООН Лінолева СН 3 –(СН 2) 4 –(СН=СН–СН 2) 2 –(СН 2) 6 –СООН Ліноленова СН 3 –СН 2 –(СН=СН–СН 2) 3 –(СН 2) 6 –СООН |
|
3) Ароматичні |
З 6 Н 5 СООН – бензойна кислота НООС-З 6 Н 4 -СООН Пара-терефталева кислота |
3. Ізомерія та номенклатура
I . Структурна
А) Ізомерія вуглецевого скелета (починаючи з C 4 )
Б) Міжкласова зі складними ефірами R - CO - O - R 1 (починаючи з C 2 )
Наприклад: для З 3 Н 6 Про 2
CH 3 -CH 2 -COOH пропіонова кислота
З H 3 -CO -OCH 3 метиловий ефір оцтової кислоти
II . Просторова
А) Оптична
Наприклад:
Б) Цис-транс - ізомерія для ненасичених кислот
Приклад:
4. Номенклатура карбонових кислот
Систематичні назви кислот даються за назвою відповідного вуглеводню з додаванням суфіксу -овата слова кислота.
Щоб вказати положення заступника (або радикала), нумерацію вуглецевого ланцюга починають від вуглецю атома карбоксильної групи. Наприклад, з'єднання з розгалуженим вуглецевим ланцюгом (CH 3) 2 CH-CH 2 -COOH називається 3-метилбутанова кислота. Для органічних кислот широко використовуються також тривіальні назви, які, як правило, відображають природне джерело, де були вперше виявлені ці сполуки.
Деякі одноосновні кислоти
|
Формула |
Назва кислоти R-COOH |
Назва залишку RCOO - |
|
|
систематичне |
тривіальне |
||
|
HCOOH |
метанова |
мурашина |
форміат |
|
CH 3 COOH |
етанова |
оцтова |
ацетат |
|
C 2 H 5 COOH |
пропанова |
пропіонова |
пропіонат |
|
C 3 H 7 COOH |
бутанова |
олійна |
бутират |
|
C 4 H 9 COOH |
пентанова |
валеріанова |
валерат |
|
C 5 H 11 COOH |
гексанова |
капронова |
капрат |
|
C 15 H 31 COOH |
гексадеканова |
пальмітинова |
пальмітат |
|
C 17 H 35 COOH |
октадеканова |
стеаринова |
стеарат |
|
C 6 H 5 COOH |
бензолкарбонова |
бензойна |
бензоат |
|
CH 2 =СH-COOH |
пропінова |
акрилова |
акрилат |
Для багатоосновних кислот застосовують суфікси -діова, -тріоваі т.д.
Наприклад:
HOOC-COOH - етандіова (щавлева) кислота;
HOOC-CH 2 -COOH - пропандіова (малонова) кислота.
Граничні одноосновні карбонові кислоти
C n H 2 n +1 - COOHабоC n H 2 nO 2
Гомологічний ряд
|
Назва |
Формула кислоти |
t пл. |
t кіп. |
ρ |
|
|
кислоти |
|||||
|
мурашина |
метанова |
HCOOH |
100,5 |
1,22 |
|
|
оцтова |
етанова |
CH 3 COOH |
16,8 |
1,05 |
|
|
пропіонова |
пропанова |
CH 3 CH 2 COOH |
0,99 |
||
|
олійна |
бутанова |
CH 3 (CH 2) 2 COOH |
0,96 |
||
Будова карбоксильної групи
Карбоксильна група поєднує у собі дві функціональні групи – карбоніл >C =O і гідроксил -OH , що взаємно впливають одна на одну:
Кислотні властивості карбонових кислот обумовлені зміщенням електронної щільності до карбонільного кисню і викликаної цим додаткової (порівняно зі спиртами) поляризації зв'язку О-Н.
У водному розчині карбонові кислоти дисоціюють на іони:
Розчинність у воді та високі температури кипіння кислот обумовлені утворенням міжмолекулярних водневих зв'язків.
Зі збільшенням молекулярної маси розчинність кислот у воді зменшується.
Фізичні властивості граничних одноосновних кислот
Нижчі члени цього ряду за звичайних умов є рідини, що мають характерний гострий запах. Наприклад, етанова (оцтова) кислота має характерний "оцтовий" запах. Безводна оцтова кислота при кімнатній температурі є рідиною; при 17 °С вона замерзає, перетворюючись на крижину речовину, яка отримала назву "крижана" оцтова кислота. Середні представники цього гомологічного ряду - в'язкі, "маслоподібні" рідини; починаючи з 10 - тверді речовини.
Найпростіша ароматична кислота - бензойна C 6 H 5 COOH (т. пл. 122,4 ° С) - легко виганяється, тобто. переходить у газоподібний стан, минаючи рідке. При охолодженні її пари сублімуються в кристали. Ця властивість використовується для чищення речовини від домішок.
ВИЗНАЧЕННЯ
Карбонові кислоти– органічні сполуки, молекули яких містять одну або кілька функціональних карбоксильних груп –СООН, пов'язаних із вуглеводневим радикалом.
Карбоксильна група складається з карбонільної групи > C= Oта пов'язаної з нею гідроксильної групи -ОН.
Загальна формула карбонових кислот: R-COOH.
Кислотні властивості карбонових кислот обумовлені зміщенням електронної густини до карбонильного кисню, що зумовлює виникнення часткового заряду позитивного на атомі .
В результаті полярність зв'язку О-Н зростає, і стає можливим процес дисоціації:
Аніон, що утворюється, стабілізується за рахунок справакалізації заряду:

Нижчі карбонові кислоти, що містять до 3 атомів вуглецю – безбарвні рідини з характерним різким запахом, поєднуються з водою в будь-яких співвідношеннях. Більшість кислот, що містять 4-9 атомів, - маслянисті рідини з неприємним запахом. Кислоти, що містять більше 10 атомів водню, – тверді речовини, нерозчинні у воді.
Розчинність карбонових кислот у воді та високі температури кипіння пов'язані з утворенням міжмолекулярних водневих зв'язків. У твердому стані карбонові кислоти існують головним чином у вигляді циклічних димерів, а в рідкому відбувається лінійна асоціація:
Види карбонових кислот
Залежно від будови вуглеводневого радикалу, карбонові кислоти поділяються на:
- ароматичні (бензойна кислота)
- аліфатичні (граничні (капронова кислота) та ненасичені (акрилова кислота))
- аліциклічні (хінна кислота)
- гетероциклічні (нікотинова кислота).
За кількістю карбоксильних груп карбонові кислоти поділяються на:
- одноосновні ()
- двоосновні (щавлева кислота)
- багатоосновні (лимонна кислота).
При введенні в молекулу кислоти інших функціональних груп (-ОН, =CO, -NH 2 та ін) утворюються інші класи сполук: окси-, кетокислоти, та ін.
Загальна формула граничних одноосновних карбонових кислот:
З n H 2n O 2 (n= 1,2,3…) або Cn H 2n+1 COOH (n = 0,1,2…)
Загальна формула ненасичених одноосновних карбонових кислот:
З n H 2 n –2 O 2 (n= 1,2,3…) або C n H 2 n –1 COOH (n = 0,1,2…)
Загальна формула граничних двоосновних карбонових кислот:
C n H 2n–2 O 4 (n = 2,3…)
Назви та формули деяких карбонових кислот
|
Формула карбонової кислоти |
Назва по ІЮПАК |
Тривіальна назва |
|---|---|---|
|
Граничні одноосновні карбонові кислоти |
||
|
Ненасичені одноосновні карбонові кислоти |
||
|
Двоосновні карбонові кислоти |
||
Приклади розв'язання задач
ПРИКЛАД 1
| Завдання | У трьох однакових пробірках без підписів знаходяться три кислоти: мурашина, оцтова та соляна. Як на підставі різниці їх хімічних властивостей визначити, яка кислота знаходиться у кожній пробірці? |
| Рішення | Мурашина кислота виявляє також деякі властивості (відновлювальні). Тому її можна визначити, наприклад, щодо реакції з гідроксидом міді (II), у разі мурашиної кислоти утворюється оксид міді (I) червоного кольору: Розрізнити кислоти, що залишилися, можна по реакції з нітратом срібла. У разі соляної кислоти випадає білий осад хлориду срібла: Ацетат срібла розчиняється у воді, тому у пробірці зі змін не відбудеться. Таким чином, в пробірці, що залишилася, - оцтова кислота. |
ПРИКЛАД 2
| Завдання | Визначити якщо при гідролізі його зразка масою 2,64 г виділяється 1,38 г спирту і 1,8 г одноосновної карбонової кислоти. |
| Рішення | Загальна формула складного ефіру, що складається зі спирту та кислоти з різним числом атомів вуглецю: Таким чином, формула спирту: а формула кислоти: Запишемо рівняння гідролізу складного ефіру: Відповідно до закону збереження маси речовин, маса продуктів реакції дорівнює масі вихідних речовин. Розрахуємо масу: M(кислоти) + m(спирту) – m(ефіру) г Розрахуємо кількість речовини води: За рівнянням реакції n(кислоти) = n(спирту) моль |
 Рух тіл під дією сили тяжіння
Рух тіл під дією сили тяжіння Стежки та стилістичні фігури
Стежки та стилістичні фігури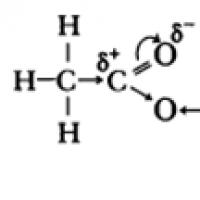 §12. Карбонові кислоти. Карбонові кислоти: фізичні властивості. Солі карбонових кислот Найпростіша карбонова кислота мурашина
§12. Карбонові кислоти. Карбонові кислоти: фізичні властивості. Солі карбонових кислот Найпростіша карбонова кислота мурашина Розмова з колишньою подругою
Розмова з колишньою подругою До чого сниться найкраща подруга, колишня приятелька чи подруга дитинства
До чого сниться найкраща подруга, колишня приятелька чи подруга дитинства Сонник вагітної сниться дитина
Сонник вагітної сниться дитина До чого сниться струм іскри. Навіщо сняться іскри? Що пишуть у сонниках
До чого сниться струм іскри. Навіщо сняться іскри? Що пишуть у сонниках