§12. Karbonskābes. Karbonskābes: fizikālās īpašības. Karbonskābju sāļi Vienkāršākā karbonskābe ir skudrskābe
DEFINĪCIJA
Tiek sauktas organiskas vielas, kuru molekulas satur vienu vai vairākas karboksilgrupas, kas saistītas ar ogļūdeņraža radikāli karbonskābes.
Pirmie trīs homologās karbonskābju sērijas locekļi, tostarp propionskābe, ir šķidrumi, kuriem ir asa smaka un kas labi šķīst ūdenī. Sekojošie homologi, sākot ar sviestskābi, arī ir šķidrumi, kuriem ir spēcīga nepatīkama smaka, bet kas slikti šķīst ūdenī. Augstākās skābes ar oglekļa atomu skaitu 10 vai vairāk ir cietas, bez smaržas, ūdenī nešķīstošas. Kopumā virknē homologu, palielinoties molekulmasai, samazinās šķīdība ūdenī, samazinās blīvums un palielinās viršanas temperatūra (1. tabula).
1. tabula. Karbonskābju homologās sērijas.
Karbonskābju sagatavošana
Karbonskābes iegūst, oksidējot piesātinātus ogļūdeņražus, spirtus un aldehīdus. Piemēram, etiķskābe - oksidējot etanolu ar kālija permanganāta šķīdumu skābā vidē, karsējot:
Karbonskābju ķīmiskās īpašības
Karbonskābju ķīmiskās īpašības galvenokārt nosaka to struktūras īpatnības. Tādējādi ūdenī šķīstošās skābes var sadalīties jonos:
R-COOH↔R-COO - + H + .
Sakarā ar H + jonu klātbūtni ūdenī, tiem ir skāba garša, tie spēj mainīt indikatoru krāsu un vadīt elektrisko strāvu. Ūdens šķīdumā šīs skābes ir vāji elektrolīti.
Karbonskābēm piemīt ķīmiskās īpašības, kas raksturīgas neorganisko skābju šķīdumiem, t.i. mijiedarbojas ar metāliem (1), to oksīdiem (2), hidroksīdiem (3) un vājajiem sāļiem (4):
2CH 3 -COOh + Zn → (CH 3 COO) 2 Zn + H2 (1);
2CH 3 -COOH + CuO → (CH 3 COO) 2 Cu + H 2 O (2);
R-COOH + KOH → R-COOK + H2O (3);
2CH 3 -COOH + NaHCO 3 → CH 3 COONa + H 2 O + CO 2 (4).
Īpaša piesātināto un nepiesātināto karbonskābju īpašība, kas izpaužas funkcionālajā grupā, ir mijiedarbība ar spirtiem.
Karsējot un koncentrētas sērskābes klātbūtnē, karbonskābes reaģē ar spirtiem. Piemēram, ja etiķskābei pievieno etilspirtu un nedaudz sērskābes, tad, karsējot, parādās etiletiķskābes (etilacetāta) smarža:
CH 3 -COOH + C 2 H 5 OH ↔CH 3 -C(O)-O-C 2 H 5 + H 2 O.
Īpaša piesātināto karbonskābju īpašība, kas izpaužas ar radikāļiem, ir halogenēšanas (hlorēšanas) reakcija.

Karbonskābju pielietojums
Karbonskābes kalpo kā izejviela ketonu, skābju halogenīdu, vinilesteru un citu svarīgu organisko savienojumu klašu ražošanai.
Skudrskābi plaši izmanto, lai iegūtu esterus, ko izmanto parfimērijā, ādas rūpniecībā (ādas miecēšana), tekstilrūpniecībā (kā kodinātāju krāsošanai), kā šķīdinātāju un konservantu.
Etiķskābes ūdens šķīdumu (70-80%) sauc par etiķa esenci, bet 3-9% ūdens šķīdumu sauc par galda etiķi. Esenci bieži izmanto, lai mājās iegūtu etiķi atšķaidot.
Problēmu risināšanas piemēri
1. PIEMĒRS
| Vingrinājums | Kādas ķīmiskās reakcijas var izmantot, lai veiktu šādas pārvērtības: a) CH 4 → CH 3 Cl → CH 3 OH → HCHO → HCOOH → HCOOK. Uzrakstiet reakciju vienādojumus un norādiet to rašanās nosacījumus. |
| Atbilde | a) Metāna hlorēšana gaismā izraisa hlormetāna ražošanu: CH 4 + Cl 2 → CH 3 Cl + HCl. Alkānu halogēnu atvasinājumi tiek hidrolizēti ūdens vai sārmainā vidē, veidojot spirtus: CH 3 Cl + NaOH → CH 3 OH + NaCl. Primāro spirtu oksidēšanas rezultātā, piemēram, ar kālija dihromātu skābā vidē katalizatora (Cu, CuO, Pt, Ag) klātbūtnē, veidojas aldehīdi: CH3OH+ [O] →HCHO. Aldehīdus viegli oksidē līdz atbilstošām karbonskābēm, piemēram, ar kālija permanganātu: HCHO + [O] → HCOOH. Karbonskābēm piemīt visas vājajām minerālskābēm raksturīgās īpašības, t.i. spēj mijiedarboties ar aktīviem metāliem, veidojot sāļus: 2HCOOH+ 2K → 2HCOOK + H 2 . |
2. PIEMĒRS
| Vingrinājums | Uzrakstiet reakcijas vienādojumus starp šādām vielām: a) 2-metilpropānskābe un hlors; b) etiķskābe un propanols-2; c) akrilskābes un broma ūdens; d) 2-metilbutānskābe un fosfora (V) hlorīds. Norādiet reakcijas apstākļus. |
| Atbilde | a) 2-metilpropānskābes un hlora reakcijas rezultātā ogļūdeņraža radikālā, kas atrodas a-pozīcijā, tiek aizstāts ūdeņraža atoms; Veidojas 2-metil-2-hlorpropānskābe H 3 C-C(CH 3)H-COOH + Cl 2 → H 3 C-C(CH 3)Cl-COOH + HCl (kat = P). b) etiķskābes un propanola-2 reakcijas rezultātā veidojas esteris - etiķskābes izopropilesteris. CH3-COOH + CH3-C(OH)H-CH3 → CH3-C(O)-O-C(CH3)-CH3. c) akrilskābes un broma ūdens mijiedarbības reakcijas rezultātā halogēna pievienošana dubultās saites vietā saskaņā ar Markovņikova likumu; Veidojas 2,3-dibrompropānskābe CH2 =CH-COOH + Br2 → CH2Br-CHBr-COOH d) 2-metilbutānskābes un fosfora (V) hlorīda reakcijas rezultātā veidojas atbilstošais skābes hlorīds CH 3 -CH 2 -C(CH 3)H-COOH + PCl5 → CH 3 -CH 2 -C(CH 3)H-COOCl + POCl 3 + HCl. |
Karbonskābes- organiskas vielas, kuru molekulas satur vienu vai vairākas karboksilgrupas.
Karboksilgrupa (saīsināti kā COOH) ir karbonskābju funkcionāla grupa, kas sastāv no karbonilgrupas un ar to saistītās hidroksilgrupas.
Pamatojoties uz karboksilgrupu skaitu, karbonskābes iedala vienbāziskās, divbāziskās utt.
Vienbāzisko karbonskābju vispārējā formula ir R-COOH. Divbāziskās skābes piemērs ir skābeņskābe HOOC-COOH.
Pamatojoties uz radikāļu veidu, karbonskābes iedala piesātinātajās (piemēram, etiķskābe CH 3 COOH), nepiesātinātajās [piemēram, akrilskābe CH 2 =CH-COOH, oleīnskābe CH 3 - (CH 2) 7 -CH =CH—(CH 2) 7 -COOH] un aromātisks (piemēram, benzoskābe C 6 H 5 -COOH).
Izomēri un homologi
Vienbāziskās piesātinātās karbonskābes R-COOH ir esteru (saīsināti R"-COOR") izomēri ar vienādu oglekļa atomu skaitu. Abu vispārējā formula ir C n H 2 n O2.
| G | HCOOH metāns (skudra) |
||||
| CH3COOH etāns (etiķskābe) | HCOOCH 3 skudrskābes metilesteris |
||||
| CH3CH2COOH propāns (propionskābe) |
HCOOCH 2 CH 3 etilskudrskābe |
CH 3 KUVIENS 3 etiķskābes metilesteris | |||
| CH3(CH2)2COOH butāns (eļļa) |
2-metilpropāns |
HCOOCH 2 CH 2 CH 3 skudrskābes propilesteris |
CH 3 COOCH 2 CH 3 etilacetāts |
CH 3 CH 2 COOCH 3 propionskābes metilesteris |
|
| izomēri | |||||
Algoritms karbonskābju nosaukumu sastādīšanai
- Atrodiet oglekļa mugurkaulu - tā ir garākā oglekļa atomu ķēde, ieskaitot karboksilgrupas oglekļa atomu.
- Numurējiet oglekļa atomus galvenajā ķēdē, sākot ar karboksiloglekļa atomu.
- Nosauciet savienojumu, izmantojot ogļūdeņražu algoritmu.
- Nosaukuma beigās pievienojiet sufiksu “-ov”, galotni “-aya” un vārdu “skābe”.
Karbonskābju molekulās lpp-hidroksilgrupas skābekļa atomu elektroni mijiedarbojas ar karbonilgrupas -saites elektroniem, kā rezultātā palielinās O-H saites polaritāte, nostiprinās -saite karbonilgrupā, daļējais lādiņš (+) uz oglekļa atoma samazinās un palielinās daļējais lādiņš (+) uz ūdeņraža atoma .
Pēdējais veicina spēcīgu ūdeņraža saišu veidošanos starp karbonskābes molekulām.
Piesātināto vienbāzisko karbonskābju fizikālās īpašības lielā mērā ir saistītas ar spēcīgu ūdeņraža saišu klātbūtni starp molekulām (stiprākas nekā starp spirta molekulām). Tāpēc skābju viršanas temperatūra un šķīdība ūdenī ir augstāka nekā attiecīgajiem spirtiem.
Skābju ķīmiskās īpašības
-saites stiprināšana karbonilgrupā noved pie tā, ka pievienošanas reakcijas nav raksturīgas karbonskābēm.
- Degšana:
CH 3 COOH + 2O 2 2CO 2 + 2H 2 O
- Skābās īpašības.
O-H saites augstās polaritātes dēļ karbonskābes ūdens šķīdumā manāmi sadalās (precīzāk, reaģē ar to atgriezeniski):HCOOH HCOO - + H + (precīzāk HCOOH + H 2 O HCOO - + H 3 O +)
Visas karbonskābes ir vāji elektrolīti. Palielinoties oglekļa atomu skaitam, skābju stiprums samazinās (sakarā ar O-H saites polaritātes samazināšanos); gluži pretēji, halogēna atomu ievadīšana ogļūdeņraža radikālā izraisa skābes stiprības palielināšanos. Jā, pēc kārtasHCOOH CH 3 COOH C 2 H 5 COOH
skābju stiprums samazinās, un sērijāPieaug.
Karbonskābēm piemīt visas vājajām skābēm raksturīgās īpašības:
Mg + 2CH 3 COOH (CH 3 COO) 2 Mg + H 2
CaO + 2CH 3 COOH (CH 3 COO) 2 Ca + H 2 O
NaOH + CH 3 COOH CH 3 COONa + H 2 O
K 2 CO 3 + 2CH 3 COOH 2CH 3 COOK + H 2 O + CO 2 - Esterifikācija (karbonskābju reakcija ar spirtiem, kā rezultātā veidojas esteris):
Esterifikācijas reakcijā var iesaistīties arī daudzvērtīgie spirti, piemēram, glicerīns. Esteri, ko veido glicerīns un augstākās karbonskābes (taukskābes), ir tauki.Tauki ir triglicerīdu maisījumi. Piesātinātās taukskābes (palmitīnskābe C 15 H 31 COOH, stearīnskābe C 17 H 35 COOH) veido cietus dzīvnieku izcelsmes taukus, bet nepiesātinātās taukskābes (oleīns C 17 H 33 COOH, linolskābe C 17 H 31 COOH u.c.) veido šķidros taukus. augu izcelsmes (eļļas).
- Aizvietošana ogļūdeņraža radikālā:
Aizstāšana notiek pozīcijā -.Skudrskābes HCOOH īpatnība ir tāda, ka šī viela ir bifunkcionāls savienojums, tā ir gan karbonskābe, gan aldehīds:
Tāpēc skudrskābe, cita starpā, reaģē ar sudraba oksīda amonjaka šķīdumu (sudraba spoguļa reakcija; kvalitatīva reakcija):HCOOH + Ag 2 O (amonjaka šķīdums) CO 2 + H 2 O + 2Ag
Karbonskābju sagatavošana
.
O
//
-C atomu grupu sauc par karboksilgrupu vai karboksilgrupu.
\
Ak!
Organiskās skābes, kas satur vienu karboksilgrupu molekulā, ir vienbāziskas. Šo skābju vispārējā formula ir RCOOH.
Karbonskābes, kas satur divas karboksilgrupas, sauc par divbāziskām. Tajos ietilpst, piemēram, skābeņskābe un dzintarskābe.
Ir arī daudzbāziskas karbonskābes, kas satur vairāk nekā divas karboksilgrupas. Tajos ietilpst, piemēram, trīsbāziskā citronskābe. Atkarībā no ogļūdeņraža radikāļa rakstura karbonskābes iedala piesātinātajās, nepiesātinātajās un aromātiskajās.
Piesātinātās vai piesātinātās karbonskābes ir, piemēram, propānskābe (propionskābe) vai jau pazīstamā dzintarskābe.
Acīmredzot piesātinātās karbonskābes nesatur P-saites ogļūdeņraža radikālā.
Nepiesātināto karbonskābju molekulās karboksilgrupa ir saistīta ar nepiesātinātu, nepiesātinātu ogļūdeņraža radikāli, piemēram, akrila (propēnskābes) CH2=CH-COOH vai oleīna CH3-(CH2)7-CH=CH-(CH2) molekulās. 7-COOH un citas skābes.
Kā redzams no benzoskābes formulas, tā ir aromātiska, jo tā molekulā satur aromātisku (benzola) gredzenu.
Nomenklatūra un izomerisms
Mēs jau esam apsvēruši vispārējos karbonskābju, kā arī citu organisko savienojumu nosaukumu veidošanas principus. Sīkāk pakavēsimies pie mono- un divbāzisko karbonskābju nomenklatūras. Karbonskābes nosaukumu veido no atbilstošā alkāna nosaukuma (alkāna ar vienādu oglekļa atomu skaitu molekulā), pievienojot sufiksu -ov, galotni -aya un vārdu skābe. Oglekļa atomu numerācija sākas ar karboksilgrupu. Piemēram:
Daudzām skābēm ir arī vēsturiski izveidoti vai triviāli nosaukumi (6. tabula). 
Pēc pirmās iepazīšanās ar daudzveidīgo un interesanto organisko skābju pasauli mēs sīkāk aplūkosim piesātinātās vienbāziskās karbonskābes.
Ir skaidrs, ka šo skābju sastāvu atspoguļos vispārējā formula C n H 2n O2, vai C n H 2n +1 COOH, vai RCOOH.
Piesātināto vienbāzisko karbonskābju fizikālās īpašības
Zemākas skābes, t.i., skābes ar salīdzinoši mazu molekulmasu, kas satur līdz četriem oglekļa atomiem vienā molekulā, ir šķidrumi ar raksturīgu asu smaku (atcerieties etiķskābes smaržu). Skābes, kas satur no 4 līdz 9 oglekļa atomiem, ir viskozi eļļaini šķidrumi ar nepatīkamu smaku; kas satur vairāk nekā 9 oglekļa atomus vienā molekulā - cietas vielas, kas nešķīst ūdenī. Piesātināto vienbāzisko karbonskābju viršanas temperatūra palielinās, palielinoties oglekļa atomu skaitam molekulā un līdz ar to palielinoties relatīvajai molekulmasai. Piemēram, skudrskābes viršanas temperatūra ir 101 °C, etiķskābe ir 118 °C, bet propionskābe ir 141 °C.
Vienkāršākā karbonskābe, skudrskābe HCOOH, ar mazu relatīvo molekulmasu (46), normālos apstākļos ir šķidrums ar viršanas temperatūru 100,8 °C. Tajā pašā laikā butāns (MR(C4H10) = 58) tādos pašos apstākļos ir gāzveida un tā viršanas temperatūra ir -0,5 °C. Šī viršanas punktu un relatīvo molekulmasu neatbilstība ir izskaidrojama ar karbonskābes dimēru veidošanos, kurā divas skābes molekulas ir saistītas ar divām ūdeņraža saitēm. Ūdeņraža saišu rašanās kļūst skaidra, ņemot vērā karbonskābes molekulu struktūru.
Piesātināto vienbāzisko karbonskābju molekulas satur polāru atomu grupu - karboksilgrupu (padomājiet par to, kas izraisa šīs funkcionālās grupas polaritāti) un praktiski nepolāru ogļūdeņraža radikāli. Karboksilgrupa tiek piesaistīta ūdens molekulām, veidojot ar tām ūdeņraža saites.
Skudrskābes un etiķskābes neierobežoti šķīst ūdenī. Ir acīmredzams, ka, palielinoties atomu skaitam ogļūdeņraža radikālā, karbonskābju šķīdība samazinās.
Zinot karbonskābes molekulu sastāvu un uzbūvi, mums nebūs grūti saprast un izskaidrot šo vielu ķīmiskās īpašības.
Ķīmiskās īpašības
Skābju (gan organisko, gan neorganisko) klasei raksturīgās vispārīgās īpašības ir saistītas ar hidroksilgrupas klātbūtni molekulās, kas satur ļoti polāru saiti starp ūdeņraža un skābekļa atomiem. Šīs īpašības jums ir labi zināmas. Apskatīsim tos vēlreiz, izmantojot ūdenī šķīstošo organisko skābju piemēru.
1. Disociācija ar skābes atlikuma ūdeņraža katjonu un anjonu veidošanos. Precīzāk, šo procesu apraksta vienādojums, kas ņem vērā ūdens molekulu līdzdalību tajā.
Karbonskābju disociācijas līdzsvars ir nobīdīts pa kreisi; lielākā daļa no tām ir vāji elektrolīti. Tomēr, piemēram, skudrskābes un etiķskābes skābā garša ir izskaidrojama ar skābju atlikumu disociāciju ūdeņraža katjonos un anjonos.
Acīmredzami, ka “skābā” ūdeņraža klātbūtne karbonskābju molekulās, t.i., karboksilgrupas ūdeņradis, nosaka arī citas raksturīgas īpašības.
2. Mijiedarbība ar metāliem elektroķīmiskā sprieguma diapazonā līdz ūdeņradim. Tādējādi dzelzs reducē ūdeņradi no etiķskābes:
2CH3-COOH + Fe -> (CHgCOO)2Fe + H2
3. Mijiedarbība ar bāzes oksīdiem, veidojot sāli un ūdeni:
2R-COOH + CaO -> (R-COO) 2Ca + H20
4. Reakcija ar metālu hidroksīdiem, veidojot sāli un ūdeni (neitralizācijas reakcija):
R-COOH + NaOH -> R-COONa + H20 3R-COOH + Ca(OH)2 -> (R-COO) 2Ca + 2H20
5. Mijiedarbība ar vājāku skābju sāļiem, veidojoties pēdējām. Tādējādi etiķskābe izspiež stearīnskābi no nātrija stearāta un ogļskābi no kālija karbonāta.
6. Karbonskābju mijiedarbība ar spirtiem, veidojot esterus, ir jums jau zināmā esterifikācijas reakcija (viena no svarīgākajām karbonskābēm raksturīgajām reakcijām). Karbonskābju mijiedarbību ar spirtiem katalizē ūdeņraža katjoni.
Esterifikācijas reakcija ir atgriezeniska. Līdzsvars novirzās uz estera veidošanos atūdeņošanas līdzekļu klātbūtnē un estera izņemšanu no reakcijas maisījuma.
Esterifikācijas apgrieztajā reakcijā, ko sauc par esteru hidrolīzi (esterim reaģējot ar ūdeni), veidojas skābe un spirts. Ir skaidrs, ka daudzvērtīgie spirti, piemēram, glicerīns, var reaģēt arī ar karbonskābēm, t.i., iesaistīties esterifikācijas reakcijā: 
Visas karbonskābes (izņemot skudrskābi) kopā ar karboksilgrupu satur ogļūdeņraža atlikumus to molekulās. Protams, tas nevar neietekmēt skābju īpašības, kuras nosaka ogļūdeņraža atlikuma raksturs.
7. Pievienošanās reakcijas pie daudzkārtējas saites - tajās nonāk nepiesātinātās karbonskābes; piemēram, ūdeņraža pievienošanas reakcija ir hidrogenēšana. Kad oleīnskābe tiek hidrogenēta, veidojas piesātināta stearīnskābe.
Nepiesātinātās karbonskābes, tāpat kā citi nepiesātinātie savienojumi, pievieno halogēnus, izmantojot dubultsaiti. Piemēram, akrilskābe maina broma ūdeni.
8. Aizvietošanas reakcijas (ar halogēniem) - tajā var iekļūt piesātinātās karbonskābes; piemēram, reaģējot etiķskābi ar hloru, var iegūt dažādas hlorētas skābes:

Halogenējot karbonskābes, kas satur vairāk nekā vienu oglekļa atomu ogļūdeņraža atlikumā, ir iespējama produktu veidošanās ar dažādām halogēna pozīcijām molekulā. Ja reakcija notiek, izmantojot brīvo radikāļu mehānismu, visus ūdeņraža atomus ogļūdeņraža atlikumā var aizstāt. Ja reakciju veic neliela daudzuma sarkanā fosfora klātbūtnē, tad tā norit selektīvi – ūdeņradis tiek aizstāts tikai A-pozīcija (pie funkcionālajai grupai vistuvāk esošā oglekļa atoma) skābes molekulā. Šīs selektivitātes cēloņus uzzināsiet, studējot ķīmiju augstskolā.
Aizvietojot hidroksilgrupu, karbonskābes veido dažādus funkcionālus atvasinājumus. Kad šie atvasinājumi tiek hidrolizēti, atkal veidojas karbonskābe.
Karbonskābes hlorīdu var iegūt, reaģējot fosfora (III) hlorīdam vai tionilhlorīdam (SOCl 2) ar skābi. Karbonskābes anhidrīdus iegūst, hlora anhidrīdiem reaģējot ar karbonskābes sāļiem. Esteri veidojas, esterificējot karbonskābes ar spirtiem. Esterizāciju katalizē neorganiskās skābes.
Šo reakciju ierosina karboksilgrupas protonēšana – ūdeņraža katjona (protona) mijiedarbība ar skābekļa atoma vientuļo elektronu pāri. Karboksilgrupas protonēšana izraisa oglekļa atoma pozitīvā lādiņa palielināšanos tajā:

Iegūšanas metodes
Karbonskābes var iegūt, oksidējot primāros spirtus un aldehīdus.
Aromātiskās karbonskābes veidojas, oksidējoties benzola homologiem.
Arī dažādu karbonskābes atvasinājumu hidrolīzes rezultātā rodas skābes. Tādējādi estera hidrolīze rada spirtu un karbonskābi. Kā minēts iepriekš, skābes katalizētās esterifikācijas un hidrolīzes reakcijas ir atgriezeniskas. Estera hidrolīze sārmu ūdens šķīduma ietekmē notiek neatgriezeniski; šajā gadījumā no estera veidojas nevis skābe, bet gan tās sāls. Nitrilu hidrolīzes laikā vispirms veidojas amīdi, kas pēc tam pārvēršas skābēs. Karbonskābes veidojas organisko magnija savienojumu mijiedarbībā ar oglekļa monoksīdu (IV).
Atsevišķi karbonskābju pārstāvji un to nozīme
Skudrskābe (metānskābe) HCOOH ir šķidrums ar asu smaku un viršanas temperatūru 100,8 °C, labi šķīst ūdenī. Skudrskābe ir indīga un, nonākot saskarē ar ādu, izraisa apdegumus! Skudru izdalītais dzēlīgais šķidrums satur šo skābi. Skudrskābei piemīt dezinficējošas īpašības, tāpēc to izmanto pārtikas, ādas un farmācijas rūpniecībā, kā arī medicīnā. To izmanto arī audumu un papīra krāsošanā.
Etiķskābe (etānskābe) CH3COOH ir bezkrāsains šķidrums ar raksturīgu asu smaku, sajaucas ar ūdeni jebkurā attiecībā. Etiķskābes ūdens šķīdumi tiek tirgoti ar nosaukumu etiķis (3-5% šķīdums) un etiķa esence (70-80% šķīdums), un tos plaši izmanto pārtikas rūpniecībā. Etiķskābe ir labs šķīdinātājs daudzām organiskām vielām, tāpēc to izmanto krāsošanai, miecēšanai, kā arī krāsu un laku rūpniecībā. Turklāt etiķskābe ir izejviela daudzu tehniski svarīgu organisko savienojumu ražošanai: no tās iegūst, piemēram, nezāļu apkarošanai izmantojamās vielas – herbicīdus. 
Etiķskābe ir galvenā vīna etiķa sastāvdaļa, kuras raksturīgā smarža ir saistīta ar to. Tas ir etanola oksidēšanās produkts un veidojas no tā, vīnu uzglabājot gaisā.
Nozīmīgākie augstāko piesātināto vienbāzisko skābju pārstāvji ir palmitīnskābes C15H31COOH un stearīnskābes C17H35COOH. Atšķirībā no zemākajām skābēm šīs vielas ir cietas un slikti šķīst ūdenī.
Taču to sāļi – stearāti un palmitāti – labi šķīst un tiem piemīt mazgāšanas efekts, tāpēc tos sauc arī par ziepēm. Ir skaidrs, ka šīs vielas tiek ražotas lielā apjomā.
No nepiesātinātajām augstākajām karbonskābēm vislielākā nozīme ir oleīnskābei C17H33COOH vai (CH2)7COOH. Tas ir eļļai līdzīgs šķidrums bez garšas un smaržas. Tās sāļus plaši izmanto tehnoloģijā.
Vienkāršākais divbāzisko karbonskābju pārstāvis ir skābeņskābe (etāndijskābe) HOOC-COOH, kuras sāļi ir atrodami daudzos augos, piemēram, skābenes un skābenes. Skābeņskābe ir bezkrāsaina kristāliska viela, kas labi šķīst ūdenī. To izmanto metālu pulēšanai, kokapstrādes un ādas rūpniecībā.
1. Nepiesātinātā elaīnskābe C17H33COOH ir oleīnskābes trans-izomērs. Uzrakstiet šīs vielas strukturālo formulu.
2. Uzrakstiet oleīnskābes hidrogenēšanas reakcijas vienādojumu. Nosauciet šīs reakcijas produktu.
3. Uzrakstiet stearīnskābes degšanas reakcijas vienādojumu. Kāds skābekļa un gaisa tilpums (n.a.) būs nepieciešams, lai sadedzinātu 568 g stearīnskābes?
4. Cieto taukskābju – palmitīnskābes un stearīnskābes – maisījumu sauc par stearīnu (tieši no tā gatavo stearīna svecītes). Kāds gaisa tilpums (n.a.) būs nepieciešams, lai sadedzinātu divsimt gramu stearīnskābes sveci, ja stearīns satur vienādu palmitīnskābes un stearīnskābes masu? Kāds oglekļa dioksīda tilpums (n.o.) un ūdens masa veidojas šajā gadījumā?
5. Atrisiniet iepriekšējo uzdevumu ar nosacījumu, ka svecē ir vienāds daudzums (vienāds molu skaits) stearīnskābes un palmitīnskābes.
6. Lai noņemtu rūsas traipus, apstrādājiet tos ar etiķskābes šķīdumu. Sastādiet molekulāros un jonu vienādojumus šajā gadījumā notiekošajām reakcijām, ņemot vērā, ka rūsa satur dzelzs(III) oksīdu un hidroksīdu - Fe2O3 un Fe(OH)3. Kāpēc šādus traipus neizņem ar ūdeni? Kāpēc tie pazūd, apstrādājot ar skābes šķīdumu?
7. Cepamais (cepamais) sodas NaHC03, kas pievienots bezrauga mīklai, vispirms tiek “dzēsts” ar etiķskābi. Veiciet šo reakciju mājās un uzrakstiet tās vienādojumu, zinot, ka ogļskābe ir vājāka par etiķskābi. Izskaidrojiet putu veidošanos.
8. Zinot, ka hlors ir vairāk elektronnegatīvs nekā ogleklis, sakārtojiet šādas skābes: etiķskābi, propionskābi, hloretiķskābi, dihloretiķskābi un trihloretiķskābi skābju īpašību palielināšanas secībā. Pamatojiet savu rezultātu.
9. Kā mēs varam izskaidrot, ka skudrskābe reaģē “sudraba spoguļa” reakcijā? Uzrakstiet šīs reakcijas vienādojumu. Kādu gāzi šajā gadījumā var atbrīvot?
10. Kad 3 g piesātinātas vienbāziskas karbonskābes reaģēja ar magnija pārpalikumu, izdalījās 560 ml (n.s.) ūdeņraža. Nosakiet skābes formulu.
11. Dodiet reakciju vienādojumus, ar kuriem var aprakstīt etiķskābes ķīmiskās īpašības. Nosauciet šo reakciju produktus.
12. Iesakiet vienkāršu laboratorijas metodi, pēc kuras jūs varat atpazīt propānskābes un akrilskābes.
13. Uzrakstiet metilformiāta - metanola un skudrskābes estera - veidošanās reakcijas vienādojumu. Kādos apstākļos šī reakcija būtu jāveic?
14. Sastādiet struktūrformulas vielām ar sastāvu C3H602. Kādās vielu klasēs tās var klasificēt? Norādiet katram no tiem raksturīgos reakciju vienādojumus.
15. Viela A – etiķskābes izomērs – nešķīst ūdenī, bet var iziet hidrolīzi. Kāda ir vielas A strukturālā formula? Nosauciet tā hidrolīzes produktus.
16. Sastādiet šādu vielu struktūrformulas:
a) metilacetāts;
b) skābeņskābe;
c) skudrskābe;
d) dihloretiķskābe;
e) magnija acetāts;
f) etilacetāts;
g) etilformiāts;
h) akrilskābe.
17*. Piesātinātas vienbāziskas organiskās skābes paraugs, kas sver 3,7 g, tika neitralizēts ar nātrija bikarbonāta ūdens šķīdumu. Izlaižot atbrīvoto gāzi caur kaļķa ūdeni, tika iegūti 5,0 g nogulsnes. Kāda skābe tika uzņemta un kāds bija izdalītās gāzes tilpums?
Karbonskābes dabā
Karbonskābes dabā ir ļoti izplatītas. Tie ir atrodami augļos un augos. Tie atrodas adatās, sviedros, urīnā un nātru sulā. Ziniet, izrādās, ka lielākā daļa skābju veido esterus, kuriem ir smarža. Tādējādi pienskābes smarža, kas atrodas cilvēka sviedros, pievelk odus, kas to sajūt diezgan ievērojamā attālumā. Tāpēc, lai kā jūs mēģinātu aizdzīt kaitinošo odu, tas joprojām labi jūtas par savu upuri. Papildus cilvēka sviedriem pienskābe ir atrodama marinētajos gurķos un skābētos kāpostos.
Un pērtiķu mātītes, lai piesaistītu tēviņu, izdala etiķskābi un propionskābi. Suņa jutīgais deguns var sajust sviestskābes smaržu, kuras koncentrācija ir 10–18 g/cm3.
Daudzas augu sugas spēj ražot etiķskābi un sviestskābi. Un dažas nezāles izmanto šo iespēju un, atbrīvojot vielas, iznīcina savus konkurentus, nomācot to augšanu un dažreiz izraisot to nāvi.
Arī indieši izmantoja skābi. Lai iznīcinātu ienaidnieku, viņi mērcēja bultas ar nāvējošu indi, kas izrādījās etiķskābes atvasinājums.
Un šeit rodas dabisks jautājums: vai skābes apdraud cilvēka veselību? Galu galā dabā plaši izplatītā skābeņskābe, kas atrodama skābenēs, apelsīnos, jāņogās un avenes, nez kāpēc nav atradusi pielietojumu pārtikas rūpniecībā. Izrādās, ka skābeņskābe ir divsimt reižu stiprāka par etiķskābi un var pat sarūsēt traukus, un tās sāļi, uzkrājoties cilvēka organismā, veido akmeņus.
Skābes ir atradušas plašu pielietojumu visās cilvēka dzīves jomās. Tos izmanto medicīnā, kosmetoloģijā, pārtikas rūpniecībā, lauksaimniecībā un mājsaimniecības vajadzībām.
Medicīniskiem nolūkiem tiek izmantotas organiskās skābes, piemēram, pienskābe, vīnskābe un askorbīns. Droši vien katrs no jums lietoja C vitamīnu, lai stiprinātu organismu – tā ir tieši askorbīnskābe. Tas ne tikai palīdz stiprināt imūnsistēmu, bet arī spēj izvadīt no organisma kancerogēnus un toksīnus. Pienskābi izmanto cauterizācijai, jo tā ir ļoti higroskopiska. Bet vīnskābe darbojas kā viegls caurejas līdzeklis, kā pretlīdzeklis saindēšanās ar sārmiem gadījumā un kā sastāvdaļa, kas nepieciešama plazmas sagatavošanai asins pārliešanai.
Taču kosmētisko procedūru cienītājiem jāzina, ka citrusaugļos esošās augļskābes labvēlīgi iedarbojas uz ādu, jo, dziļi iekļūstot, var paātrināt ādas atjaunošanās procesu. Turklāt citrusaugļu smaržai ir tonizējoša ietekme uz nervu sistēmu.
Vai esat ievērojuši, ka ogas, piemēram, dzērvenes un brūklenes, tiek uzglabātas ilgu laiku un saglabājas svaigas. Vai Tu zini kapēc? Izrādās, ka tajos ir benzoskābe, kas ir lielisks konservants.
Bet lauksaimniecībā dzintarskābe ir plaši izmantota, jo to var izmantot, lai palielinātu kultivēto augu produktivitāti. Tas var arī stimulēt augu augšanu un paātrināt to attīstību.
1.Karbonskābes – tās ir skābekli saturošas organiskas vielas, kuru molekulas satur vienu vai vairākas karboksilgrupas
(-C OOH ), kas savienots ar oglekļa radikāli vai ūdeņraža atomu.
Karboksilgrupā ir divas funkcionālās grupas - karbonilgrupa >C=O un hidroksilgrupa, kas ir tieši saistītas viena ar otru:
2. Klasifikācija
A) Pēc karboksilgrupu skaita molekulā
|
Vārds |
Piemēri |
|
1) Vienbāzes |
Metāns jauns , skudrskābe Etāns jauns , etiķskābe |
|
2) Divbāzu |
HOOC-COOH Skābeņskābe |
|
3) Polybasic |
B) Pēc ogļūdeņraža radikāļa rakstura
|
Vārds |
Piemēri |
|
1) Ierobežojums (piesātināts) |
HCOOH Metāns jauns , skudrskābe CH3COOH Etāns jauns , etiķskābe |
|
2) neierobežots |
Akrilskābe CH2 = CHCOOH Krotonskābe CH 3 –CH=CH–COOH Oleīnskābe CH 3 – (CH 2) 7 –CH=CH– (CH 2) 7 –COOH Linolskābe CH 3 – (CH 2) 4 – (CH=CH–CH 2) 2 – (CH 2) 6 –COOH Linolēns CH 3 –CH 2 – (CH=CH–CH 2) 3 – (CH 2) 6 –COOH |
|
3) Aromātisks |
C 6 H 5 COOH – benzoskābe NOOS–C 6 H 4 –COOH Pāris- tereftalskābe |
3. Izomērisms un nomenklatūra
es . Strukturāls
A) Oglekļa skeleta izomerisms (sākot no C 4 )
B) Starpklase ar esteriem R - CO - O - R 1 (sākot no C 2)
Piemēram: C3H6O2
CH 3 -CH 2 -COOH propionskābe
AR Etiķskābes H 3 -CO -OCH 3 metilesteris
II . Telpiskā
A) Optiskais
Piemēram:
B) Cis-trans izomērija nepiesātinātām skābēm
Piemērs:
4. Karbonskābju nomenklatūra
Skābju sistemātiskie nosaukumi tiek doti ar atbilstošā ogļūdeņraža nosaukumu, pievienojot sufiksu - jauns un vārdi skābe.
Lai norādītu aizvietotāja (vai radikāļa) pozīciju, oglekļa ķēdes numerācija sākas no karboksilgrupas oglekļa atoma. Piemēram, savienojumu ar sazarotu oglekļa ķēdi (CH 3) 2 CH-CH 2 -COOH sauc 3-metilbutānskābe. Triviālie nosaukumi tiek plaši izmantoti arī organiskajām skābēm, kas parasti atspoguļo dabisko avotu, kur savienojumi pirmo reizi tika atklāti.
Dažas vienbāziskās skābes
|
Formula |
Skābes nosaukums R-COOH |
Atlikuma nosaukums RCOO - |
|
|
sistemātiski |
triviāls |
||
|
HCOOH |
metāns |
skudra |
formātā |
|
CH3COOH |
etāns |
etiķis |
acetāts |
|
C2H5COOH |
propāns |
propionskābe |
propionāts |
|
C3H7COOH |
butāns |
eļļa |
butirāts |
|
C4H9COOH |
pentāns |
baldriāns |
valerāts |
|
C5H11COOH |
heksāns |
neilons |
kaprat |
|
C15H31COOH |
heksadekāns |
palmitisks |
palmitāts |
|
C17H35COOH |
oktadekāns |
stearic |
stearāts |
|
C6H5COOH |
benzolkarbonāts |
benzoīns |
benzoāts |
|
CH2=CH-COOH |
propēns |
akrils |
akrilāts |
Daudzbāziskām skābēm izmanto sufiksus -diovaya, -triovaya utt.
Piemēram:
HOOC-COOH- etāndijskābe (skābeņskābe);
HOOC-CH2-COOH - propāndijskābe (malonskābe).
IEROBEŽOJUMS MONOBĀZISKARBOKSĀBES
CnH 2 n +1 - COOHvaiCnH 2 nO 2
Homologa sērija
|
Vārds |
Formula skābes |
t pl. |
t kip. |
ρ |
|
|
skābes |
|||||
|
skudra |
metāns |
HCOOH |
100,5 |
1,22 |
|
|
etiķis |
etāns |
CH3COOH |
16,8 |
1,05 |
|
|
propionskābe |
propāns |
CH3CH2COOH |
0,99 |
||
|
eļļa |
butāns |
CH3(CH2)2COOH |
0,96 |
||
Karboksilgrupas struktūra
Karboksilgrupa apvieno divas funkcionālās grupas - karbonil>C = O un hidroksilgrupu, kas savstarpēji ietekmē viena otru:
Karbonskābju skābās īpašības ir saistītas ar elektronu blīvuma pāreju uz karbonilskābekli un no tā izrietošo papildu (salīdzinājumā ar spirtiem) O-H saites polarizāciju.
Ūdens šķīdumā karbonskābes sadalās jonos:
Šķīdība ūdenī un skābju augsta viršanas temperatūra ir saistīta ar starpmolekulāro ūdeņraža saišu veidošanos.
Palielinoties molekulmasai, skābju šķīdība ūdenī samazinās.
Piesātināto vienbāzisko skābju fizikālās īpašības
Šīs sērijas apakšējie elementi normālos apstākļos ir šķidrumi ar raksturīgu asu smaku. Piemēram, etānskābei (etiķskābei) ir raksturīga “etiķskābes” smarža. Bezūdens etiķskābe istabas temperatūrā ir šķidrums; 17 °C temperatūrā tas sasalst, pārvēršoties ledainā vielā, ko sauc par “ledus” etiķskābi. Šīs homologās sērijas vidējie pārstāvji ir viskozi, “eļļaini” šķidrumi; sākot no C 10 - cietas vielas.
Vienkāršākā aromātiskā skābe - benzoskābe C 6 H 5 COOH (mp 122,4 ° C) - viegli sublimējas, t.i. pārvēršas gāzveida stāvoklī, apejot šķidro stāvokli. Atdzesējot, tā tvaiki sublimējas kristālos. Šo īpašību izmanto, lai attīrītu vielu no piemaisījumiem.
DEFINĪCIJA
Karbonskābes– organiskie savienojumi, kuru molekulas satur vienu vai vairākas funkcionālās karboksilgrupas – COOH, kas saistītas ar ogļūdeņraža radikāli.
Karboksilgrupa sastāv no karbonilgrupas > C= O un saistītā hidroksilgrupa –OH.
Karbonskābju vispārējā formula ir R-COOH.
Karbonskābju skābās īpašības ir saistītas ar elektronu blīvuma nobīdi uz karbonilskābekli, kas izraisa daļēja pozitīva lādiņa parādīšanos atomā.
Rezultātā palielinās O-H saites polaritāte, un kļūst iespējams disociācijas process:
Iegūtais anjons tiek stabilizēts lādiņa delokalizācijas dēļ:

Zemākās karbonskābes, kas satur līdz 3 oglekļa atomiem, ir bezkrāsaini šķidrumi ar raksturīgu asu smaku, sajaucas ar ūdeni jebkurā attiecībā. Lielākā daļa skābju, kas satur 4–9 atomus, ir eļļaini šķidrumi ar nepatīkamu smaku. Skābes, kas satur vairāk nekā 10 ūdeņraža atomus, ir cietas vielas, kas nešķīst ūdenī.
Karbonskābju šķīdība ūdenī un augsta viršanas temperatūra ir saistīta ar starpmolekulāro ūdeņraža saišu veidošanos. Cietā stāvoklī karbonskābes galvenokārt pastāv ciklisku dimēru veidā, un šķidrā stāvoklī notiek arī lineāra asociācija:
Karbonskābju veidi
Atkarībā no ogļūdeņraža radikāļa struktūras karbonskābes iedala:
- aromātisks (benzoskābe)
- alifātiskā (piesātinātā (kaproīnskābe) un nepiesātinātā (akrilskābe))
- alicikliskā (hinskābe)
- heterociklisks (nikotīnskābe).
Pamatojoties uz karboksilgrupu skaitu, karbonskābes iedala:
- monobāze ()
- divbāziska (skābeņskābe)
- daudzbāziska (citronskābe).
Kad skābes molekulā tiek ievadītas citas funkcionālās grupas (–OH, =CO, –NH2 u.c.), veidojas citas savienojumu klases: hidroksi, ketoskābes u.c.
Piesātināto vienbāzisko karbonskābju vispārējā formula:
AR n H2nO2 (n= 1,2,3...) vai Cn H 2n+1 COOH (n = 0,1,2…)
Nepiesātināto vienbāzisko karbonskābju vispārīgā formula:
AR n H 2 n –2 O 2 (n= 1,2,3...) vai CnH 2 n –1 COOH (n = 0,1,2…)
Piesātināto divvērtīgo karbonskābju vispārējā formula:
C n H 2n–2 O 4 (n = 2,3…)
Dažu karbonskābju nosaukumi un formulas
|
Karbonskābes formula |
IUPAC nosaukums |
Triviāls nosaukums |
|---|---|---|
|
Piesātinātās vienbāziskās karbonskābes |
||
|
Nepiesātinātās vienbāziskās karbonskābes |
||
|
Divbāziskās karbonskābes |
||
Problēmu risināšanas piemēri
1. PIEMĒRS
| Vingrinājums | Trīs identiskas mēģenes bez parakstiem satur trīs skābes: skudrskābi, etiķskābi un sālsskābi. Pamatojoties uz to ķīmisko īpašību atšķirībām, kā jūs varat noteikt, kura skābe ir katrā mēģenē? |
| Risinājums | Skudrskābei ir arī dažas īpašības (reducējošas). Tāpēc to var noteikt, piemēram, reaģējot ar vara (II) hidroksīdu, skudrskābes gadījumā veidojas sarkanais vara (I) oksīds: Atlikušās skābes var atšķirt pēc reakcijas ar sudraba nitrātu. Sālsskābes gadījumā izgulsnējas baltas sudraba hlorīda nogulsnes: Sudraba acetāts izšķīst ūdenī, tāpēc mēģenē nekādas izmaiņas nenotiks. Tādējādi atlikušajā mēģenē ir etiķskābe. |
2. PIEMĒRS
| Vingrinājums | Nosaka, vai hidrolīzē paraugam, kas sver 2,64 g, izdalās 1,38 g spirta un 1,8 g monobāziskās karbonskābes. |
| Risinājums | Estera, kas sastāv no spirta un skābes ar dažādu oglekļa atomu skaitu, vispārējā formula ir: Tādējādi alkohola formula ir šāda: un skābes formula ir: Uzrakstīsim estera hidrolīzes vienādojumu: Saskaņā ar vielu masas nezūdamības likumu reakcijas produktu masa ir vienāda ar izejvielu masu. Aprēķināsim masu: M(skābe) + m(spirts) – m(ēteris) g Aprēķināsim ūdens vielas daudzumu: Saskaņā ar reakcijas vienādojumu n(skābe) = n(spirts) mol |
 Ķermeņu kustība gravitācijas ietekmē
Ķermeņu kustība gravitācijas ietekmē Tropi un stilistiskās figūras
Tropi un stilistiskās figūras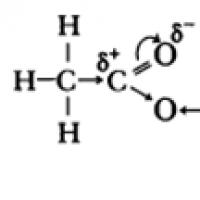 §12. Karbonskābes. Karbonskābes: fizikālās īpašības. Karbonskābju sāļi Vienkāršākā karbonskābe ir skudrskābe
§12. Karbonskābes. Karbonskābes: fizikālās īpašības. Karbonskābju sāļi Vienkāršākā karbonskābe ir skudrskābe Saruna ar bijušo draudzeni
Saruna ar bijušo draudzeni Kāpēc tu sapņo par savu labāko draugu, bijušo draugu vai bērnības draugu?
Kāpēc tu sapņo par savu labāko draugu, bijušo draugu vai bērnības draugu? Grūtnieces sapņu interpretācija sapņo par bērnu
Grūtnieces sapņu interpretācija sapņo par bērnu Kāpēc jūs sapņojat par dzirksteles strāvu? Kāpēc jūs sapņojat par dzirkstelēm? Ko viņi raksta sapņu grāmatās
Kāpēc jūs sapņojat par dzirksteles strāvu? Kāpēc jūs sapņojat par dzirkstelēm? Ko viņi raksta sapņu grāmatās