§12. Karboksirūgštys. Karboksirūgštys: fizinės savybės. Karboksilo rūgščių druskos Paprasčiausia karboksirūgštis yra skruzdžių rūgštis
APIBRĖŽIMAS
Vadinamos organinės medžiagos, kurių molekulėse yra viena ar daugiau karboksilo grupių, sujungtų su angliavandenilio radikalu karboksirūgštys.
Pirmieji trys homologinės karboksirūgšties serijos nariai, įskaitant propiono rūgštį, yra skysčiai, turintys aštrų kvapą ir gerai tirpstantys vandenyje. Šie homologai, pradedant sviesto rūgštimi, taip pat yra skysčiai, kurie turi stiprų nemalonų kvapą, bet blogai tirpsta vandenyje. Aukštesnės rūgštys, kurių anglies atomų skaičius yra 10 ar daugiau, yra kietos, bekvapės, netirpsta vandenyje. Apskritai, homologų serijoje, didėjant molekulinei masei, tirpumas vandenyje mažėja, tankis mažėja ir virimo temperatūra didėja (1 lentelė).
1 lentelė. Homologinės karboksirūgščių serijos.
Karboksilo rūgščių paruošimas
Karboksirūgštys gaunamos oksiduojant sočiuosius angliavandenilius, alkoholius ir aldehidus. Pavyzdžiui, acto rūgštis - kaitinant rūgštinėje aplinkoje oksiduojant etanolį kalio permanganato tirpalu:
Cheminės karboksirūgščių savybės
Chemines karboksirūgščių savybes pirmiausia lemia jų struktūros ypatumai. Taigi vandenyje tirpios rūgštys gali išsiskirti į jonus:
R-COOH↔R-COO - + H + .
Dėl vandenyje esančio H + jono jie turi rūgštų skonį, gali keisti indikatorių spalvą ir pravesti elektros srovę. Vandeniniame tirpale šios rūgštys yra silpni elektrolitai.
Karboksirūgštys turi cheminių savybių, būdingų neorganinių rūgščių tirpalams, t.y. sąveikauja su metalais (1), jų oksidais (2), hidroksidais (3) ir silpnomis druskomis (4):
2CH3-COOh + Zn → (CH3COO) 2Zn + H2 (1);
2CH 3 -COOH + CuO → (CH 3 COO) 2 Cu + H 2 O (2);
R-COOH + KOH → R-COOK + H 2 O (3);
2CH 3 -COOH + NaHCO 3 → CH 3 COONa + H 2 O + CO 2 (4).
Specifinė sočiųjų ir nesočiųjų karboksirūgščių savybė, pasireiškianti funkcine grupe, yra sąveika su alkoholiais.
Kaitinant ir esant koncentruotai sieros rūgštiai, karboksirūgštys reaguoja su alkoholiais. Pavyzdžiui, jei į acto rūgštį įpilama etilo alkoholio ir šiek tiek sieros rūgšties, tada kaitinant atsiranda etilo acto rūgšties (etilo acetato) kvapas:
CH 3 -COOH + C 2 H 5 OH ↔CH 3 -C(O)-O-C 2 H 5 + H 2 O.
Specifinė sočiųjų karboksirūgščių savybė, pasireiškianti radikalu, yra halogeninimo (chlorinimo) reakcija.

Karboksilo rūgščių taikymas
Karboksirūgštys naudojamos kaip žaliava ketonams, rūgščių halogenidams, vinilo esteriams ir kitoms svarbioms organinių junginių klasėms gaminti.
Skruzdžių rūgštis plačiai naudojama esteriams gauti, naudojamiems parfumerijoje, odos pramonėje (odos rauginimas), tekstilės pramonėje (kaip dažymo priemonė), kaip tirpiklis ir konservantas.
Vandeninis acto rūgšties tirpalas (70-80%) vadinamas acto esencija, o 3-9% vandeninis – stalo actu. Esmė dažnai naudojama actui gauti namuose praskiedus.
Problemų sprendimo pavyzdžiai
1 PAVYZDYS
| Pratimas | Kokios cheminės reakcijos gali būti naudojamos atliekant šiuos pokyčius: a) CH 4 → CH 3 Cl → CH 3 OH → HCHO → HCOOH → HCOOK. Parašykite reakcijų lygtis ir nurodykite jų atsiradimo sąlygas. |
| Atsakymas | a) Chloruojant metaną šviesoje, susidaro chlormetanas: CH 4 + Cl 2 → CH 3 Cl + HCl. Alkanų halogeniniai dariniai hidrolizuojami vandeninėje arba šarminėje terpėje ir susidaro alkoholiai: CH 3 Cl + NaOH → CH 3 OH + NaCl. Dėl pirminių alkoholių oksidacijos, pavyzdžiui, kalio dichromatu rūgščioje aplinkoje, esant katalizatoriui (Cu, CuO, Pt, Ag), susidaro aldehidai: CH3OH+ [O] →HCHO. Aldehidai lengvai oksiduojami į atitinkamas karboksirūgštis, pavyzdžiui, su kalio permanganatu: HCHO + [O] → HCOOH. Karboksirūgštys pasižymi visomis silpnosioms mineralinėms rūgštims būdingomis savybėmis, t.y. galintys sąveikauti su aktyviais metalais ir sudaryti druskas: 2HCOOH+ 2K → 2HCOOK + H 2 . |
2 PAVYZDYS
| Pratimas | Parašykite reakcijų lygtis tarp šių medžiagų: a) 2-metilpropano rūgšties ir chloro; b) acto rūgštis ir propanolis-2; c) akrilo rūgštis ir bromo vanduo; d) 2-metilbutano rūgštis ir fosforo (V) chloridas. Nurodykite reakcijos sąlygas. |
| Atsakymas | a) vykstant reakcijai tarp 2-metilpropano rūgšties ir chloro, vandenilio atomas pakeičiamas angliavandenilio radikale, esančiame a padėtyje; Susidaro 2-metil-2-chlorpropano rūgštis H 3 C-C(CH 3)H-COOH + Cl 2 → H 3 C-C(CH 3)Cl-COOH + HCl (kat = P). b) dėl acto rūgšties ir propanolio-2 reakcijos susidaro esteris - acto rūgšties izopropilo esteris. CH3-COOH + CH3-C(OH)H-CH3 → CH3-C(O)-O-C(CH3)-CH3. c) dėl akrilo rūgšties ir bromo vandens sąveikos reakcijos halogeno pridėjimas dvigubos jungties vietoje pagal Markovnikovo taisyklę; Susidaro 2,3-dibrompropano rūgštis CH 2 =CH-COOH + Br 2 → CH 2 Br-CHBr-COOH d) vykstant reakcijai tarp 2-metilbutano rūgšties ir fosforo (V) chlorido susidaro atitinkamas rūgšties chloridas CH3-CH2-C(CH3)H-COOH + PCl5 →CH3-CH2-C(CH3)H-COOCl + POCl3 + HCl. |
Karboksirūgštys- organinės medžiagos, kurių molekulėse yra viena ar daugiau karboksilo grupių.
Karboksilo grupė (sutrumpintai kaip COOH) yra funkcinė karboksilo rūgščių grupė, kurią sudaro karbonilo grupė ir susijusi hidroksilo grupė.
Pagal karboksilo grupių skaičių karboksirūgštys skirstomos į vienbazes, dvibazes ir kt.
Bendra vienbazių karboksirūgšties formulė yra R-COOH. Dvibazinės rūgšties pavyzdys yra oksalo rūgštis HOOC-COOH.
Pagal radikalo tipą karboksirūgštys skirstomos į sočiąsias (pvz., acto rūgštis CH 3 COOH), nesočiąsias [pavyzdžiui, akrilo rūgštis CH 2 =CH-COOH, oleino rūgštis CH 3 - (CH 2) 7 -CH =CH—(CH 2) 7 -COOH] ir aromatinis (pavyzdžiui, benzenkarboksirūgštis C 6 H 5 -COOH).
Izomerai ir homologai
Vienbazinės sočiosios karboksirūgštys R-COOH yra esterių (sutrumpintai R"-COOR") izomerai, turintys tą patį anglies atomų skaičių. Bendra abiejų formulė yra C. n H 2 n O2.
| G | HCOOH metanas (skruzdė) |
||||
| CH3COOH etanas (acto rūgštis) | HCOOCH 3 skruzdžių rūgšties metilo esteris |
||||
| CH3CH2COOH propanas (propioninis) |
HCOOCH 2 CH 3 etilo skruzdžių rūgštis |
CH 3 COOCH 3 acto rūgšties metilo esteris | |||
| CH3(CH2)2COOH butanas (aliejus) |
2-metilpropanas |
HCOOCH 2 CH 2 CH 3 skruzdžių rūgšties propilo esteris |
CH 3 COOCH 2 CH 3 etilo acetatas |
CH 3 CH 2 COOCH 3 propiono rūgšties metilo esteris |
|
| izomerai | |||||
Karboksilo rūgščių pavadinimų sudarymo algoritmas
- Raskite anglies pagrindą – tai ilgiausia anglies atomų grandinė, įskaitant karboksilo grupės anglies atomą.
- Sunumeruokite anglies atomus pagrindinėje grandinėje, pradedant nuo karboksilo anglies atomo.
- Pavadinkite junginį naudodami angliavandenilių algoritmą.
- Pavadinimo pabaigoje pridėkite priesagą „-ov“, galūnę „-aya“ ir žodį „rūgštis“.
Karboksilo rūgščių molekulėse p-hidroksilo grupės deguonies atomų elektronai sąveikauja su karbonilo grupės -ryšio elektronais, dėl to padidėja O-H jungties poliškumas, sustiprėja -ryšis karbonilo grupėje, dalinis krūvis (+) ant anglies atomo mažėja, o dalinis krūvis (+) ant vandenilio atomo didėja .
Pastarasis skatina stiprių vandenilinių ryšių tarp karboksirūgšties molekulių susidarymą.
Sočiųjų vienbazių karboksirūgščių fizinės savybės daugiausia priklauso nuo stiprių vandenilio ryšių tarp molekulių (stipresnių nei tarp alkoholio molekulių). Todėl rūgščių virimo temperatūra ir tirpumas vandenyje yra didesnis nei atitinkamų alkoholių.
Cheminės rūgščių savybės
Karbonilo grupės -ryšio stiprinimas lemia tai, kad karboksirūgštims nebūdingos prisijungimo reakcijos.
- Degimas:
CH 3 COOH + 2O 2 2CO 2 + 2H 2 O
- Rūgštinės savybės.
Dėl didelio O-H jungties poliškumo karboksirūgštys vandeniniame tirpale pastebimai disocijuoja (tiksliau, su juo reaguoja grįžtamai):HCOOH HCOO - + H + (tiksliau HCOOH + H 2 O HCOO - + H 3 O +)
Visos karboksirūgštys yra silpni elektrolitai. Didėjant anglies atomų skaičiui, mažėja rūgščių stiprumas (dėl O-H jungties poliškumo sumažėjimo); priešingai, halogeno atomų įvedimas į angliavandenilio radikalą padidina rūgšties stiprumą. Taip, iš eilėsHCOOH CH 3 COOH C 2 H 5 COOH
rūgščių stiprumas mažėja, o serijojeDidėja.
Karboksirūgštys pasižymi visomis silpnosioms rūgštims būdingomis savybėmis:
Mg + 2CH 3 COOH (CH 3 COO) 2 Mg + H 2
CaO + 2CH 3 COOH (CH 3 COO) 2 Ca + H 2 O
NaOH + CH 3 COOH CH 3 COONa + H 2 O
K 2 CO 3 + 2CH 3 COOH 2CH 3 COOK + H 2 O + CO 2 - Esterifikacija (karboksirūgščių reakcija su alkoholiais, dėl kurios susidaro esteris):
Į esterinimo reakciją taip pat gali patekti polihidroksiliai alkoholiai, tokie kaip glicerolis. Esteriai, kuriuos sudaro glicerolis ir aukštesnės karboksirūgštys (riebalų rūgštys), yra riebalai.Riebalai yra trigliceridų mišiniai. Sočiosios riebalų rūgštys (palmitino C 15 H 31 COOH, stearino C 17 H 35 COOH) sudaro kietus gyvūninės kilmės riebalus, o nesočiosios riebalų rūgštys (oleino C 17 H 33 COOH, linolo C 17 H 31 COOH ir kt.) – skystus riebalus. (aliejai) augalinės kilmės.
- Pakeitimas angliavandenilio radikalu:
Pakeitimas vyksta padėtyje -.Skruzdžių rūgšties HCOOH ypatumas yra tas, kad ši medžiaga yra dvifunkcinis junginys; ji yra ir karboksirūgštis, ir aldehidas:
Todėl skruzdžių rūgštis, be kita ko, reaguoja su sidabro oksido amoniako tirpalu (sidabro veidrodžio reakcija; kokybinė reakcija):HCOOH + Ag 2 O (amoniako tirpalas) CO 2 + H 2 O + 2Ag
Karboksilo rūgščių paruošimas
.
O
//
-C atomų grupė vadinama karboksilo grupe arba karboksilo grupe.
\
OI
Organinės rūgštys, kurių molekulėje yra viena karboksilo grupė, yra vienbazinės. Bendra šių rūgščių formulė yra RCOOH.
Karboksirūgštys, turinčios dvi karboksilo grupes, vadinamos dvibazinėmis. Tai apima, pavyzdžiui, oksalo ir gintaro rūgštis.
Taip pat yra daugiabazių karboksilo rūgščių, turinčių daugiau nei dvi karboksilo grupes. Tai apima, pavyzdžiui, tribazę citrinų rūgštį. Priklausomai nuo angliavandenilio radikalo pobūdžio, karboksirūgštys skirstomos į sočiąsias, nesočiąsias ir aromatines.
Sočiosios arba sočiosios karboksirūgštys yra, pavyzdžiui, propano (propiono) rūgštis arba jau pažįstama gintaro rūgštis.
Akivaizdu, kad sočiųjų karboksirūgščių nėra P-ryšiai angliavandenilio radikaluose.
Nesočiųjų karboksirūgščių molekulėse karboksilo grupė yra susijusi su nesočiuoju, nesočiuoju angliavandenilio radikalu, pavyzdžiui, akrilo (propeno) CH2=CH-COOH arba oleino CH3-(CH2)7-CH=CH-(CH2) molekulėse. 7-COOH ir kitos rūgštys.
Kaip matyti iš benzenkarboksirūgšties formulės, ji yra aromatinė, nes jos molekulėje yra aromatinis (benzeno) žiedas.
Nomenklatūra ir izomerizmas
Mes jau apsvarstėme bendruosius karboksirūgščių, taip pat kitų organinių junginių pavadinimų formavimo principus. Išsamiau panagrinėkime mono- ir dvibazių karboksirūgščių nomenklatūrą. Karboksirūgšties pavadinimas susidaro iš atitinkamo alkano (alkano, kurio molekulėje yra tiek pat anglies atomų) pavadinimo, pridedant priesagą -ov, galūnę -aya ir žodį rūgštis. Anglies atomų numeracija prasideda nuo karboksilo grupės. Pavyzdžiui:
Daugelis rūgščių taip pat turi istoriškai nusistovėjusius arba nereikšmingus pavadinimus (6 lentelė). 
Po pirmos pažinties su įvairialypiu ir įdomiu organinių rūgščių pasauliu, plačiau panagrinėsime sočiąsias vienbazes karboksirūgštis.
Akivaizdu, kad šių rūgščių sudėtis atsispindės bendroje formulėje C n H 2n O2 arba C n H 2n +1 COOH, arba RCOOH.
Sočiųjų vienbazių karboksirūgščių fizinės savybės
Žemesnės rūgštys, t. y. santykinai mažos molekulinės masės rūgštys, kurių vienoje molekulėje yra iki keturių anglies atomų, yra būdingo aštraus kvapo skysčiai (prisiminkime acto rūgšties kvapą). Rūgštys, turinčios nuo 4 iki 9 anglies atomų, yra klampūs aliejiniai skysčiai, turintys nemalonų kvapą; kurių molekulėje yra daugiau nei 9 anglies atomai – kietos medžiagos, kurios netirpsta vandenyje. Sočiųjų vienbazių karboksirūgščių virimo temperatūra didėja didėjant anglies atomų skaičiui molekulėje ir, atitinkamai, didėjant santykinei molekulinei masei. Pavyzdžiui, skruzdžių rūgšties virimo temperatūra yra 101 °C, acto rūgšties – 118 °C, o propiono rūgšties – 141 °C.
Paprasčiausia karboksirūgštis, skruzdžių HCOOH, turinti mažą santykinę molekulinę masę (46), normaliomis sąlygomis yra skystis, kurio virimo temperatūra yra 100,8 °C. Tuo pačiu metu butanas (MR(C4H10) = 58) tomis pačiomis sąlygomis yra dujinis ir jo virimo temperatūra yra -0,5 °C. Šis virimo temperatūros ir santykinės molekulinės masės neatitikimas paaiškinamas karboksirūgšties dimerų susidarymu, kuriuose dvi rūgšties molekulės yra sujungtos dviem vandenilio ryšiais. Vandenilio jungčių atsiradimas tampa aiškus įvertinus karboksirūgšties molekulių struktūrą.
Sočiųjų vienbazių karboksirūgščių molekulėse yra polinė atomų grupė – karboksilas (pagalvokite, kas lemia šios funkcinės grupės poliškumą) ir praktiškai nepolinis angliavandenilio radikalas. Karboksilo grupę traukia vandens molekulės, sudarydamos su jomis vandenilinius ryšius.
Skruzdžių ir acto rūgštys neribotai tirpsta vandenyje. Akivaizdu, kad angliavandenilio radikale didėjant atomų skaičiui, karboksirūgščių tirpumas mažėja.
Žinant karboksirūgšties molekulių sudėtį ir struktūrą, mums nebus sunku suprasti ir paaiškinti šių medžiagų chemines savybes.
Cheminės savybės
Bendrosios savybės, būdingos rūgščių klasei (tiek organinėms, tiek neorganinėms), atsiranda dėl to, kad molekulėse yra hidroksilo grupė, turinti labai polinį ryšį tarp vandenilio ir deguonies atomų. Šios savybės jums gerai žinomos. Panagrinėkime jas dar kartą naudodami vandenyje tirpių organinių rūgščių pavyzdį.
1. Disociacija susidarant vandenilio katijonams ir rūgšties liekanos anijonams. Tiksliau šį procesą apibūdina lygtis, kurioje atsižvelgiama į vandens molekulių dalyvavimą jame.
Karboksilo rūgščių disociacijos pusiausvyra pasislenka į kairę, didžioji jų dalis yra silpni elektrolitai. Nepaisant to, rūgštus, pavyzdžiui, skruzdžių ir acto rūgščių skonis paaiškinamas rūgščių liekanų disociacija į vandenilio katijonus ir anijonus.
Akivaizdu, kad „rūgštaus“ vandenilio buvimas karboksilo rūgščių molekulėse, ty karboksilo grupės vandenilis, lemia ir kitas būdingas savybes.
2. Sąveika su metalais elektrocheminės įtampos diapazone iki vandenilio. Taigi, geležis redukuoja vandenilį iš acto rūgšties:
2CH3-COOH + Fe -> (CHgCOO)2Fe + H2
3. Sąveika su baziniais oksidais, kad susidarytų druska ir vanduo:
2R-COOH + CaO -> (R-COO)2Ca + H20
4. Reakcija su metalų hidroksidais, kad susidarytų druska ir vanduo (neutralizacijos reakcija):
R-COOH + NaOH -> R-COONa + H20 3R-COOH + Ca(OH)2 -> (R-COO)2Ca + 2H20
5. Sąveika su silpnesnių rūgščių druskomis, susidarant pastarosioms. Taigi, acto rūgštis išstumia stearino rūgštį iš natrio stearato ir anglies rūgštį iš kalio karbonato.
6. Karboksilo rūgščių sąveika su alkoholiais susidarant esteriams – tai jums jau žinoma esterinimo reakcija (viena iš svarbiausių karboksirūgštims būdingų reakcijų). Karboksilo rūgščių sąveiką su alkoholiais katalizuoja vandenilio katijonai.
Esterifikavimo reakcija yra grįžtama. Pusiausvyra pasislenka link esterio susidarymo esant vandens šalinimo priemonėms ir esterio pašalinimo iš reakcijos mišinio.
Atvirkštinėje esterinimo reakcijoje, vadinamoje esterio hidrolize (esteriui reaguojant su vandeniu), susidaro rūgštis ir alkoholis. Akivaizdu, kad polihidroksiliai alkoholiai, pavyzdžiui, glicerolis, taip pat gali reaguoti su karboksirūgštimis, t. y. įsijungti į esterinimo reakciją: 
Visų karboksirūgščių (išskyrus skruzdžių rūgštį) molekulėse kartu su karboksilo grupe yra angliavandenilio liekanų. Žinoma, tai negali turėti įtakos rūgščių savybėms, kurias lemia angliavandenilio likučio pobūdis.
7. Sudėjimo reakcijos ties daugybine jungtimi - į jas patenka nesočiosios karboksirūgštys; pavyzdžiui, vandenilio pridėjimo reakcija yra hidrinimas. Hidrinant oleino rūgštį susidaro sočioji stearino rūgštis.
Nesočiosios karboksirūgštys, kaip ir kiti nesotieji junginiai, per dvigubą jungtį prideda halogenų. Pavyzdžiui, akrilo rūgštis pakeičia bromo vandens spalvą.
8. Pakeitimo reakcijos (su halogenais) - į ją gali patekti sočiosios karboksirūgštys; pavyzdžiui, acto rūgštį reaguojant su chloru, galima gauti įvairių chloruotų rūgščių:

Halogeninant karboksirūgštis, kurių angliavandenilio liekanoje yra daugiau nei vienas anglies atomas, gali susidaryti produktai, turintys skirtingą halogeno padėtį molekulėje. Kai reakcija vyksta per laisvųjų radikalų mechanizmą, bet kokie vandenilio atomai angliavandenilio liekanoje gali būti pakeisti. Jei reakcija vykdoma esant nedideliam raudonojo fosforo kiekiui, ji vyksta selektyviai – vandenilis pakeičiamas tik A-padėtis (prie anglies atomo arčiausiai funkcinės grupės) rūgšties molekulėje. Šio selektyvumo priežastis sužinosite studijuodami chemiją aukštojoje mokykloje.
Karboksilo rūgštys, pakeisdamos hidroksilo grupę, sudaro įvairius funkcinius darinius. Kai šie dariniai hidrolizuojami, vėl susidaro karboksirūgštis.
Karboksirūgšties chloridas gali būti gaunamas reaguojant fosforo (III) chloridui arba tionilchloridui (SOCl 2) su rūgštimi. Karboksirūgšties anhidridai gaunami reaguojant chloro anhidridams su karboksirūgšties druskomis. Esteriai susidaro esterifikuojant karboksirūgštis alkoholiais. Esterifikaciją katalizuoja neorganinės rūgštys.
Šią reakciją inicijuoja karboksilo grupės protonavimas – vandenilio katijono (protono) sąveika su viena deguonies atomo elektronų pora. Karboksilo grupės protonavimas padidina teigiamą joje esančio anglies atomo krūvį:

Gavimo būdai
Karboksirūgštys gali būti gaunamos oksiduojant pirminius alkoholius ir aldehidus.
Aromatinės karboksirūgštys susidaro oksiduojantis benzeno homologams.
Hidrolizuojant įvairius karboksirūgšties darinius taip pat susidaro rūgštys. Taigi, esterio hidrolizės metu susidaro alkoholis ir karboksirūgštis. Kaip minėta aukščiau, rūgštimi katalizuojamos esterinimo ir hidrolizės reakcijos yra grįžtamos. Esterio hidrolizė, veikiant vandeniniam šarmo tirpalui, vyksta negrįžtamai; šiuo atveju iš esterio susidaro ne rūgštis, o jos druska. Nitrilų hidrolizės metu pirmiausia susidaro amidai, kurie vėliau paverčiami rūgštimis. Karboksirūgštys susidaro sąveikaujant organiniams magnio junginiams su anglies monoksidu (IV).
Atskiri karboksirūgščių atstovai ir jų reikšmė
Skruzdžių (metano) rūgštis HCOOH yra aštraus kvapo skystis, kurio virimo temperatūra 100,8 °C, gerai tirpus vandenyje. Skruzdžių rūgštis yra nuodinga ir, patekusi ant odos, sukelia nudegimus! Skruzdžių išskiriamame geluonies skystyje yra šios rūgšties. Skruzdžių rūgštis turi dezinfekuojančių savybių, todėl ji naudojama maisto, odos ir farmacijos pramonėje bei medicinoje. Jis taip pat naudojamas audiniams ir popieriui dažyti.
Acto (etano) rūgštis CH3COOH yra bespalvis skystis, turintis būdingą aštrų kvapą, bet kokiu santykiu maišomas su vandeniu. Vandeniniai acto rūgšties tirpalai parduodami acto (3-5% tirpalas) ir acto esencijos (70-80% tirpalas) pavadinimu ir yra plačiai naudojami maisto pramonėje. Acto rūgštis yra geras daugelio organinių medžiagų tirpiklis, todėl naudojama dažymo, rauginimo, dažų ir lako pramonėje. Be to, acto rūgštis yra žaliava daugelio techniškai svarbių organinių junginių gamybai: pavyzdžiui, iš jos gaunamos piktžolėms naikinti naudojamos medžiagos – herbicidai. 
Acto rūgštis yra pagrindinė vyno acto sudedamoji dalis, kuriai būdingas kvapas. Tai yra etanolio oksidacijos produktas ir susidaro iš jo, kai vynas laikomas ore.
Svarbiausi aukštesnių sočiųjų vienabazių rūgščių atstovai yra palmitino C15H31COOH ir stearino C17H35COOH rūgštys. Skirtingai nuo žemesnių rūgščių, šios medžiagos yra kietos ir blogai tirpios vandenyje.
Tačiau jų druskos – stearatas ir palmitatas – puikiai tirpsta ir turi plovimo efektą, todėl jie dar vadinami muilu. Akivaizdu, kad šios medžiagos gaminamos dideliu mastu.
Iš nesočiųjų aukštesniųjų karboksirūgščių didžiausią reikšmę turi oleino rūgštis C17H33COOH arba (CH2)7COOH. Tai į aliejų panašus skystis be skonio ir kvapo. Jo druskos plačiai naudojamos technologijoje.
Paprasčiausias dvibazių karboksirūgščių atstovas yra oksalo (etandio) rūgštis HOOC-COOH, kurios druskos yra daugelyje augalų, pavyzdžiui, rūgštynėse ir rūgštynėse. Oksalo rūgštis yra bespalvė kristalinė medžiaga, gerai tirpstanti vandenyje. Jis naudojamas metalų poliravimui, medienos apdirbimo ir odos pramonėje.
1. Nesočioji elaido rūgštis C17H33COOH yra oleino rūgšties trans-izomeras. Parašykite šios medžiagos struktūrinę formulę.
2. Parašykite oleino rūgšties hidrinimo reakcijos lygtį. Pavadinkite šios reakcijos produktą.
3. Parašykite stearino rūgšties degimo reakcijos lygtį. Kokio tūrio deguonies ir oro (n.a.) reikės norint sudeginti 568 g stearino rūgšties?
4. Kietųjų riebalų rūgščių – palmitino ir stearino – mišinys vadinamas stearinu (būtent iš jo gaminamos stearino žvakutės). Kokio tūrio oro (n.a.) reikės norint sudeginti dviejų šimtų gramų stearino žvakę, jei stearine yra vienodos masės palmitino ir stearino rūgščių? Koks anglies dioksido tūris (n.o.) ir vandens masė susidaro šiuo atveju?
5. Išspręskite ankstesnį uždavinį su sąlyga, kad žvakėje yra vienodas kiekis (tiek pat molių) stearino ir palmitino rūgščių.
6. Norėdami pašalinti rūdžių dėmes, apdorokite jas acto rūgšties tirpalu. Sudarykite šiuo atveju vykstančių reakcijų molekulines ir jonines lygtis, atsižvelgdami į tai, kad rūdyse yra geležies(III) oksido ir hidroksido - Fe2O3 ir Fe(OH)3. Kodėl tokios dėmės nepašalinamos vandeniu? Kodėl jie išnyksta apdorojus rūgšties tirpalu?
7. Kepimo (kepimo) soda NaHC03, dedama į bemielę tešlą, pirmiausia „užgesinama“ acto rūgštimi. Atlikite šią reakciją namuose ir parašykite jos lygtį, žinodami, kad anglies rūgštis yra silpnesnė už acto rūgštį. Paaiškinkite putų susidarymą.
8. Žinodami, kad chloras yra labiau elektronegatyvus nei anglis, išdėliokite šias rūgštis: acto, propiono, chloracto, dichloracto ir trichloracto rūgštis pagal didėjančias rūgštines savybes. Pagrįskite savo rezultatą.
9. Kaip galime paaiškinti, kad skruzdžių rūgštis reaguoja „sidabrinio veidrodžio“ reakcijoje? Parašykite šios reakcijos lygtį. Kokios dujos gali išsiskirti tokiu atveju?
10. Kai 3 g sočios monobazinės karboksirūgšties reaguoja su magnio pertekliumi, išsiskyrė 560 ml (n.s.) vandenilio. Nustatykite rūgšties formulę.
11. Pateikite reakcijų lygtis, kuriomis galima apibūdinti acto rūgšties chemines savybes. Pavadinkite šių reakcijų produktus.
12. Pasiūlykite paprastą laboratorinį metodą, pagal kurį galėtumėte atpažinti propano ir akrilo rūgštis.
13. Parašykite metilformiato – metanolio ir skruzdžių rūgšties esterio – susidarymo reakcijos lygtį. Kokiomis sąlygomis ši reakcija turėtų būti atlikta?
14. Sudarykite C3H602 sudėties medžiagų struktūrines formules. Į kokias medžiagų klases jas galima priskirti? Pateikite kiekvienai iš jų būdingas reakcijų lygtis.
15. Medžiaga A – acto rūgšties izomeras – netirpi vandenyje, bet gali būti hidrolizuojama. Kokia yra medžiagos A struktūrinė formulė? Pavadinkite jo hidrolizės produktus.
16. Sudarykite šių medžiagų struktūrines formules:
a) metilo acetatas;
b) oksalo rūgštis;
c) skruzdžių rūgšties;
d) dichloracto rūgšties;
e) magnio acetatas;
f) etilo acetatas;
g) etilo formiatas;
h) akrilo rūgštis.
17*. 3,7 g sveriančios sočiosios vienbazinės organinės rūgšties mėginys buvo neutralizuotas vandeniniu natrio bikarbonato tirpalu. Išsiskyrusias dujas leidžiant per kalkių vandenį, gauta 5,0 g nuosėdų. Kokia rūgštis buvo paimta ir koks dujų kiekis išsiskyrė?
Karboksirūgštys gamtoje
Karboksirūgštys yra labai paplitusios gamtoje. Jų yra vaisiuose ir augaluose. Jų yra adatose, prakaite, šlapime ir dilgėlių sultyse. Žinote, pasirodo, kad didžioji dalis rūgščių sudaro esterius, kurie turi kvapą. Taigi pieno rūgšties kvapas, esantis žmogaus prakaite, vilioja uodus, kuriuos jie jaučia gana dideliu atstumu. Todėl, kad ir kiek stengtumėtės nuvyti įkyrų uodą, jis vis tiek gerai jaučiasi savo auka. Be žmogaus prakaito, pieno rūgšties yra raugintuose agurkuose ir raugintuose kopūstuose.
O beždžionių patelės, norėdamos pritraukti patiną, išskiria acto ir propiono rūgštį. Jautri šuns nosis gali užuosti sviesto rūgšties kvapą, kurios koncentracija yra 10–18 g/cm3.
Daugelis augalų rūšių gali gaminti acto ir sviesto rūgštį. O kai kurios piktžolės tuo pasinaudoja ir, išskirdamos medžiagas, pašalina savo konkurentus, slopindamos jų augimą, o kartais ir sukeldamos jų mirtį.
Indėnai taip pat naudojo rūgštį. Norėdami sunaikinti priešą, jie pamerkė strėles mirtinu nuodu, kuris pasirodė esąs acto rūgšties darinys.
Ir čia iškyla natūralus klausimas: ar rūgštys kelia pavojų žmogaus sveikatai? Mat gamtoje plačiai paplitusi oksalo rūgštis, esanti rūgštynėse, apelsinuose, serbentuose ir avietėse, maisto pramonėje kažkodėl nerado pritaikymo. Pasirodo, oksalo rūgštis yra du šimtus kartų stipresnė už acto rūgštį ir gali net ėsdinti indus, o jos druskos, besikaupdamos žmogaus organizme, formuoja akmenis.
Rūgštys plačiai naudojamos visose žmogaus gyvenimo srityse. Jie naudojami medicinoje, kosmetologijoje, maisto pramonėje, žemės ūkyje ir buities reikmėms.
Medicininiais tikslais naudojamos organinės rūgštys, tokios kaip pieno, vyno ir askorbo rūgštys. Tikriausiai kiekvienas iš jūsų naudojo vitaminą C, kad sustiprintų organizmą – tai būtent askorbo rūgštis. Tai ne tik padeda stiprinti imuninę sistemą, bet ir turi savybę pašalinti iš organizmo kancerogenus ir toksinus. Pieno rūgštis naudojama kauterizacijai, nes ji yra labai higroskopiška. Tačiau vyno rūgštis veikia kaip švelnus vidurius laisvinantis vaistas, kaip priešnuodis apsinuodijus šarmais ir kaip komponentas, būtinas ruošiant plazmą kraujo perpylimui.
Tačiau kosmetinių procedūrų gerbėjai turėtų žinoti, kad citrusiniuose vaisiuose esančios vaisių rūgštys teigiamai veikia odą, nes, prasiskverbdamos giliai, gali pagreitinti odos atsinaujinimo procesą. Be to, citrusinių vaisių kvapas tonizuoja nervų sistemą.
Ar pastebėjote, kad uogos, tokios kaip spanguolės ir bruknės, laikomos ilgai ir išlieka šviežios. Ar žinai kodėl? Pasirodo, juose yra benzenkarboksirūgšties, kuri yra puikus konservantas.
Tačiau žemės ūkyje gintaro rūgštis buvo plačiai naudojama, nes ji gali būti naudojama auginamų augalų produktyvumui padidinti. Tai taip pat gali paskatinti augalų augimą ir paspartinti jų vystymąsi.
1.Karboksirūgštys – tai deguonies turinčios organinės medžiagos, kurių molekulėse yra viena ar kelios karboksilo grupės
(-C OOH ), prijungtas prie anglies radikalo arba vandenilio atomo.
Karboksilo grupėje yra dvi funkcinės grupės - karbonilo >C=O ir hidroksilo -OH, tiesiogiai sujungtos viena su kita:
2. Klasifikacija
A) Pagal karboksilo grupių skaičių molekulėje
|
vardas |
Pavyzdžiai |
|
1) Vienbazis |
Metanas naujas , skruzdžių rūgštis Etanas naujas , acto rūgštis |
|
2) dvibazis |
HOOC-COOH Oksalo rūgštis |
|
3) Daugiabazinis |
B) Pagal angliavandenilio radikalo prigimtį
|
vardas |
Pavyzdžiai |
|
1) Riba (prisotintas) |
HCOOH Metanas naujas , skruzdžių rūgštis CH3COOH Etanas naujas , acto rūgštis |
|
2) Neribotas |
Akrilo rūgštis CH 2 = CHCOOH Krotoninė rūgštis CH 3 –CH=CH–COOH Oleino CH 3 – (CH 2) 7 –CH=CH– (CH 2) 7 –COOH Linolo CH 3 – (CH 2) 4 – (CH=CH–CH 2) 2 – (CH 2) 6 –COOH Linoleno CH 3 –CH 2 – (CH=CH–CH 2) 3 – (CH 2) 6 –COOH |
|
3) Aromatinis |
C 6 H 5 COOH – benzenkarboksirūgštis NOOS–C 6 H 4 –COOH Pora- tereftalio rūgštis |
3. Izomerizmas ir nomenklatūra
aš . Struktūrinis
A) Anglies skeleto izomerija (pradedant nuo C 4 )
B) Interclass su esteriais R – CO – O – R 1 (pradedant nuo C 2)
Pavyzdžiui: C 3 H 6 O 2
CH 3 -CH 2 -COOH propiono rūgštis
SU H 3 -CO -OCH 3 acto rūgšties metilo esteris
II . Erdvinė
A) Optinis
Pavyzdžiui:
B) Nesočiųjų rūgščių cis-trans izomerija
Pavyzdys:
4. Karboksirūgščių nomenklatūra
Sisteminiai rūgščių pavadinimai pateikiami atitinkamo angliavandenilio pavadinimu, pridedant priesagą - naujas ir žodžiai rūgšties.
Norint nurodyti pakaito (arba radikalo) padėtį, anglies grandinės numeracija prasideda nuo karboksilo grupės anglies atomo. Pavyzdžiui, junginys su šakotąja anglies grandine (CH 3) 2 CH-CH 2 -COOH vadinamas 3-metilbutano rūgštis. Nereikšmingi pavadinimai taip pat plačiai naudojami organinėms rūgštims, kurios paprastai atspindi natūralų šaltinį, kuriame junginiai buvo pirmą kartą aptikti.
Kai kurios monobazinės rūgštys
|
Formulė |
Rūgšties pavadinimas R-COOH |
Likučio pavadinimas RCOO - |
|
|
sistemingas |
trivialus |
||
|
HCOOH |
metanas |
ant |
formato |
|
CH3COOH |
etanas |
acto |
acetatas |
|
C2H5COOH |
propanas |
propiono |
propionatas |
|
C3H7COOH |
butanas |
Alyva |
butiratas |
|
C4H9COOH |
pentanas |
valerijonas |
valeratas |
|
C5H11COOH |
heksanas |
nailono |
kapratas |
|
C15H31COOH |
heksadekanas |
palmitinė |
palmitatas |
|
C17H35COOH |
oktadekanas |
stearino |
stearatas |
|
C6H5COOH |
benzeno anglies |
benzoinas |
benzoatas |
|
CH2 =CH-COOH |
propeno |
akrilo |
akrilatas |
Priesagos naudojamos daugiabazinėms rūgštims -diovaya, -triovaya ir tt
Pavyzdžiui:
HOOC-COOH- etandio (oksalo) rūgštis;
HOOC-CH 2 -COOH - propandio (malono) rūgštis.
RIBOTI MONOBAZINIŲ KARBOKSIRŪGŠČIŲ DĖL
CnH 2 n +1 - COOHarbaCnH 2 nO 2
Homologinė serija
|
vardas |
Formulė rūgštys |
t pl. |
t kip. |
ρ |
|
|
rūgštys |
|||||
|
ant |
metanas |
HCOOH |
100,5 |
1,22 |
|
|
acto |
etanas |
CH3COOH |
16,8 |
1,05 |
|
|
propiono |
propanas |
CH3CH2COOH |
0,99 |
||
|
Alyva |
butanas |
CH3(CH2)2COOH |
0,96 |
||
Karboksilo grupės struktūra
Karboksilo grupė jungia dvi funkcines grupes - karbonilą >C = O ir hidroksilo -OH, kurios viena kitą veikia:
Rūgštinės karboksirūgščių savybės atsiranda dėl elektronų tankio poslinkio į karbonilo deguonį ir dėl to atsirandančios papildomos (lyginant su alkoholiais) O-H jungties poliarizacija.
Vandeniniame tirpale karboksirūgštys disocijuoja į jonus:
Tirpumas vandenyje ir aukšta rūgščių virimo temperatūra atsiranda dėl tarpmolekulinių vandenilio jungčių susidarymo.
Didėjant molekulinei masei, rūgščių tirpumas vandenyje mažėja.
Sočiųjų vienbazių rūgščių fizinės savybės
Apatiniai šios serijos elementai normaliomis sąlygomis yra būdingo aštraus kvapo skysčiai. Pavyzdžiui, etano (acto) rūgštis turi būdingą "acto" kvapą. Bevandenė acto rūgštis yra skystis kambario temperatūroje; 17 °C temperatūroje jis užšąla, virsdamas ledine medžiaga, vadinama „ledine“ acto rūgštimi. Viduriniai šios homologinės serijos atstovai yra klampūs, „riebūs“ skysčiai; pradedant nuo C 10 – kietosios medžiagos.
Paprasčiausia aromatinė rūgštis – benzenkarboksirūgštis C 6 H 5 COOH (mp 122,4 °C) – lengvai sublimuojasi, t.y. virsta dujine būsena, apeinant skystąją būseną. Atvėsus jo garai sublimuojasi į kristalus. Ši savybė naudojama medžiagai išvalyti nuo priemaišų.
APIBRĖŽIMAS
Karboksirūgštys– organiniai junginiai, kurių molekulėse yra viena ar daugiau funkcinių karboksilo grupių – COOH, susietų su angliavandenilio radikalu.
Karboksilo grupė susideda iš karbonilo grupės > C= O ir susijusi hidroksilo grupė –OH.
Bendra karboksirūgščių formulė yra R-COOH.
Karboksilo rūgščių rūgštinės savybės atsiranda dėl elektronų tankio poslinkio į karbonilo deguonį, dėl kurio atsiranda dalinis teigiamas atomo krūvis.
Dėl to padidėja O-H jungties poliškumas ir tampa įmanomas disociacijos procesas:
Gautas anijonas stabilizuojamas dėl krūvio delokalizacijos:

Žemesnės karboksirūgštys, turinčios iki 3 anglies atomų, yra bespalviai skysčiai, turintys būdingą aštrų kvapą, bet kokiu santykiu maišomi su vandeniu. Dauguma rūgščių, turinčių 4–9 atomus, yra riebūs skysčiai, turintys nemalonų kvapą. Rūgštys, turinčios daugiau nei 10 vandenilio atomų, yra vandenyje netirpios kietos medžiagos.
Karboksilo rūgščių tirpumas vandenyje ir aukšta virimo temperatūra yra susiję su tarpmolekulinių vandenilio jungčių susidarymu. Kietoje būsenoje karboksirūgštys daugiausia egzistuoja ciklinių dimerų pavidalu, o skystoje būsenoje taip pat atsiranda linijinis ryšys:
Karboksilo rūgščių rūšys
Atsižvelgiant į angliavandenilio radikalo struktūrą, karboksirūgštys skirstomos į:
- aromatinė (benzenkarboksirūgštis)
- alifatinė (sočioji (kaprono rūgštis) ir nesočioji (akrilo rūgštis))
- aliciklinė (chino rūgštis)
- heterociklinė (nikotino rūgštis).
Pagal karboksilo grupių skaičių karboksirūgštys skirstomos į:
- monobase ()
- dvibazis (oksalo rūgštis)
- daugiabazis (citrinų rūgštis).
Į rūgšties molekulę įvedant kitas funkcines grupes (–OH, =CO, –NH2 ir kt.), susidaro kitų klasių junginiai: hidroksi, keto rūgštys ir kt.
Bendra sočiųjų vienbazių karboksirūgščių formulė:
SU n H2nO2 (n= 1,2,3...) arba Cn H 2n+1 COOH (n = 0,1,2…)
Bendroji nesočiųjų vienbazių karboksirūgščių formulė:
SU n H 2 n –2 O 2 (n= 1,2,3...) arba CnH 2 n –1 COOH (n = 0,1,2…)
Bendra sočiųjų dvibazių karboksirūgščių formulė:
C n H 2n–2 O 4 (n = 2,3…)
Kai kurių karboksirūgščių pavadinimai ir formulės
|
Karboksirūgšties formulė |
IUPAC pavadinimas |
Trivialus vardas |
|---|---|---|
|
Sočiosios monobazinės karboksirūgštys |
||
|
Nesočiosios monobazinės karboksirūgštys |
||
|
Dvibazinės karboksirūgštys |
||
Problemų sprendimo pavyzdžiai
1 PAVYZDYS
| Pratimas | Trijuose vienoduose mėgintuvėliuose be parašų yra trys rūgštys: skruzdžių, acto ir druskos. Kaip, remiantis jų cheminių savybių skirtumais, galite nustatyti, kurios rūgšties yra kiekviename mėgintuvėlyje? |
| Sprendimas | Skruzdžių rūgštis taip pat turi tam tikrų savybių (redukuojančių). Todėl jį galima nustatyti, pavyzdžiui, reaguojant su vario (II) hidroksidu, skruzdžių rūgšties atveju susidaro raudonasis vario (I) oksidas: Likusias rūgštis galima atskirti reaguojant su sidabro nitratu. Vandenilio chlorido rūgšties atveju nusėda baltos sidabro chlorido nuosėdos: Sidabro acetatas ištirpsta vandenyje, todėl mėgintuvėlyje jokių pokyčių nebus. Taigi likusiame mėgintuvėlyje yra acto rūgšties. |
2 PAVYZDYS
| Pratimas | Nustatoma, ar hidrolizuojant 2,64 g sveriantį mėginį išsiskiria 1,38 g alkoholio ir 1,8 g monobazinės karboksirūgšties. |
| Sprendimas | Bendroji esterio, sudaryto iš alkoholio ir rūgšties, turinčios skirtingą anglies atomų skaičių, formulė yra tokia: Taigi alkoholio formulė yra tokia: ir rūgšties formulė yra tokia: Parašykime esterio hidrolizės lygtį: Pagal medžiagų masės tvermės dėsnį reakcijos produktų masė yra lygi pradinių medžiagų masei. Apskaičiuokime masę: M(rūgštis) + m(alkoholis) – m(eteris) g Apskaičiuokime vandens medžiagos kiekį: Pagal reakcijos lygtį n(rūgštis) = n(alkoholis) mol |
 Kūnų judėjimas veikiant gravitacijai
Kūnų judėjimas veikiant gravitacijai Tropai ir stilistinės figūros
Tropai ir stilistinės figūros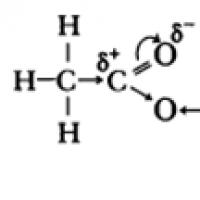 §12. Karboksirūgštys. Karboksirūgštys: fizinės savybės. Karboksilo rūgščių druskos Paprasčiausia karboksirūgštis yra skruzdžių rūgštis
§12. Karboksirūgštys. Karboksirūgštys: fizinės savybės. Karboksilo rūgščių druskos Paprasčiausia karboksirūgštis yra skruzdžių rūgštis Pokalbis su buvusia mergina
Pokalbis su buvusia mergina Kodėl svajojate apie savo geriausią draugą, buvusį draugą ar vaikystės draugą?
Kodėl svajojate apie savo geriausią draugą, buvusį draugą ar vaikystės draugą? Nėščios moters svajonių interpretacija svajoja apie vaiką
Nėščios moters svajonių interpretacija svajoja apie vaiką Kodėl svajojate apie kibirkšties srovę? Kodėl svajojate apie kibirkštis? Ką jie rašo svajonių knygose
Kodėl svajojate apie kibirkšties srovę? Kodėl svajojate apie kibirkštis? Ką jie rašo svajonių knygose