Milliseid tulemusi on geenitehnoloogia saavutanud? Geenitehnoloogia. Geenitehnoloogia tähtsus
1. Geenitehnoloogia võimalused. 4
2. Geenitehnoloogia ajalugu. 6
3. Geenitehnoloogia kui teadus. Geenitehnoloogia meetodid. 10
4. Geenitehnoloogia rakendusalad. 12
5. Teaduslikud faktid geenitehnoloogia ohtudest. 18
Järeldus. 22
Viited.. 23
Sissejuhatus
Geenitehnoloogia teema on viimasel ajal muutunud üha populaarsemaks. Enim pööratakse tähelepanu negatiivsetele tagajärgedele, mida selle teadusharu areng võib kaasa tuua, ning väga vähe käsitletakse kasu, mida geenitehnoloogia võib tuua.
Kõige lootustandvam rakendusvaldkond on ravimite tootmine geenitehnoloogia tehnoloogiate abil. Viimasel ajal on saanud võimalikuks saada kasulikke vaktsiine, mis põhinevad transgeensetel taimedel. Vähem huvi ei paku ka toiduainete tootmine samu tehnoloogiaid kasutades.
Geenitehnoloogia on tulevikuteadus. Hetkel külvatakse üle maailma miljoneid hektareid maad transgeensete taimedega, luuakse ainulaadseid ravipreparaate ja uusi kasulike ainete tootjaid. Aja jooksul võimaldab geenitehnoloogia saavutada uusi edusamme meditsiinis, põllumajanduses, toiduainetööstuses ja loomakasvatuses.
Käesoleva töö eesmärgiks on uurida geenitehnoloogia võimalikkuse, arengulugu ja rakendusvaldkondi.
1. Geenitehnoloogia võimalused
Biotehnoloogia oluline osa on geenitehnoloogia. 70ndate alguses sündinud ta on tänaseks saavutanud suure edu. Geenitehnoloogia meetodid muudavad bakteri-, pärmi- ja imetajarakud "vabrikuteks", mis võimaldavad suuremahuliselt toota mis tahes valku. See võimaldab üksikasjalikult analüüsida valkude ehitust ja funktsioone ning kasutada neid ravimitena. Praegu on Escherichia coli (E. coli) saanud selliste oluliste hormoonide tarnijaks nagu insuliin ja somatotropiin. Varem saadi insuliini loomade kõhunäärme rakkudest, mistõttu oli selle maksumus väga kõrge. 100 g kristallilise insuliini saamiseks on vaja 800–1000 kg kõhunääret ja lehma üks nääre kaalub 200–250 grammi. See muutis insuliini kalliks ja paljudele diabeetikutele raskesti kättesaadavaks. 1978. aastal tootsid Genentechi teadlased esmakordselt insuliini spetsiaalselt loodud Escherichia coli tüvest. Insuliin koosneb kahest polüpeptiidahelast A ja B, pikkusega 20 ja 30 aminohapet. Kui need on ühendatud disulfiidsidemetega, moodustub loomulik kaheahelaline insuliin. On näidatud, et see ei sisalda E. coli valke, endotoksiine ega muid lisandeid, ei tekita kõrvaltoimeid nagu loomne insuliin ja sellel puudub bioloogiline aktiivsus.
on erinev. Seejärel sünteesiti proinsuliin E. coli rakkudes, mille DNA koopia sünteesiti RNA matriitsil, kasutades pöördtranskriptaasi. Pärast saadud proinsuliini puhastamist jagati see natiivseks insuliiniks, samal ajal kui hormooni ekstraheerimise ja eraldamise etapid viidi miinimumini. 1000 liitrist kultiveerimisvedelikust võib saada kuni 200 grammi hormooni, mis võrdub sea või lehma 1600 kg kõhunäärme eritunud insuliini kogusega.
Somatotropiin on inimese kasvuhormoon, mida eritab hüpofüüs. Selle hormooni puudus põhjustab hüpofüüsi kääbust. Kui somatotropiini manustada kolm korda nädalas annustes 10 mg kehakaalu kg kohta, siis aastaga võib selle vaeguse all kannatav laps kasvada 6 cm.Varem saadi seda surnukehast, ühelt laibalt: 4 - 6 mg somatotropiini lõpptoote osas. Seega olid hormooni saadaolevad kogused piiratud, lisaks oli selle meetodiga saadud hormoon heterogeenne ja võis sisaldada aeglaselt kasvavaid viirusi. 1980. aastal töötas firma Genentec välja bakterite abil somatotropiini tootmise tehnoloogia, millel puudusid need puudused. 1982. aastal saadi inimese kasvuhormooni E. coli ja loomarakkude kultuuris Prantsusmaal Pasteuri Instituudis ning 1984. aastal alustati NSV Liidus insuliini tööstuslikku tootmist. Interferooni tootmisel kasutatakse nii E. coli, S. cerevisae (pärm) kui ka fibroblastide või transformeeritud leukotsüütide kultuuri. Sarnaseid meetodeid kasutades saadakse ka ohutuid ja odavaid vaktsiine.
Rekombinantne DNA tehnoloogia põhineb väga spetsiifiliste DNA-sondide tootmisel, mille abil uuritakse geenide ekspressiooni kudedes, geenide lokaliseerumist kromosoomidel ning tuvastatakse seotud funktsioonidega geene (näiteks inimestel ja kanadel). DNA-sonde kasutatakse ka erinevate haiguste diagnoosimisel.
Rekombinantne DNA tehnoloogia on teinud võimalikuks ebatavalise valgu-geeni lähenemisviisi, mida nimetatakse pöördgeneetikaks. Selle lähenemisviisi korral eraldatakse valk rakust, selle valgu geen kloonitakse ja seda muudetakse, luues valgu muudetud vormi kodeeriva mutantse geeni. Saadud geen viiakse rakku. Kui see ekspresseerub, sünteesivad seda kandev rakk ja selle järglased muutunud valgu. Nii saab vigaseid geene parandada ja pärilikke haigusi ravida.
Kui hübriid-DNA viiakse viljastatud munarakku, saab toota transgeenseid organisme, mis ekspresseerivad mutantset geeni ja annavad selle edasi oma järglastele. Loomade geneetiline transformatsioon võimaldab kindlaks teha üksikute geenide ja nende valguproduktide rolli nii teiste geenide aktiivsuse reguleerimisel kui ka erinevates patoloogilistes protsessides. Geenitehnoloogia abil on loodud viirushaigustele resistentsete loomade liinid, aga ka inimesele kasulike omadustega loomatõud. Näiteks veise somatotropiini geeni sisaldava rekombinantse DNA mikrosüstimine küüliku sügooti võimaldas saada selle hormooni hüperproduktsiooniga transgeense looma. Saadud loomadel oli väljendunud akromegaalia.
Geenide materiaalse baasi kandjad on kromosoomid, mis hõlmavad DNA-d ja valke. Kuid moodustumise geenid pole keemilised, vaid funktsionaalsed. Funktsionaalsest vaatenurgast koosneb DNA paljudest plokkidest, mis salvestavad teatud hulga informatsiooni – geenid. Geeni toime põhineb selle võimel määrata RNA kaudu valgusünteesi. DNA molekul sisaldab justkui teavet, mis määrab valgu molekulide keemilise struktuuri. Geen on DNA molekuli osa, mis sisaldab teavet ühe valgu primaarstruktuuri kohta (üks geen – üks valk). Kuna organismides on kümneid tuhandeid valke, on kümneid tuhandeid geene. Kõik raku geenid moodustavad selle genoomi. Kõik keharakud sisaldavad sama geenikomplekti, kuid igaüks neist rakendab erinevat osa salvestatud teabest. Seetõttu erinevad näiteks närvirakud maksarakkudest nii struktuursete, funktsionaalsete kui ka bioloogiliste omaduste poolest.
Nüüd on isegi raske ennustada kõiki võimalusi, mis lähikümnenditel realiseeruvad.
2. Geenitehnoloogia ajalugu
Kõrgete biomeditsiiniliste tehnoloogiate, geeniuuringute meetodite, aga ka geenitehnoloogia enda ajalugu on otseselt seotud inimese igavese sooviga parandada inimeste poolt kasvatatavaid koduloomade ja kultuurtaimi. Loomade ja taimede rühmade hulgast teatud isendeid valides ja neid omavahel ristates lõi inimene, omamata õiget ettekujutust elusolendite sees toimuvate protsesside sisemisest olemusest, siiski paljude sadade ja tuhandete aastate jooksul paranenud. loomatõud ja taimesordid, millel olid inimesele teatud kasulikud ja vajalikud omadused.
18. ja 19. sajandil tehti palju katseid välja selgitada, kuidas iseloomuomadused põlvest põlve edasi kanduvad. Ühe olulise avastuse tegi 1760. aastal botaanik Koelreuther, kes ristas kahte tüüpi tubakat, kandes õietolmu ühe liigi tolmukast teise liigi pesasse. Hübriidseemnetest saadud taimede omadused olid mõlema vanema omade vahepealsed. Koelreuter tegi sellest loogilise järelduse, et vanemlikud omadused kanduvad edasi nii õietolmu (seemnerakud) kui ka munarakkude (munarakkude) kaudu. Pärilikkuse edasikandumise mehhanismi olemust ei suutnud aga tema ega tema kaasaegsed, kes tegelesid taimede ja loomade hübridiseerimisega, paljastada. See on osaliselt seletatav asjaoluga, et tol ajal ei olnud veel teada selle mehhanismi tsütoloogilist alust, kuid peamiselt sellega, et teadlased püüdsid üheaegselt uurida kõigi taimeomaduste pärilikkust.
Teadusliku lähenemise teatud tunnuste ja omaduste pärilikkuse uurimisel töötas välja Austria katoliku munk Gregor Mendel, kes 1865. aasta suvel alustas oma kloostri territooriumil taimede hübridiseerimise (eri sortide herneste ristamise) katseid. Ta oli esimene, kes avastas geneetika põhiseadused. Gregor Mendel saavutas edu, kuna ta uuris individuaalsete, selgelt eristuvate (kontrastsete) tunnuste pärandumist, loendas iga tüübi järglaste arvu ja pidas hoolikalt üksikasjalikku arvestust kõigi oma ristamiskatsete kohta. Matemaatika põhitõdede tundmine võimaldas tal saadud andmeid õigesti tõlgendada ja eeldada, et iga tunnuse määravad kaks pärilikku tegurit. Andekas munk-uurija suutis hiljem selgelt näidata, et pärilikud omadused ei segune, vaid kanduvad järglastele edasi teatud ühikute kujul. See hiilgav järeldus leidis hiljem täielikult kinnitust, kui oli võimalik näha kromosoome ja teada saada erinevat tüüpi rakkude jagunemise tunnuseid: mitoos (somaatilised rakud - keharakud), meioos (seksuaalne, reproduktiivne, idu) ja viljastumine.
Mendel teatas oma töö tulemustest Brunni Loodusuurijate Seltsi koosolekul ja avaldas need selle seltsi toimetistes. Tema tulemuste olulisust tema kaasaegsed ei mõistnud ning need uuringud ei pälvinud taimekasvatajate ja loodusteadlaste tähelepanu ligi 35 aasta jooksul.
Aastal 1900, pärast seda, kui rakkude jagunemise üksikasjad mitoosi, meioosi ja viljastamise tüübi järgi said teatavaks, viisid kolm teadlast – de Vries Hollandis, Correns Saksamaal ja Chermak Austrias – läbi rea katseid ja üksteisest sõltumatult taasavastasid. Mendeli poolt varem kirjeldatud pärilikkuse seadused. Hiljem, olles avastanud Mendeli artikli, milles need seadused olid selgelt sõnastatud 35 aastat varem, avaldasid need teadlased mungateadlasele üksmeelselt austust, nimetades kaks pärilikkuse põhiseadust tema järgi.
20. sajandi esimesel kümnendil tehti katseid väga erinevate taimede ja loomadega ning tehti arvukalt tähelepanekuid iseloomude pärilikkuse kohta inimestel, mis näitasid selgelt, et kõigis neis organismides allub pärilikkus samadele põhiseadustele. Leiti, et Mendeli kirjeldatud tegurid, mis määravad individuaalse tunnuse, asuvad raku tuuma kromosoomides. Seejärel, aastal 1909, nimetas Taani botaanik Johansen neid üksusi geenideks (kreeka sõnast "ge-nos" - perekond, päritolu) ja Ameerika teadlane William Sutton märkas üllatavat sarnasust kromosoomide käitumise vahel kromosoomide moodustumise ajal. sugurakud (sugurakud), nende viljastumine ja Mendeli pärilike tegurite – geenide ülekandmine. Nende geniaalsete avastuste põhjal loodi nn kromosomaalne pärilikkuse teooria.
Tõepoolest, geneetika ise kui teadus elusorganismide pärilikkusest ja muutlikkusest ning nende ohjeldamise meetoditest tekkis 20. sajandi alguses. Ameerika geneetik T. Morgan viis koos oma kaastöölistega läbi arvukalt katseid, mis võimaldasid paljastada soo määramise geneetilised alused ja selgitada mitmeid ebatavalisi pärilikkuse vorme, mille puhul tunnuse edasikandumine sõltub indiviidi soost. (nn sooga seotud tunnused). Järgmine suurem samm edasi tehti 1927. aastal, kui G. Möller tuvastas, et Drosophila äädikakärbse ja teisi organisme röntgenikiirgusega kiiritades on võimalik neis kunstlikult esile kutsuda geenimuutusi ehk mutatsioone. See võimaldas saada palju uusi mutantseid geene – lisamaterjali pärilikkuse uurimiseks. Andmed mutatsioonide olemuse kohta olid üheks võtmeks geenide endi mõistmisel ja struktuuril.
Meie sajandi 20. aastatel leidsid A.S. koolkonna nõukogude teadlased. Serebrovski viis läbi esimesed katsed, mis näitasid, kui keeruline see geen on. Neid ideid kasutasid J. Watson ja F. Crick, kes suutsid 1953. aastal Inglismaal luua DNA mudeli ja dešifreerida geneetilist koodi. Hilisem uurimistöö, mis oli seotud uute geneetilise materjali kombinatsioonide sihipärase loomisega, viis geenitehnoloogia enda tekkeni.
Samal ajal, 40ndatel, algas geenide ja ensüümide vaheliste seoste eksperimentaalne uurimine. Selleks kasutati laialdaselt teist objekti - hallitusseent Neurospora, millest oli võimalik kunstlikult saada ja uurida mitmeid biokeemilisi mutatsioone, mis olid seotud ühe või teise erilise ensüümi (valgu) kadumisega. Viimase kahe aastakümne jooksul on geeniuuringute kõige levinumad sihtmärgid olnud Escherichia coli ja teatud bakteriofaagid, mis seda bakterit nakatavad.
Alates 20. sajandi algusest on jätkunud huvi teatud (spetsiifiliste) tunnuste pärilikkuse uurimise vastu inimestel ning soovitavate ja ebasoovitavate tunnuste päriliku ülekandumise vastu koduloomadel ja kultuurtaimedel. Tuginedes üha suurenevatele teadmistele geneetiliste mustrite kohta, on geneetikud ja aretajad õppinud peaaegu tellimustööna aretama loomatõugusid, kes suudavad ellu jääda kuumas kliimas, lehmi, kes toodavad palju kõrge rasvasisaldusega piima, ja kanu, kes munevad suuri mune. õhukese kestaga ning maisi- ja nisusordid, mis on teatud haiguste suhtes väga vastupidavad.
1972. aastal saadi USA-s P. Bergi laboris esimene hübriidne (rekombinantne) DNA. Põnevaid ideid inimgeneetika ja geeniuuringute meetodite vallas on hakatud laialdaselt arendama ja rakendama ka meditsiinis endas. 70ndatel algas inimese genoomi dekodeerimine. Rohkem kui aastakümneid on olnud projekt nimega Inimgenoom. 3 miljardist katkematuteks lõikudeks paigutatud nukleotiidipaarist on seni loetud vaid umbes 10 miljonit tähemärki. Samal ajal luuakse uusi geneetilisi tehnikaid, mis suurendavad DNA lugemise kiirust. Venemaa Meditsiiniteaduste Akadeemia meditsiinigeneetika keskuse direktor V.I. Ivanov usub kindlasti, et "kogu genoom loetakse 2020. aasta paiku."
3. Geenitehnoloogia kui teadus. Geenitehnoloogia meetodid
Geenitehnoloogia on funktsionaalselt aktiivsete geneetiliste struktuuride (rekombinantne DNA) in vitro konstrueerimine ehk teisisõnu kunstlike geneetiliste programmide loomine (Baev A.A.). Vastavalt E.S. Piruzyani geenitehnoloogia on eksperimentaaltehnikate süsteem, mis võimaldab konstrueerida laboris (in vitro) tehislikke geneetilisi struktuure nn rekombinantsete või hübriidsete DNA molekulide kujul.
Me räägime molekulaarsete geneetiliste süsteemide suunatud ülesehitamisest väljaspool keha ja nende järgnevast elusorganismi viimisest. Sel juhul muutub rekombinantne DNA retsipientorganismi geneetilise aparaadi lahutamatuks osaks ja annab sellele uued ainulaadsed geneetilised, biokeemilised ja seejärel füsioloogilised omadused.
Rakendusliku geenitehnoloogia eesmärk on kujundada sellised rekombinantsed DNA molekulid, mis geeniaparatuuri sisestatuna annaksid kehale inimesele kasulikud omadused.
Rekombinantne DNA tehnoloogia kasutab järgmisi meetodeid:
DNA spetsiifiline lõhustamine restriktsiooninukleaaside abil, kiirendades üksikute geenide eraldamist ja manipuleerimist;
Kõigi nukleotiidide kiire järjestamine puhastatud DNA fragmendis, mis võimaldab määrata geeni ja selle poolt kodeeritud aminohappejärjestuse piire;
Rekombinantse DNA konstrueerimine;
Nukleiinhapete hübridisatsioon, mis võimaldab tuvastada spetsiifilisi RNA või DNA järjestusi suurema täpsuse ja tundlikkusega, lähtudes nende võimest siduda komplementaarseid nukleiinhappejärjestusi;
DNA kloonimine: in vitro amplifikatsioon polümeraasi ahelreaktsiooni abil või DNA fragmendi sisestamine bakterirakku, mis pärast sellist transformatsiooni reprodutseerib seda fragmenti miljonites koopiates;
Rekombinantse DNA sisestamine rakkudesse või organismidesse.
4. Geenitehnoloogia rakendusalad
Praegused teaduslikud avastused inimgeneetika vallas on tegelikult revolutsioonilise tähtsusega, kuna me räägime võimalusest luua "inimgenoomi kaart" või "inimese genoomi patoloogiline anatoomia". See geneetiline kaart võimaldab kindlaks teha teatud pärilike haiguste eest vastutavate geenide asukoha pikal DNA spiraalil. Geeniteadlaste sõnul panid need piiramatud võimalused aluse ideele kasutada kliinilises praktikas nn geeniteraapiat, mis on patsientide ravi suund, mis hõlmab kahjustatud geenide asendamist kõrgete biomeditsiiniliste tehnoloogiate ja geenitehnoloogia abil. Invasioon inimese geenisüsteemide koostisesse ja nende elulise aktiivsuse tagamine on võimalik nii keha somaatiliste (kõik teatud struktuursete ja funktsionaalsete erinevustega keharakud) kui ka reproduktiiv-, reproduktiiv- (idu) ja idu tasandil. (embrüonaalsed) rakud.
Geenitehnoloogia kui teraapialiik – konkreetse geneetiliselt määratud haiguse ravi – on seotud vastava mittedefektse DNA molekuli tarnimisega eesmärgiga asendada see geeni – kromosoomi lõigu, mis sisaldab defektiks või integreerimiseks inimese geneetilisse materjaliga, ühinedes inimese keha nn somaatiliste rakkudega, millel on geneetiline defekt. Geenitehnoloogia ülesanne seoses inimesega on pakkuda konkreetsele geenile asjakohast sihipärast mõju, et korrigeerida seda õige funktsioneerimise suunas ja anda pärilikku haigust põdevale inimesele geeni normaalne, muutumatu versioon. Erinevalt medikamentoossest ravist suudab see ravi, mida nimetatakse geenitehnoloogiaks, ilmselt pakkuda patsiendile pikaajalist, pikaajalist ja väga tõhusat ravi, mis toob suurt leevendust ja kasu.
Kõik tänapäevased DNA elusorganismidesse viimise meetodid ei ole aga võimelised suunama ja toimetama seda kindlasse rakupopulatsiooni, mis sisaldab muutunud ja seetõttu talitlushäireid. Teisisõnu, nn suunatud ülekanne, geenide transportimine kehas (“in vivo” mudelis) on praegu võimatu.
Teine metodoloogiline lähenemine, mis põhineb patsiendi kehast teatud kahjustatud geeni sisaldava rakupopulatsiooni ekstraheerimisel ja geneetilise materjaliga manipuleerimisel, asendades rakkudes defektsed geenid geenitehnoloogia abil ("in vitro" mudelis) ja tagastades need sinna. koht kehas, kus nad patsiendilt võeti, on praegu võimalik meditsiinilistes geenikeskustes. Seda geenitehnoloogia abil geeniteraapia meetodit on juba kasutatud eksperimentaalsel katsel ravida kahte patsienti, kes põevad haruldast geneetilist haigust, mida nimetatakse beeta-talasseemiaks, mis, nagu sirprakuline aneemia, on samuti põhjustatud väärarengu olemasolust ja seetõttu valesti funktsioneerivast. valk punastes verelibledes. Manipulatsiooni olemus seisnes selles, et nende patsientide luuüdist eraldati nn tüvirakud, mille kromosoomidesse viidi normaalse hemoglobuliini valgu tootmise eest vastutav DNA osa - geen. Pärast seda, kui patsientide luuüdis allesjäänud talitlushäired tüvirakud peaaegu täielikult hävisid, süstiti patsientidele geneetiliselt muundatud tüvirakke. Kahjuks olid need kaks katset kliiniliselt ebaõnnestunud, kuna patsiendid surid. See esimene geenitehnoloogia juhtum haiglakeskkonnas ei olnud asjaomaste läbivaatamiskomisjonide poolt lubatud ega heaks kiidetud ning selle osalejad mõisteti karmilt hukka inimgeneetika valdkonna uurimisreeglite jämeda rikkumise eest.
Reproduktiivrakkude geenitehnoloogia võib viia täiesti erinevate tagajärgedeni, kuna DNA sisestamine nendesse rakkudesse erineb somaatiliste (kehaliste, mittereproduktiivsete) rakkude geneetilise defekti parandamisest. On teada, et teiste geenide viimine sugurakkude kromosoomidesse viib nende edasikandumiseni järgmistesse põlvkondadesse. Põhimõtteliselt võib ette kujutada teatud DNA lõikude lisamist, et asendada defektsed lõigud teatud inimese, keda tabab üks või teine geneetiliselt määratud haigus, iga paljuneva raku geneetilisele materjalile.
Tõepoolest, see on saavutatud hiirtel. Nii saadi emaslooma munasarjast munarakk, mis seejärel viljastati in vitro (in vitro) ja seejärel viidi viljastatud munaraku kromosoomi võõras DNA osa. Viljastatud munarakk ise muudetud genoomiga implanteeriti (sisestati) emase hiire emakasse. Ühes katses oli võõr-DNA allikaks küüliku ja teises inimese geneetiline materjal.
Teatud geneetiliste kõrvalekalletega, näiteks Downi sündroomi või Tay-Sachsi tõvega lapse saamise tõenäosuse tuvastamiseks loote arengu perioodil kasutatakse uurimismeetodit, mida nimetatakse amniotsenteesiks – sünnieelset analüüsi, mille käigus võetakse bioloogilise vedeliku proov. mis sisaldavad sugurakke, mis on võetud amnionikotist raseduse teise trimestri alguses. Lisaks arendati edasi tehnikat erinevate looterakkude eraldamiseks ema platsentavere proovist. Sel viisil saadud emakarakke saab praegu kasutada vaid piiratud hulga geneetiliselt määratud haiguste tuvastamiseks, mille puhul esineb väljendunud, jämedaid DNA struktuuri häireid ja biokeemiliste testidega määratud muutusi. Rekombinantset DNA-d kasutav geenitehnoloogia sünnieelsete uuringute käigus avab võimaluse erinevate ja arvukate pärilike haiguste õigeks diagnoosimiseks.
Sel juhul töötatakse välja tehnikaid nn geenisondide loomiseks, mille abil saab kindlaks teha, kas kromosoom sisaldab normaalset muutumatut geeni või ebanormaalset defektset geeni. Lisaks võimaldab rekombinantse DNA kasutamisega kaasnev geenitehnoloogia, mis on selle moodustumise ühes etapis, tulevikus teostada inimese geenide nn "planeerimist", nii et teatud geen mis kannab moonutatud patoloogilist teavet ja pakub seetõttu huvi geneetikutele, saab õigeaegselt ja piisavalt kiiresti tuvastada analoogselt teise "märgistatud" geeni kasutamise meetodiga. See keerukas meditsiiniline ja bioloogiline tehnika peaks aitama määrata mis tahes geeni asukohta emakarakkudes, mitte ainult nendes, kus amniotsenteesi tehnikat kasutades tuvastatakse tõenäoliselt mitmesuguseid häireid.
Sellega seoses on viimastel aastatel esile kerkinud uued biomeditsiiniteaduste osad, nagu näiteks kõrge DNA tehnoloogiad, embrüoteraapia ja rakuteraapia (tsütoteraapia), st geneetiliselt määratud haiguse emakasisene diagnoosimine ja ravi. haridusfaasis ja embrüo (embrüo) arengus ning loote küpsemise staadiumis. Embrüonaalse materjali sissetung ja sellega manipuleerimine mõjutab otseselt geneetiliste muutuste pärandumist, kuna neid saab edasi anda põlvest põlve. Veelgi enam, geneetiline diagnostika ise hakkab arenema geneetiliseks prognoosimiseks, see tähendab inimese edasise saatuse kindlaksmääramiseks, kinnistades peamised revolutsioonilised muutused meditsiinis endas, mis keeruliste meditsiinilis-geneetiliste katsete ja tehnikate tulemusena said võimaluse. ammu enne "haiguse kliinilise pildi" ilmnemist, mõnikord isegi enne inimese sündi, et teha kindlaks, millised pärilikud vaevused teda ähvardavad. Nii sündis tänu geneetikute ja geenitehnoloogia valdkonna spetsialistide pingutustele biomeditsiiniteaduste sügavustes nn ennustav meditsiin, see tähendab meditsiin, mis "teeb tulevikuennustusi".
Samal ajal võimaldavad erinevad geenitehnoloogia tehnoloogiad ja meetodid ennustada lapse sünnieelsel arenguperioodil enne tema sündi mitte ainult teatud päriliku haiguse esinemist, vaid ka üksikasjalikult kirjeldada meditsiinilist ja geneetilist. kasvava embrüo ja loote omadused.
Uute andmete kogunemisega inimese genoomi geneetilise kaardistamise ja selle DNA kirjeldamise (sekveneerimise) kohta ning ka seetõttu, et väljatöötamisel olevad kaasaegsed DNA polümorfismide uurimismeetodid võimaldavad teha kättesaadavaks geneetilise teabe teatud struktuursete ja funktsionaalsete ( sealhulgas patoloogilised) inimkeha tunnused, mis ilmselt ilmnevad tulevikus, kuid pole praegu veel märgatavad, on meditsiinilise geneetilise diagnostika abil võimalik saada kogu geneetiline teave lapse kohta mitte ainult prekliiniliselt, see tähendab enne teatud päriliku haiguse ilmnemist ja sünnieelselt, see tähendab enne tema sündi, aga ka ettenägelikult, see tähendab isegi enne selle eostamist.
Nähtavas tulevikus on tänu edule ja edusammudele meditsiinilise geenidiagnostika vallas võimalik DNA-diagnostika andmete põhjal üsna enesekindlalt hinnata näiteks seda, milline on inimese pikkus, vaimsed võimed, eelsoodumus teatud haigustele. (eriti vähk) on. või vaimne), on määratud mis tahes pärilike haiguste avaldumisele ja arengule.
Kaasaegsed meditsiinilised ja bioloogilised tehnoloogiad võimaldavad tuvastada geenides mitmesuguseid häireid, mis võivad avalduda ja põhjustada teatud vaevusi mitte ainult kliiniliselt väljendunud haiguse staadiumis, vaid ka siis, kui patoloogia tunnuseid veel ei ole ja haigus ise ei avaldu. avaldub nii ruttu. Selle näiteks on Alzheimeri tõbi ja Huntingtoni korea, mis mõjutavad üle 40-aastaseid või isegi 70-aastaseid inimesi. Kuid isegi sellistel juhtudel on võimalik tuvastada geene, mis võivad inimestel sarnaseid haigusi põhjustada, juba enne patsiendi rasestumist. Samuti on teada, et suhkurtõbi võib liigitada nende haiguste hulka. Selle haiguse eelsoodumus ja geneetiliselt määratud patoloogia ise on pärilikud ja võivad avalduda teatud elustiili mittejärgimisel täiskasvanueas või vanemas eas. Võime üsna kindlalt väita, et kui mõlemad vanemad või üks neist põeb diabeeti, kandub tõenäosus “diabeedi” geeni või selliste geenide kombinatsiooni pärimiseks ka lastele.
Sel juhul osutub võimalikuks läbi viia asjakohased meditsiinilised ja bioloogilised uuringud ning panna õige diagnoos mikroskoopiliselt väikese koguse bioloogilise materjali juuresolekul. Mõnikord piisab selleks mõnest üksikust rakust, mida kultuuris in vitro paljundatakse ja nendest saadakse testitava inimese “geneetiline portree”, muidugi mitte kõigi tema genoomi geenide kohta (neid on kümneid). tuhandetest neist!), kuid nende puhul, mille puhul on alust kahtlustada teatud defektide esinemist. Raku- ja geenitehnoloogia meetodite samaaegne arendamine võimaldab genoomi tundmise järgmistel etappidel avada praktilise võimaluse meelevaldselt ja ennekõike terapeutilistel eesmärkidel muuta geenide järjestust ja järjestust, nende koostis ja struktuur.
Meditsiin ei ole geenitehnoloogia ainus rakendusvaldkond. On taimede geenitehnoloogia ja bakterioloogiliste rakkude geenitehnoloogia.
Hiljuti on ilmnenud uued võimalused transgeensetel taimedel põhinevate "söödavate" vaktsiinide hankimisel.
Transgeensete taimede vallas on maailmas tehtud suuri edusamme. Need on suuresti tingitud sellest, et taimedes rakust, rakurühmast või ebaküpsest embrüost organismi kättesaamise probleem ei ole praegu kuigi keeruline. Kaasaegses teaduses kasutatakse laialdaselt rakutehnoloogiaid, koekultuuri ja regenerantide loomist.
Vaatleme saavutusi taimekasvatuse vallas, mis saadi Venemaa Teaduste Akadeemia Siberi filiaali Siberi Taimefüsioloogia ja Biokeemia Instituudis.
Nii on viimastel aastatel saadud mitmeid transgeenseid taimi, kandes nende genoomi erinevatest taimsetest objektidest eraldatud geene ugt, acp, acb, accc ja teisi.
Nende geenide sissetoomise tulemusena ilmusid nisu, kartuli, tomati, kurgi, sojaoa, herneste, rapsi, maasikate, haava ja mõnede teiste transgeensed taimed.
Geenide sisestamine viidi läbi kas kudede "sihtimise teel" "geenipüstolist" (mille disain töötati välja meie instituudis) või geneetilise vektori abil, mis põhines agrobakteriaalsel plasmiidil, millel olid sisseehitatud sihtgeenid ja vastavad promootorid. .
Selle tulemusena moodustus hulk uusi transgeenseid vorme. Siin on mõned neist.
Transgeenne nisu (2 sorti), millel on oluliselt intensiivsem kasv ja võsa, on eeldatavalt vastupidavam põuale ja muudele ebasoodsatele keskkonnateguritele. Uuritakse selle tootlikkust ja omandatud omaduste pärandumist.
Transgeensed kartulid, mida on jälgitud kolm aastat. See annab pidevalt 50–90 protsenti suuremat saaki kui kontroll, on omandanud peaaegu täieliku resistentsuse auksiini herbitsiidide suhtes ja lisaks “mustuvad” tema mugulad jaotustükkide ajal polüfenooloksüdaasi aktiivsuse vähenemise tõttu oluliselt vähem.
Transgeenne tomat (mitu sorti), mida iseloomustab suurem põõsasus ja saagikus. Kasvuhoones on selle saagikus kuni 46 kg ruutmeetrilt (üle kahe korra suurem kui kontroll).
Transgeenne kurk (mitu sorti) annab suurema hulga viljakaid õisi ja järelikult ka vilju saagisega kuni 21 kg ruutmeetrilt võrreldes 13,7-ga kontrollis.
On ka teiste taimede transgeenseid vorme, millest paljudel on ka mitmeid kasulikke majanduslikke tunnuseid.
Geenitehnoloogia on tänase ja homse teadus. Juba praegu külvatakse üle maailma kümneid miljoneid hektareid transgeensete taimedega, luuakse uusi ravimeid ja uusi kasulike ainete tootjaid. Aja jooksul muutub geenitehnoloogia üha võimsamaks vahendiks uute edusammude jaoks meditsiinis, veterinaarmeditsiinis, farmakoloogias, toiduainetööstuses ja põllumajanduses.
5. Teaduslikud faktid geenitehnoloogia ohtudest
Tuleb märkida, et koos geenitehnoloogia arenguga kaasnevate edusammudega on ka mõned faktid geenitehnoloogia ohtude kohta, millest peamised on välja toodud allpool.
1. Geenitehnoloogia erineb põhimõtteliselt uute sortide ja tõugude väljatöötamisest. Võõrgeenide kunstlik lisamine häirib oluliselt normaalse raku peenreguleeritud geneetilist kontrolli. Geenimanipulatsioon erineb põhimõtteliselt ema ja isa kromosoomide kombinatsioonist, mis toimub looduslike ristumise korral.
2. Praegu on geenitehnoloogia tehniliselt ebatäiuslik, kuna see ei suuda kontrollida uue geeni sisestamise protsessi. Seetõttu on sisestamiskohta ja lisatud geeni mõju võimatu ennustada. Isegi kui geeni asukohta saab määrata pärast selle genoomi sisestamist, on saadaolev DNA teave tulemuste ennustamiseks väga puudulik.
3. Võõrgeeni kunstliku lisamise tulemusena võib ootamatult tekkida ohtlikke aineid. Halvimal juhul võivad need olla mürgised ained, allergeenid või muud tervisele kahjulikud ained. Teave seda tüüpi võimaluste kohta on endiselt väga puudulik.
4. Puuduvad täiesti usaldusväärsed meetodid kahjutuse kontrollimiseks. Hoolimata hoolikalt läbiviidud ohutusuuringutest ei ole võimalik avastada enam kui 10% uute ravimite tõsistest kõrvaltoimetest. Risk, et uute geneetiliselt muundatud toitude ohtlikud omadused jäävad avastamata, on tõenäoliselt palju suurem kui ravimite puhul.
5. Kehtivad nõuded kahjutuse kontrollimiseks on äärmiselt ebapiisavad. Need on selgelt kavandatud heakskiitmisprotsessi lihtsustamiseks. Need võimaldavad kasutada äärmiselt tundlikke kahjutuse testimise meetodeid. Seetõttu on märkimisväärne oht, et ohtlikud toiduained läbivad kontrolli märkamatult.
6. Seni geenitehnoloogia abil loodud toiduainetel ei ole inimkonna jaoks olulist väärtust. Need tooted rahuldavad peamiselt ainult kaubanduslikke huve.
7. Teadmised keskkonda viidud geneetiliselt muundatud organismide mõjust on täiesti ebapiisavad. Veel ei ole tõestatud, et geenitehnoloogia abil muudetud organismidel poleks kahjulikku mõju keskkonnale. Keskkonnakaitsjad on soovitanud mitmesuguseid võimalikke keskkonnaprobleeme. Näiteks on palju võimalusi geenitehnoloogias kasutatavate potentsiaalselt kahjulike geenide kontrollimatuks levikuks, sealhulgas geeniülekandeks bakterite ja viiruste poolt. Keskkonnast põhjustatud tüsistusi on tõenäoliselt võimatu parandada, kuna vabanenud geene ei saa tagasi võtta.
8. Võib tekkida uusi ja ohtlikke viirusi. Eksperimentaalselt on näidatud, et genoomi põimitud viirusgeenid võivad ühineda nakkuslike viiruste geenidega (nn rekombinatsioon). Need uued viirused võivad olla agressiivsemad kui algsed. Viirused võivad muutuda ka vähem liigispetsiifiliseks. Näiteks võivad taimeviirused muutuda kahjulikuks kasulikele putukatele, loomadele ja ka inimestele.
9. Teadmised päriliku aine DNA kohta on väga puudulikud. Teada on vaid kolme protsendi DNA funktsioon. On riskantne manipuleerida keeruliste süsteemidega, mille kohta teadmised on puudulikud. Laialdased kogemused bioloogia, ökoloogia ja meditsiini vallas näitavad, et see võib põhjustada tõsiseid ettearvamatuid probleeme ja häireid.
10. Geenitehnoloogia ei aita lahendada maailma näljaprobleemi. Väide, et geenitehnoloogia võib oluliselt kaasa aidata maailma näljaprobleemi lahendamisele, on teaduslikult põhjendamatu müüt.
Järeldus
Geenitehnoloogia on biotehnoloogia meetod, mis tegeleb genotüüpide ümberstruktureerimise uurimisega. Genotüüp ei ole lihtsalt mehaaniline geenide summa, vaid kompleksne süsteem, mis on välja kujunenud organismide evolutsiooni käigus. Geenitehnoloogia võimaldab geneetilist informatsiooni ühelt organismilt teisele üle kanda in vitro operatsioonide kaudu. Geeniülekanne võimaldab ületada liikidevahelisi barjääre ja kanda üle ühe organismi individuaalsed pärilikud omadused teisele.
Genotüüpide ümberkorraldamine geenitehnoloogia ülesannete täitmisel kujutab endast kvalitatiivseid muutusi geenides, mis ei ole seotud mikroskoobis nähtavate kromosoomide struktuuri muutustega. Geenimuutused on eelkõige seotud DNA keemilise struktuuri muutumisega. Teave valgu struktuuri kohta, mis on kirjutatud nukleotiidide järjestusena, realiseeritakse sünteesitud valgu molekulis aminohapete järjestusega. Kromosomaalse DNA nukleotiidide järjestuse muutumine, osade kadumine ja teiste nukleotiidide kaasamine muudab DNA-l moodustunud RNA molekulide koostist ja see omakorda määrab sünteesi käigus uue aminohapete järjestuse. Selle tulemusena hakkab rakus sünteesima uut valku, mis toob kaasa uute omaduste ilmnemise kehas. Geenitehnoloogia meetodite olemus seisneb selles, et üksikud geenid või geenirühmad sisestatakse organismi genotüüpi või jäetakse sellest välja. Varem puudunud geeni genotüüpi sisestamise tulemusena võib rakk olla sunnitud sünteesima valke, mida ta varem ei olnud sünteesinud.
Bibliograafia
2. Lee A., Tinland B. T-DNA integreerimine taimegenoomi: prototüüp ja tegelikkus // Taimefüsioloogia. 2000. - 47. köide. - nr 3.
3. Lutova L. A., Provorov N. A., Tikhodeev O. N. jt. Taimede arengu geneetika. - Peterburi: Nauka, 2000. - 539 lk.
4. Ljadskaja M. Geenitehnoloogia suudab kõike – isegi aias vaktsiini kasvatada // Farmaatsiabülletään. - 2000. - nr 7.
5. Romanov G. A. Taimede geenitehnoloogia ja bioohutuse probleemi lahendamise viisid // Taimefüsioloogia, 2000. - 47. köide - nr 3.
6. Saljajev R. Geenitehnoloogia müüdid ja tegelikkus // Teadus Siberis. - 2002. - nr 7.
7. Favorova O. O. Ravi geenidega – väljamõeldis või reaalsus? // Farmaatsiabülletään. - 2002. - nr 5.
Kuzmina N.A. Biotehnoloogia alused: õpik. - Omsk: OGPU, 2001. - 256 lk.
Lutova L. A., Provorov N. A., Tikhodeev O. N. jt. Taimede arengu geneetika. - Peterburi: Nauka, 2000. - 539 lk.
Ljadskaja M. Geenitehnoloogia suudab kõike – isegi aias vaktsiini kasvatada // Farmaatsiabülletään. - 2000. - nr 7.
Kuzmina N.A. Biotehnoloogia alused: õpik. - Omsk: OGPU, 2001. - 256 lk.
Favorova O. O. Ravi geenidega – väljamõeldis või reaalsus? // Farmaatsiabülletään. - 2002. - nr 5.
Saljajev R. Geenitehnoloogia müüdid ja tegelikkus // Teadus Siberis. - 2002. - nr 7.
Kuzmina N.A. Biotehnoloogia alused: õpik. - Omsk: OGPU, 2001. - 256 lk.
JA BIOTEHNOLOOGIA
“Teadmised määrab
mida me väidame
nagu tõde"
P. A. FLORENSKY.
Kaasaegne bioloogia erineb radikaalselt traditsioonilisest bioloogiast mitte ainult kognitiivsete ideede suurema arengu sügavuse poolest, vaid ka oma tihedama seotuse poolest ühiskonnaelu ja praktikaga. Võib öelda, et meie ajal on bioloogiast saanud vahend elusmaailma ümberkujundamiseks, et rahuldada ühiskonna materiaalseid vajadusi. Seda järeldust illustreerib eelkõige tihe seos bioloogia ja biotehnoloogia vahel, millest on saanud kõige olulisem materjalitootmise valdkond, võrdväärne partner varem inimese loodud mehaanilistele ja keemilistele tehnoloogiatele. Mis seletab biotehnoloogia tõusu?
Alates nende loomisest on bioloogia ja biotehnoloogia alati koos arenenud, kusjuures bioloogia on algusest peale olnud biotehnoloogia teaduslik alus. Oma andmete puudumine ei võimaldanud aga pikka aega bioloogial biotehnoloogiale väga suurt mõju avaldada. Olukord muutus dramaatiliselt koos loomisega 20. sajandi teisel poolel. geenitehnoloogia metoodika, mille all mõistetakse geenimanipulatsiooni eesmärgiga "konstrueerida uusi ja rekonstrueerida olemasolevaid genotüüpe. Olles oma olemuselt metodoloogiline saavutus, ei toonud geenitehnoloogia kaasa seniste arusaamade katkemist bioloogiliste nähtuste kohta, ei mõjutanud bioloogia alusprintsiibid, nii nagu raadioastronoomia ei kõigutanud astrofüüsika aluspõhimõtteid, ei toonud "soojuse mehaanilise ekvivalendi" kehtestamine kaasa soojusjuhtivuse seaduste muutust ning aine aatomiteooria tõestust. ei muutnud termodünaamika, hüdrodünaamika ja elastsusteooria vahelisi seoseid.
Geenitehnoloogia on avanud bioloogias uue ajastu põhjusel, et on tekkinud uued võimalused tungida bioloogiliste nähtuste sügavustesse elusaine eksisteerimisvormide edasiseks iseloomustamiseks, et tõhusamalt uurida geenide ehitust ja talitlust. molekulaarsel tasandil ja mõista geneetilise aparaadi toimimise peeneid mehhanisme. Geenitehnoloogia edu tähendab revolutsiooni kaasaegses loodusteaduses. Need määravad kriteeriumid tänapäevaste ideede väärtustamiseks elusaine molekulaarse ja rakulise taseme struktuursete ja funktsionaalsete omaduste kohta. Kaasaegsetel andmetel elusolendite kohta on tohutu hariduslik tähtsus, sest need annavad arusaamise orgaanilise maailma ühest olulisemast aspektist ja annavad seeläbi hindamatu panuse teadusliku maailmapildi loomisesse. Seega, laiendades dramaatiliselt oma kognitiivset baasi, oli bioloogial geenitehnoloogia kaudu ka juhtiv mõju biotehnoloogia tõusule.
Geenitehnoloogia loob aluse uute organismide “konstrueerimise” või olemasolevate organismide täiustamise viiside ja vahendite mõistmisele, andes neile suurema majandusliku väärtuse ja suurema võimaluse järsult tõsta biotehnoloogiliste protsesside tootlikkust.
Geenitehnoloogia raames eristatakse geenitehnoloogiat ja rakutehnoloogiat. Geenitehnoloogia viitab manipulatsioonidele rekombinantsete DNA molekulide loomiseks. Seda metoodikat nimetatakse sageli molekulaarseks kloonimiseks, geenide kloonimiseks, rekombinantse DNA tehnoloogiaks või lihtsalt geneetiliseks manipuleerimiseks. Oluline on rõhutada, et geenitehnoloogia objektideks on DNA molekulid ja üksikud geenid. Seevastu rakutehnoloogia viitab isoleeritud üksikute rakkude või taimede ja loomade rakurühmade geneetilisele manipuleerimisele.
XIX peatükk
GEENITEHNOLOOGIA
Geenitehnoloogia on erinevate eksperimentaalsete tehnikate (tehnikate) kogum, mis tagab DNA molekulide (geenide) kavandamise (rekonstrueerimise) ja kloonimise etteantud eesmärkidel.
Geenitehnoloogia meetodeid kasutatakse kindlas järjestuses (joonis 221) ja tüüpilise geeni kloonimiseks mõeldud geenitehnoloogia eksperimendi läbiviimisel eristatakse mitut etappi, nimelt:
1. DNA eraldamine huvipakkuva organismi rakkudest (esialgne) ja DNA vektori eraldamine.
2. Algorganismi DNA lõikamine (restriktsioon) huvipakkuvaid geene sisaldavateks fragmentideks, kasutades ühte restriktsiooniensüümidest ja nende geenide eraldamine saadud restriktsioonisegust. Samal ajal lõigatakse (piiratakse) vektor-DNA, muutes selle ringikujulisest struktuurist lineaarseks.

3. Huvipakkuva DNA segmendi (geeni) ühendamine vektor-DNA-ga, et saada hübriid-DNA molekule.
4. Hübriidsete DNA molekulide sisestamine transformatsiooni teel mõnda teise organismi, näiteks E. colisse või somaatilistesse rakkudesse.
5. Bakterite külvamine, millesse viidi hübriid-DNA molekulid toitesöötmele, mis võimaldab kasvada ainult hübriid-DNA molekule sisaldavatel rakkudel.
6. Hübriid-DNA molekule sisaldavatest bakteritest koosnevate kolooniate tuvastamine.
7. Kloonitud DNA eraldamine (kloonitud geenid) ja selle iseloomustamine, sh lämmastiku aluste sekveneerimine kloonitud DNA fragmendis.
DNA (allikas ja vektor), ensüümid, rakud, milles DNA kloonitakse – kõiki neid nimetatakse geenitehnoloogia "tööriistadeks".
DNA ekstraheerimine
Vaatleme näiteks DNA eraldamise meetodit, kasutades DNA plasmiide. Plasmiidi sisaldavatest bakterirakkudest eraldatakse DNA traditsioonilise tehnikaga, mis seisneb rakuekstraktide saamises detergentide juuresolekul ja järgnevas valkude eemaldamises ekstraktidest fenooliga ekstraheerimisega (joonis 222). Plasmiidse DNA täielik puhastamine valkudest, RNA-st ja muudest ühenditest viiakse läbi mitmes etapis. Pärast rakkude hävitamist, näiteks lüsosüümiga (nende seinad on lahustunud), lisatakse ekstraktile pesuainet, mis lahustab membraane ja inaktiveerib mõningaid valke. Enamik kromosomaalset DNA-d eemaldatakse saadud preparaatidest tavapärase tsentrifuugimisega.

 Täielikuks puhastamiseks kasutatakse sageli kromatograafiat. Kui on vaja väga põhjalikku puhastamist, kasutatakse kiiret CsCI tihedusgradienttsentrifuugimist, kasutades etiidiumbromiidi. Ülejäänud kromosomaalne DNA fragmenteeritakse lineaarseks DNA-ks, samas kui plasmiidne DNA jääb kovalentselt suletuks. Kuna etiidiumbromiid on vähem tihe kui DNA, siis tsentrifuugitorus ultratsentrifuugimisel "keerab" lahti kaks rõngast - plasmiidne DNA ja kromosomaalne DNA (joonis 223). Plasmiidne DNA valitakse edasiseks tööks, kromosomaalne DNA visatakse ära.
Täielikuks puhastamiseks kasutatakse sageli kromatograafiat. Kui on vaja väga põhjalikku puhastamist, kasutatakse kiiret CsCI tihedusgradienttsentrifuugimist, kasutades etiidiumbromiidi. Ülejäänud kromosomaalne DNA fragmenteeritakse lineaarseks DNA-ks, samas kui plasmiidne DNA jääb kovalentselt suletuks. Kuna etiidiumbromiid on vähem tihe kui DNA, siis tsentrifuugitorus ultratsentrifuugimisel "keerab" lahti kaks rõngast - plasmiidne DNA ja kromosomaalne DNA (joonis 223). Plasmiidne DNA valitakse edasiseks tööks, kromosomaalne DNA visatakse ära.
Majanduslik tähtsus
Geenitehnoloogia eesmärk on saavutada muutuva või geneetiliselt muundatud organismi soovitud omadused. Erinevalt traditsioonilisest selektsioonist, mille käigus genotüüp muutub ainult kaudselt, võimaldab geenitehnoloogia molekulaarse kloonimise tehnika abil otsest sekkumist geeniaparatuuri. Geenitehnoloogia rakendamise näideteks on uute geneetiliselt muundatud teraviljasortide tootmine, iniminsuliini tootmine geneetiliselt muundatud bakterite abil, erütropoetiini tootmine rakukultuuris või uued katsehiirte tõud teadusuuringuteks.
Mikrobioloogilise, biosünteetilise tööstuse aluseks on bakterirakk. Tööstuslikuks tootmiseks vajalikud rakud valitakse välja kindlate omaduste järgi, millest olulisim on võime toota, sünteesida maksimaalses võimalikus koguses teatud ühendit - aminohapet või antibiootikumi, steroidhormooni või orgaanilist hapet. . Vahel peab olema mikroorganism, mis oskaks näiteks õli või reovett “toiduna” kasutada ja seda söödalisanditeks üsna sobivaks biomassiks või isegi valguks töödelda. Mõnikord vajame organisme, mis võivad areneda kõrgel temperatuuril või ainete juuresolekul, mis on kindlasti surmavad teist tüüpi mikroorganismidele.
Selliste tööstuslike tüvede hankimise ülesanne on väga oluline, nende modifitseerimiseks ja valikuks on välja töötatud arvukalt raku aktiivse mõjutamise meetodeid - alates tugevatoimeliste mürkidega töötlemisest kuni radioaktiivse kiiritamiseni. Nende tehnikate eesmärk on üks – saavutada muutused raku pärilikus, geneetilises aparaadis. Nende tulemuseks on arvukate mutantsete mikroobide tootmine, mille sadade ja tuhandete hulgast püüavad teadlased seejärel välja valida konkreetseks otstarbeks sobivaima. Keemilise või kiirgusmutageneesi meetodite loomine oli bioloogia silmapaistev saavutus ja seda kasutatakse laialdaselt tänapäevases. biotehnoloogia.
Kuid nende võimalused on piiratud mikroorganismide endi olemusega. Nad ei suuda sünteesida mitmeid väärtuslikke aineid, mis akumuleeruvad taimedes, eelkõige ravim- ja eeterlikes õlitaimedes. Nad ei suuda sünteesida loomade ja inimeste eluks väga olulisi aineid, mitmeid ensüüme, peptiidhormoone, immuunvalke, interferoone ja paljusid lihtsamaid ühendeid, mis sünteesitakse loomade ja inimeste organismis. Muidugi pole mikroorganismide võimalused kaugeltki ammendatud. Kogu mikroorganismide rohkusest on teaduses ja eriti tööstuses kasutatud vaid väikest osa. Mikroorganismide valikul pakuvad suurt huvi näiteks anaeroobsed bakterid, mis on võimelised elama hapniku puudumisel, valgusenergiat kasutavad fototroofid nagu taimed, kemoautotroofid, termofiilsed bakterid, mis on võimelised elama temperatuuridel, nagu hiljuti avastati, umbes 110 ° C jne.
Ja ometi on "loodusliku materjali" piirangud ilmsed. Nad on püüdnud ja üritavad piirangutest mööda hiilida taimede ja loomade raku- ja koekultuuride abil. See on väga oluline ja paljutõotav tee, mida ka rakendatakse biotehnoloogia. Viimastel aastakümnetel on teadlased välja töötanud meetodid, mille abil saab taime või looma üksikuid koerakke panna kasvama ja paljunema kehast eraldi, nagu bakterirakud. See oli oluline saavutus – saadud rakukultuure kasutatakse katseteks ja teatud ainete tööstuslikuks tootmiseks, mida ei ole võimalik saada bakterikultuuride abil.
Arengulugu ja saavutatud tehnoloogiatase
20. sajandi teisel poolel tehti mitmeid olulisi avastusi ja leiutisi, mis selle aluseks on geenitehnoloogia. Paljude aastate pikkused katsed "lugeda" geenidesse "kirjutatud" bioloogilist teavet on edukalt lõpule viidud. Seda tööd alustasid inglise teadlane F. Sanger ja Ameerika teadlane W. Gilbert (Nobeli keemiaauhind). Teatavasti sisaldavad geenid info-juhiseid RNA molekulide ja valkude, sh ensüümide sünteesiks organismis. Et sundida rakku sünteesima uusi, tema jaoks ebatavalisi aineid, on vajalik, et selles sünteesitaks vastavad ensüümide komplektid. Ja selleks on vaja selles asuvaid geene sihipäraselt muuta või sisestada sinna uusi, varem puudunud geene. Muutused geenides elusrakkudes on mutatsioonid. Need tekivad näiteks mutageenide – keemiliste mürkide või kiirguse mõjul. Kuid selliseid muutusi ei saa kontrollida ega suunata. Seetõttu on teadlased koondanud oma jõupingutused sellele, et püüda välja töötada meetodeid uute, väga spetsiifiliste inimestele vajalike geenide rakkudesse viimiseks.
Geenitehnoloogia probleemi lahendamise peamised etapid on järgmised:
1. Isoleeritud geeni saamine. 2. Geeni sisestamine vektorisse kehasse ülekandmiseks. 3. Vektori ülekandmine koos geeniga muudetud organismi. 4. Keharakkude transformatsioon. 5. Geneetiliselt muundatud organismide valik ( GMO) ja kõrvaldades need, mida ei õnnestunud muuta.
Geenide sünteesi protsess on nüüdseks väga hästi arenenud ja isegi suures osas automatiseeritud. Seal on spetsiaalsed arvutitega varustatud seadmed, mille mällu salvestatakse erinevate nukleotiidjärjestuste sünteesi programmid. See aparaat sünteesib kuni 100-120 lämmastikualuse pikkuseid DNA segmente (oligonukleotiide). Laialt levinud on tehnika, mis võimaldab kasutada polümeraasi ahelreaktsiooni DNA, sealhulgas mutantse DNA sünteesiks. Selles kasutatakse matriitsi DNA sünteesiks termostabiilset ensüümi DNA polümeraasi, mille seemnetena kasutatakse kunstlikult sünteesitud nukleiinhappe tükke – oligonukleotiide. Ensüüm pöördtranskriptaas võimaldab selliseid praimereid kasutades sünteesida DNA-d rakkudest eraldatud RNA matriitsil. Sel viisil sünteesitud DNA-d nimetatakse komplementaarseks DNA-ks (RNA) või cDNA-ks. Eraldatud "keemiliselt puhta" geeni võib saada ka faagi raamatukogust. See on bakteriofaagi preparaadi nimi, mille genoomi on sisse ehitatud juhuslikud fragmendid genoomist või cDNA-st, mida faag koos kogu oma DNA-ga reprodutseerib.
Geenide bakteritesse sisestamise tehnika töötati välja pärast seda, kui Frederick Griffith avastas bakterite transformatsiooni nähtuse. See nähtus põhineb primitiivsel seksuaalprotsessil, millega bakterites kaasneb mittekromosomaalse DNA väikeste fragmentide, plasmiidide vahetus. Plasmiidtehnoloogiad moodustasid aluse kunstlike geenide sisestamiseks bakterirakkudesse.
Märkimisväärseid raskusi seostati valmisgeeni sisestamisega taime- ja loomarakkude pärilikku aparaati. Looduses on aga juhtumeid, kus võõr-DNA (viiruse või bakteriofaagi) satub raku geneetilisse aparatuuri ja hakkab oma metaboolsete mehhanismide abil sünteesima “oma” valku. Teadlased uurisid võõra DNA sissetoomise tunnuseid ja kasutasid seda geneetilise materjali rakku viimise põhimõttena. Seda protsessi nimetatakse transfektsiooniks.
Kui ainuraksed organismid või mitmerakulised rakukultuurid alluvad modifitseerimisele, siis selles etapis algab kloonimine ehk nende organismide ja nende järglaste (kloonide) valimine, mis on läbinud modifikatsiooni. Kui ülesandeks on hankida hulkrakse organisme, kasutatakse muudetud genotüübiga rakke taimede vegetatiivseks paljundamiseks või viiakse surrogaatema blastotsüstidesse, kui tegemist on loomadega. Selle tulemusena sünnivad pojad muutunud või muutumatu genotüübiga, mille hulgast valitakse välja ja ristatakse omavahel vaid need, kellel on oodatud muutused.
Rakendus teadusuuringutes
Kuigi vähesel määral kasutatakse geenitehnoloogiat juba selleks, et anda teatud tüüpi viljatusega naistele võimalus rasestuda. Sel eesmärgil kasutatakse terve naise mune. Selle tulemusena pärib laps genotüübi ühelt isalt ja kahelt emalt.
Inimese genoomis märkimisväärsemate muudatuste tegemise võimalus seisab aga silmitsi mitmete tõsiste eetiliste probleemidega.
Mis on geenitehnoloogia?
Geenitehnoloogia on uus revolutsiooniline tehnoloogia, mille abil saavad teadlased eraldada geene ühest organismist ja viia need mis tahes teise organismi. Geenid on elu programm – need on bioloogilised konstruktsioonid, millest koosneb DNA ja mis määravad ühele või teisele elusorganismile omased spetsiifilised omadused. Geenisiirdamine muudab retsipientorganismi programmi ja selle rakud hakkavad tootma erinevaid aineid, mis omakorda loovad selles organismis uusi omadusi.
Seda meetodit kasutades saavad teadlased konkreetseid omadusi ja omadusi soovitud suunas muuta, näiteks arendada välja pikema säilivusajaga tomatisordi või herbitsiididele vastupidava sojaoasordi. Geenitehnoloogia on biotehnoloogia meetod, mis tegeleb genotüüpide ümberstruktureerimise uurimisega. Genotüüp ei ole lihtsalt mehaaniline geenide summa, vaid kompleksne süsteem, mis on välja kujunenud organismide evolutsiooni käigus. Geenitehnoloogia võimaldab geneetilist informatsiooni ühelt organismilt teisele üle kanda in vitro operatsioonide kaudu. Geeniülekanne võimaldab ületada liikidevahelisi barjääre ja kanda üle ühe organismi individuaalsed pärilikud omadused teisele. Geenide materiaalse baasi kandjad on kromosoomid, mis hõlmavad DNA-d ja valke. Kuid moodustumise geenid pole keemilised, vaid funktsionaalsed.
Funktsionaalsest vaatenurgast koosneb DNA paljudest plokkidest, mis salvestavad teatud hulga informatsiooni – geenid. Geeni toime põhineb selle võimel määrata RNA kaudu valgusünteesi. DNA molekul sisaldab justkui teavet, mis määrab valgu molekulide keemilise struktuuri. Geen on DNA molekuli osa, mis sisaldab teavet ühe valgu primaarstruktuuri kohta (üks geen – üks valk). Kuna organismides on kümneid tuhandeid valke, on kümneid tuhandeid geene.
Kõik raku geenid moodustavad selle genoomi. Kõik keharakud sisaldavad sama geenikomplekti, kuid igaüks neist rakendab erinevat osa salvestatud teabest. Seetõttu erinevad näiteks närvirakud maksarakkudest nii struktuursete, funktsionaalsete kui ka bioloogiliste omaduste poolest. Genotüüpide ümberkorraldamine geenitehnoloogia ülesannete täitmisel kujutab endast kvalitatiivseid muutusi geenides, mis ei ole seotud mikroskoobis nähtavate kromosoomide struktuuri muutustega. Geenimuutused on eelkõige seotud DNA keemilise struktuuri muutumisega.
Teave valgu struktuuri kohta, mis on kirjutatud nukleotiidide järjestusena, realiseeritakse sünteesitud valgu molekulis aminohapete järjestusega. Kromosomaalse DNA nukleotiidide järjestuse muutumine, osade kadumine ja teiste nukleotiidide kaasamine muudab DNA-l moodustunud RNA molekulide koostist ja see omakorda määrab sünteesi käigus uue aminohapete järjestuse. Selle tulemusena hakkab rakus sünteesima uut valku, mis toob kaasa uute omaduste ilmnemise kehas. Geenitehnoloogia meetodite olemus seisneb selles, et üksikud geenid või geenirühmad sisestatakse organismi genotüüpi või jäetakse sellest välja. Varem puudunud geeni genotüüpi sisestamise tulemusena võib rakk olla sunnitud sünteesima valke, mida ta varem ei olnud sünteesinud.
Geenitehnoloogia probleemid
Kahekümnenda sajandi teaduse ühe olulisema loomingu - geenitehnoloogia - võimalused on inimkonna kujutlusvõimet pikka aega erutanud, kuna see on lähenenud inimkehas kõige tähtsamale, tema keha eluseadustele. Aga kui veel viisteist aastat tagasi seostati biotehnoloogide töö tulemusi eelkõige uute porgandisortide või uut tõugu lüpsilehmade väljatöötamisega, siis paar aastat tagasi osutus võimalikuks suhelda väikese lamba Dollyga. , mille kloonisid Šoti bioloogid, ning eelmisel aastal teatati esimese enam-vähem üldise inimese genoomi kaardi loomisest. Bioloogia valdkonna saavutuste taustal on tagaplaanile vajumas eelmiste hooaegade hitid - uued infotehnoloogiad. Väheseid inimesi huvitab nüüd küsimus, millal saab inimene Marsil vabalt kõndida; arutelu selle üle, millal on võimalik inimest kloonida ja vastavalt sellele, kuidas seda vältida, on palju pakilisem - omamoodi noogutus moraalile ja eetikale.
Geenitehnoloogia – vaenlane või sõber? Ajalooline perspektiiv...
Ajalooline perspektiiv
Nagu teate, tekkis elu Maal umbes 4,6 miljardit aastat tagasi ja olenemata sellest, mis vormid see tekkis, vastutas iga organismi eluilmingute eest sama aine - desoksüribonukleiinhape (teise nimega DNA). Geenidesse kantud DNA määras ja määrab siiani (ja edaspidi ilmselt inimese rangel juhendamisel) rakkude ellujäämiseks vajaliku metaboolse aktiivsuse ja see ongi elu kõige lihtsamas definitsioonis. Tegelikult kasutati terminit "geenid" alles eelmise sajandi alguses, kuigi nende toimimise uurimine algas 19. sajandil. Austria munk Gregor Mendel jälgis aastaid hernetaimede järglasi, mida ta kloostriaias kasvatas. Salvestades väliseid tunnuseid - varre kõrgust, kroonlehtede värvi, herneste kuju, suutis ta teoreetiliselt oletada teatud "tegurite" olemasolu, mille järglased pärivad vanemtaimedelt. Nagu Columbus, suri Mendel, teadmata, mida ta oli avastanud. Alates kahekümnenda sajandi algusest on rakustruktuuri uurimise buum olnud. Bioloogidel õnnestus kindlaks teha, milliseid funktsioone raku tuum täidab, ja lahendada kromosoomide olemuse mõistatus. Kõige olulisem oli see, et selgus DNA molekulide translatsiooni olemus: meoosi ajal, mis eelneb munarakkude ja spermatosoidide ilmumisele, väheneb DNA-d sisaldavate kromosoomide arv poole võrra, mis hiljem fusiooniga sugurakud, võimaldavad nende tuumad ühendada üheks tervikuks – tekitada uus organism, millel on täiesti unikaalne geenikomplekt. 1953. aastal õnnestus lõpuks isoleerida DNA topeltspiraalne struktuur, mida nüüdseks teab iga koolilaps silma järgi. DNA on nüüdseks tunnistatud universaalseks bioloogiliseks keeleks, mis ühendab kõiki Maal elavaid organisme: inimesi ja baktereid, seeni ja taimi. Kahekümnes sajand ei ole aga mitte ainult fundamentaalsete avastuste, vaid ka inseneriteaduse – nende samade avastuste praktilise rakendamise – sajand. Seetõttu arenesid koos käimasolevate uuringutega selle kohta, kuidas see kõik üldiselt toimib, hüppeliselt arenenud erinevad geenitehnoloogia harud ja erinevad biotehnoloogiad. Algusest peale tegeles sedalaadi insenerimõte eelkõige sellega, kuidas saaks mõnda kindla geeniga elusorganismi kasutada teiste täiustamiseks – me rääkisime taimedest või loomadest. Seitsmekümnendatel õppisid teadlased ühe organismi DNA-st lõigud välja lõikama ja teise organismi siirdama, mis tegi väikese pöörde erinevate ravimite – insuliini, inimese kasvuhormooni jne – tootmises. Aastaid on püütud rakendada nn inimese geeniteraapiat - inimestele, kellel puuduvad teatud komponendid geenikomplektis või on nad mingil määral defektsed, siirdatakse teiste inimeste geene. Geneetika kaudu omandatud teadmisi kasutatakse inimese paljunemise valdkonnas üsna laialdaselt. Paljud inimesed teavad, et teatud tingimustel on täiesti võimalik lapsi "katseklaasist" kasvatada ja mõnes naise viljatuse olukorras - pöörduda abi saamiseks surrogaatema poole. Geneetiliselt muundatud taimed (külmakindlad teraviljad, transgeensed kartulid, kiiresti valmivad tomatid jne) ilmuvad juba toidulaudadele, kuigi siiani ei tekita need erilist elevust.
Geenitehnoloogia – vaenlane või sõber? Geenitehnoloogia võimalused...
Geenitehnoloogia võimalused, inimgenoomi projekt
Loomulikult ei saanud edukad manipulatsioonid taimede ja loomade geenidega viia üsna libeda küsimuseni: kuidas on lood inimestega? Kui on võimalik parandada loomi, siis miks mitte parandada inimesi. Kõigepealt peate siiski mõistma inimese geenikomplekti. Nii ilmus 1990. aastal algatus inimese kromosoomide kaardistamiseks, mis koosnevad 26-30 tuhandest geenist. Projekti nimetati lihtsalt inimgenoomiks ja see pidi kunagi 2005. aastal koostama genoomi täieliku kaardi. Projekt hõlmab uurimisrühmi erinevatest riikidest ja alates 90ndate lõpust. luuakse spetsiaalsed ettevõtted, mille põhiülesanne on hõlbustada ja kiirendada selliste gruppide vahelist suhtlust. 2001. aasta alguseks oli täielikult kaardistatud juba 2 kromosoomi: 21 ja 22.
Eelmise aasta peamine sensatsioon oli aga Craig Venteri grupi inimgenoomi üldise kaardi avastamine. Teadlased ütlevad, et kui võrrelda seda kaarti tavalistega, siis vaevalt oleks võimalik seda kasutada järgmisel tänaval asuvasse poodi jõudmiseks, kuid igal juhul räägib selle olemasolu fakt geenide ajastu algusest. patenteerimine ja see omakorda tekitab palju küsimusi, mis ei ole enam bioloogilised, vaid eetilised ja juriidilised. Kuigi teadlased väidavad, et genoomi kaardistamise põhieesmärk on vajadus mõista, kuidas inimkeha toimib, et tõhusamalt vastu seista erinevatele haigustele ning sellised teadmised võivad oluliselt hõlbustada uute ravimite loomist, on vajadus selle küsimuse õigusliku reguleerimise järele siiski. ilmneb: kuidas ja mida saab inimkehaga teha ning vastus küsimusele: kus peaksime peatuma? Kas inimene võib muutuda Looja sarnaseks ja hakata ise uusi olendeid looma? Inimese genoomi kaardistamist võrreldakse sageli selliste pöördeliste sündmustega nagu näiteks inimese Kuule maandumine. Nüüd on aga üks oluline erinevus: kui kosmoseprogrammid on üks riigi ülesannetest, siis projektis osalevatel kontsernidel on reeglina erafinantseering, mistõttu saavad oma arenduste autoriõigused mitteriiklikud ettevõtted. . Mida nad nendega teevad?
Kujutagem ette, et lähiajal saab kaart üsna täpselt koostatud ja iga inimest saab nii kirjeldada. Tekib küsimus – kes sellele teabele ligi pääseb? Kuivõrd suudab inimene enda kohta kõige “intiimsema” informatsiooni puutumatuna hoida? Kas tööandjad keelduvad palkamast inimest, kellel on geneetiline eelsoodumus mis tahes tüüpi vähi tekkeks? Kas ravikindlustus on võimalik olukorras, kus iga inimese genoom annab teavet kõigi võimalike haiguste kohta? Tony Blair rääkis kurjategijate geneetiliste portreede koostamise vajadusest. Ja tundub, et teadlased on valmis töötama välja spetsiaalsete geenide avastamiseks, mis vastutavad inimeste hälbiva käitumise eest. Paljusid eksperte aga hirmutab juba praegu väljavaade, et lähitulevikus nihutab ühiskond lahendusi erinevatele probleemidele – kuritegevus, vaesus, rassism jne. - geneetikute ja geenitehnoloogia kohta: "nad ütlevad, et kõik on geenides, kui midagi on valesti, siis pole see ühiskonna mure, vaid üksikisikute geneetiline eelsoodumus." Lõppude lõpuks unustavad paljud inimesed üldiselt, et ainult mõned haruldased haigused on põhjustatud ainuüksi geenide komplektist ja need haigused, mida me tavaliselt nimetame geneetilisteks – vähk, südame-veresoonkonna häired – on vaid osaliselt geneetilised, paljuski tõenäoline. nende toimumise pööre sõltub eelkõige inimese enda ja ühiskonna sammudest ning seetõttu ei saa olla midagi hullemat, kui ühiskond peseb oma käed sellisest olukorrast puhtaks. Levinuim geenitehnoloogia meetod on rekombinantse, s.o. mis sisaldab võõrgeeni, plasmiidi. Plasmiidid on ringikujulised kaheahelalised DNA molekulid, mis koosnevad mitmest tuhandest nukleotiidipaarist.
See protsess koosneb mitmest etapist:
1.
Piirang – DNA, näiteks inimese DNA lõikamine fragmentideks.
2.
Ligeerimine – soovitud geeniga fragment lisatakse plasmiididesse ja õmmeldakse kokku.
3.
Transformatsioon on rekombinantsete plasmiidide sisestamine bakterirakkudesse. Muutunud bakterid omandavad teatud omadused. Iga transformeeritud bakter paljuneb ja moodustab paljudest tuhandetest järglastest koosneva koloonia – klooni.
4.
Skriinimine on soovitud inimese geeni kandvate plasmiididega transformeeritud bakterite kloonide selekteerimine.
Kogu seda protsessi nimetatakse kloonimiseks. Kloonimist kasutades on inimeselt või muult organismilt võimalik saada rohkem kui miljon koopiat mis tahes DNA fragmendist. Kui kloonitud fragment kodeerib valku, siis on võimalik eksperimentaalselt uurida selle geeni transkriptsiooni reguleerivat mehhanismi, samuti toota seda valku vajalikus koguses. Lisaks saab ühest organismist pärit kloonitud DNA fragmenti viia teise organismi rakkudesse. Nii on võimalik saavutada näiteks kõrge ja stabiilne saak tänu sisse viidud geenile, mis tagab resistentsuse mitmete haiguste suhtes. Kui sisestate mullabakterite genotüüpi teiste bakterite geenid, millel on võime siduda õhulämmastikku, siis suudavad mullabakterid muuta selle lämmastiku fikseeritud mullalämmastikuks. Sisestades E. coli bakteri genotüüpi inimese genotüübist pärit geeni, mis kontrollib insuliini sünteesi, saavutasid teadlased sellise E. coli kaudu insuliini tootmise. Teaduse edasise arenguga saab võimalikuks puuduvate geenide sisestamine inimese embrüosse ja seeläbi geneetiliste haiguste vältimine.
Loomade kloonimise katsed on kestnud juba pikka aega. Piisab, kui eemaldada munarakust tuum, implanteerida sinna embrüokoest võetud teise raku tuum ja kasvatada – kas katseklaasis või lapsendaja emakas. Kloonitud lammas Doli loodi ebatavalisel viisil. Ühe tõu 6-aastase täiskasvanud lamba udaraku tuum siirdati teise tõu lamba tuumavabasse muna. Arenev embrüo pandi kolmanda tõu lambale. Kuna vastsündinud tall sai kõik geenid esimeselt doonorlambalt, on tegemist tema täpse geneetilise koopiaga. See katse avab paljude aastate pikkuse valiku asemel palju uusi võimalusi eliittõugude kloonimiseks. Texase ülikooli teadlased on suutnud pikendada mitut tüüpi inimrakkude eluiga. Tavaliselt rakk sureb pärast umbes 7-10 jagunemisprotsessi läbimist, kuid nad saavutasid sada raku jagunemist. Teadlaste sõnul toimub vananemine seetõttu, et rakud kaotavad iga jagunemisega telomeerid ehk molekulaarstruktuurid, mis paiknevad kõigi kromosoomide otstes.
Teadlased siirdasid rakkudesse avastatud geeni, mis vastutab telomeraasi tootmise eest, muutes need seeläbi surematuks. Võib-olla on see tulevane tee surematuseni. Alates 80ndatest on ilmunud programmid inimese genoomi uurimiseks. Nende programmide täitmise käigus on juba loetud umbes 5 tuhat geeni (täielik inimese genoom sisaldab 50-100 tuhat). Avastatud on hulk uusi inimese geene. Geenitehnoloogia muutub geeniteraapias järjest olulisemaks. Kuna paljud haigused on määratud geneetilisel tasandil. Just genoomis on eelsoodumus või resistentsus paljude haiguste suhtes. Paljud teadlased usuvad, et genoomimeditsiin ja geenitehnoloogia toimivad 21. sajandil. Ükski teadlane, kes seisab tõeliselt kindlalt teadusliku objektiivsuse platvormil, ei ütleks kunagi, et mis tahes võib ravida absoluutselt kõike või et miski on "absoluutselt ohutu", eriti kui tegemist on geenitehnoloogiaga, mis manipuleerib loodusseaduse üksikuid tasemeid, ignoreerides samal ajal selle terviklikkust. Nagu tuumauuringutega juba nägime, võib selliste manipulatsioonide tulemusena vabanev energia olla tohutu, kuid ka võimalik oht on tohutu. Kui tuumatehnoloogia oli arendusjärgus, ei osanud keegi arvata, et juba mõne aasta pärast ähvardab inimkonda mitmekordne hävimine, mida mõlemad vastasjõud võiksid võrdselt tagada. Ja kui tuumaenergiat hakati kasutama elektri tootmiseks, ei teadnud keegi, et tulemuseks on miljoneid tonne radioaktiivseid jäätmeid, mis jäävad mürgiseks kümneteks tuhandeteks aastateks. Keegi ei teadnud sellest midagi, kuid tegime siiski pimeda hüppe, tekitades sellega tõsiseid probleeme nii endale kui ka tulevastele põlvedele. Seetõttu peame olema väga ettevaatlikud geenitehnoloogia kasutamise suhtes, mis toimib tasemel, kus sisaldub täielik teave elu sügavaima struktuuri kohta.
Kulus miljoneid aastaid, enne kui elu Maal arenes välja väga tasakaalustatud ja dünaamilise ökosüsteemiga, nagu see praegu on, koos kõigi meile tänapäeval tuntud lugematute eluvormide mitmekesisusega. Elame praegu ajal, mil ühe põlvkonna või vähema aja pärast toimuvad geenitehnoloogia sekkumise tulemusena kõige olulisemad põllukultuurid radikaalsed muutused ning need muutused kahjustavad tõsiselt ökosüsteemi tervikuna ning ohustavad ka kogu inimkonda. Kuni geenitehnoloogia tulemusena saadud toodete ohutus pole tõestatud, jääb see küsimus alati kahtluse alla – ja seda seisukohta kaitseb Loomuõiguse Partei. Geenitehnoloogia kasutamisega peab kaasnema range teaduslik ohutuskontroll. Peaaegu täieliku kindlusega võib väita, et geenitehnoloogia toob kaasa keskkonna keemilise reostuse. Suurenenud herbitsiidiresistentsusega teraviljasortide aretamine toob kaasa asjaolu, et põllumehed on sunnitud kasutama umbrohutõrjeks senisest kolm korda rohkem keemilisi pestitsiide, mis omakorda suurendab Ameerika pinnase ja põhjavee reostust. Näiteks keemiafirma Monsanto on juba välja töötanud sama firma toodetava herbitsiidi Roundup suhtes resistentseid sorte maisist, sojaubadest ja suhkrupeedist. Tööstusametnikud on korduvalt öelnud, et Roundup on elusorganismidele ohutu ja keskkond neutraliseerib selle kiiresti. Taanis tehtud esialgsed uuringud on aga näidanud, et Roundup püsib pinnases kolm aastat (ja seetõttu võivad sellele alale istutatud põllukultuurid imenduda) ning muud teadustööd on näidanud, et selle kasutamine Herbitsiid põhjustab põllumeestel toksilisi reaktsioone, häirib. imetajate paljunemisfunktsiooni ning kahjustab kalu, vihmausse ja kasulikke putukaid.
Geenitehnoloogia pooldajad väidavad sageli, et see tehnoloogia on lihtsalt selle ristamise täiustus, mida on aastatuhandeid kasutatud põllukultuuride ja koduloomade tõu parandamiseks. Kuid tegelikult tungib geenitehnoloogia sekkumine läbi looduslike paljunemisbarjääride liikide vahel, mis säilitavad elu tasakaalu ja terviklikkuse Maal. Traditsiooniline uute tõugude ja sortide aretamise süsteem võib ristata üht tõugu sea teisega või hobust eesliga või kahte sorti tomatitega, kuid see ei saa ristata tomateid kaladega - loodus ei võimalda sellist geenide segamist. Ja geenitehnoloogia abiga on teadlased kala ja tomati geenid juba kokku pannud – ja need tomatid, mis pole kuidagi märgistatud, lebavad nüüd vaikselt meie riiulitel. Pealegi on praktiliselt kõik teraviljad, kaunviljad, juur- ja puuviljad juba läbinud geenitehnoloogia ning toiduainetööstus kavatseb kõik need tooted turule tuua järgmise 5-8 aasta jooksul. Maailma suurim seemnefirma Pioneer Hybrid International on geenitehnoloogia abil välja töötanud uue sojaoasordi, mis sisaldab brasiilia pähkli geeni, et suurendada sojaubade valgusisaldust. Kuid sojasse siirdatud Brasiilia pähkli komponent põhjustas enamikus tarbijates allergilise reaktsiooni ja seejärel tühistas Pioneer projekti. Ja kui Jaapani ettevõte Showa Denko muutis geenitehnoloogia abil loodusliku bakteri struktuuri, et tõhusamalt toota toidulisandit nimega trüptofaan, viisid need geneetilised manipulatsioonid selleni, et see bakter, olles osa trüptofaanist, hakkas tootma tugevat mürgine aine, mis avastati alles pärast toote turule toomist 1989. aastal. Selle tulemusena: 5000 inimest haigestus, 1500 jäi püsivalt invaliidiks ja 37 suri. Teadlased on väga innustunud kasutama geenitehnoloogiat kõrgema saagikusega nisusortide arendamiseks, toitvamate toitude loomiseks ja teatud haiguste kõrvaldamiseks, lootes seeläbi parandada inimeste elu Maal. Kuid tegelikkuses, hoolimata asjaolust, et geene saab katsekolvis ekstraheerida ja õigesti ristada, on päriselus väga raske ennustada geenide kellegi teise kehasse siirdamise tagajärgi.
Sellised toimingud võivad põhjustada mutatsioone, mille tulemusena pärsitakse organismi loomulike geenide aktiivsust. Sisestatud geenid võivad põhjustada ka ootamatuid kõrvalmõjusid: geneetiliselt muundatud toit võib sisaldada näiteks toksiine ja allergeene või olla vähenenud toiteväärtusega, mistõttu tarbijad haigestuvad või, nagu on juhtunud, isegi surevad. Lisaks on geenitehnoloogia abil aretatud organismid võimelised iseseisvalt paljunema ja ristuma looduslike populatsioonidega, mis ei ole läbinud geneetilist sekkumist, põhjustades pöördumatuid bioloogilisi muutusi kogu Maa ökosüsteemis. Võime täie kindlusega väita, et geenitehnoloogia on kindlasti perspektiivikas valdkond, mida meie riigis kahjuks ei rahastata ega oma tootjat. Venemaa muidugi tegeleb selle valdkonna arendustega, kuid on sunnitud oma leiutisi välismaale müüma. Meie teadlased leiutasid inimese interferooni, aspartaami ja ämblikuvõrgu. Oluline on see, et ravimit luues ei läheks see kasutusele enne, kui selle struktuur on lähedane inimese genoomile. Sel juhul on ravim täiesti kahjutu. Aspartaami tootmisel segatakse kaks aminohapet, kuid protsessi katalüsaatoriks on mikroorganismid. Geneetiku ülesanne on viia läbi arendus nii, et ravimi puhastamine mikroorganismidest läbiks 100% kontrolli. See on töö kvaliteet. Vastutame kvaliteedi eest ja professionaalne seisukoht on, et geenitehnoloogia on inimkonnale mõistlikul määral kasulik.
Geenitehnoloogia – vaenlane või sõber? Geenitehnoloogia ohud...
Teaduslikud faktid geenitehnoloogia ohtude kohta
1. Geenitehnoloogia erineb põhimõtteliselt uute sortide ja tõugude väljatöötamisest. Võõrgeenide kunstlik lisamine häirib oluliselt normaalse raku peenreguleeritud geneetilist kontrolli. Geenimanipulatsioon erineb põhimõtteliselt ema ja isa kromosoomide kombinatsioonist, mis toimub looduslike ristumise korral.
2. Praegu on geenitehnoloogia tehniliselt ebatäiuslik, kuna see ei suuda kontrollida uue geeni sisestamise protsessi. Seetõttu on sisestamiskohta ja lisatud geeni mõju võimatu ennustada. Isegi kui geeni asukohta saab määrata pärast selle genoomi sisestamist, on saadaolev DNA teave tulemuste ennustamiseks väga puudulik.
3. Võõrgeeni kunstliku lisamise tulemusena võib ootamatult tekkida ohtlikke aineid. Halvimal juhul võivad tegemist olla mürgiste ainete, allergeenide või muude tervisele kahjulike ainetega. Teave selliste võimaluste kohta on endiselt väga puudulik.
4. Puuduvad täiesti usaldusväärsed meetodid kahjutuse kontrollimiseks. Rohkem kui 10% uute ravimite tõsistest kõrvaltoimetest ei ole võimalik avastada hoolimata hoolikalt läbi viidud ohutusuuringutest. Risk, et uute geneetiliselt muundatud toitude ohtlikud omadused jäävad avastamata, on tõenäoliselt palju suurem kui ravimite puhul.
5. Praegused ohutustestimise nõuded on äärmiselt ebapiisavad. Need on selgelt kavandatud heakskiitmisprotsessi lihtsustamiseks. Need võimaldavad kasutada äärmiselt tundlikke kahjutuse testimise meetodeid. Seetõttu on märkimisväärne oht, et ohtlikud toiduained läbivad kontrolli märkamatult.
6. Seni geenitehnoloogia abil loodud toiduainetel ei ole inimkonna jaoks olulist väärtust. Need tooted rahuldavad peamiselt ainult kaubanduslikke huve.
7. Teadmised keskkonda sattunud geneetiliselt muundatud organismide mõjust on täiesti ebapiisavad. Veel ei ole tõestatud, et geenitehnoloogia abil muudetud organismid ei avaldaks keskkonnale kahjulikku mõju. Keskkonnakaitsjad on soovitanud mitmesuguseid võimalikke keskkonnaprobleeme. Näiteks on palju võimalusi geenitehnoloogias kasutatavate potentsiaalselt kahjulike geenide kontrollimatuks levikuks, sealhulgas geeniülekandeks bakterite ja viiruste poolt. Keskkonnast põhjustatud tüsistusi on tõenäoliselt võimatu parandada, kuna vabanenud geene ei saa tagasi võtta.
8. Võib tekkida uusi ja ohtlikke viirusi. Eksperimentaalselt on näidatud, et genoomi põimitud viirusgeenid võivad ühineda nakkuslike viiruste geenidega (nn rekombinatsioon). Need uued viirused võivad olla agressiivsemad kui algsed. Viirused võivad muutuda ka vähem liigispetsiifiliseks. Näiteks võivad taimeviirused muutuda kahjulikuks kasulikele putukatele, loomadele ja ka inimestele.
9. Teadmised päriliku aine DNA kohta on väga puudulikud. Teada on vaid kolme protsendi DNA funktsioon. On riskantne manipuleerida keeruliste süsteemidega, mille kohta teadmised on puudulikud. Laialdased kogemused bioloogia, ökoloogia ja meditsiini vallas näitavad, et see võib põhjustada tõsiseid ettearvamatuid probleeme ja häireid.
10. Geenitehnoloogia ei lahenda maailma näljaprobleemi. Väide, et geenitehnoloogia võib oluliselt kaasa aidata maailma näljaprobleemi lahendamisele, on teaduslikult põhjendamatu müüt.
 Sulamistemperatuur ni
Sulamistemperatuur ni Mille poolest erineb meteoor meteoriidist?
Mille poolest erineb meteoor meteoriidist? Rostov: “Raha pole – uputa ennast vähemalt ära!
Rostov: “Raha pole – uputa ennast vähemalt ära!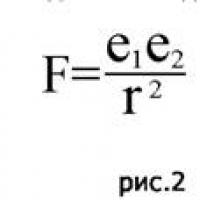 Kas antigravitatsioon on olemas?
Kas antigravitatsioon on olemas? Kvantpõimumine lihtsate sõnadega
Kvantpõimumine lihtsate sõnadega Surmaoru liikuvad kivid Salapärased liikuvad kivid
Surmaoru liikuvad kivid Salapärased liikuvad kivid Milline Lel on muinasjutu Lumetüdruk?
Milline Lel on muinasjutu Lumetüdruk?