§12. Karboxylsyror. Karboxylsyror: fysikaliska egenskaper. Salter av karboxylsyror Den enklaste karboxylsyran är myrsyra
DEFINITION
Organiska ämnen vars molekyler innehåller en eller flera karboxylgrupper kopplade till en kolväteradikal kallas karboxylsyror.
De första tre medlemmarna i den homologa serien av karboxylsyror, inklusive propionsyra, är vätskor som har en stickande lukt och är mycket lösliga i vatten. Följande homologer, som börjar med smörsyra, är också vätskor som har en stark obehaglig lukt, men som är dåligt lösliga i vatten. Högre syror, med antalet kolatomer 10 eller fler, är fasta, luktfria, olösliga i vatten. I allmänhet, i en serie homologer, med ökande molekylvikt, minskar lösligheten i vatten, densiteten minskar och kokpunkten ökar (tabell 1).
Tabell 1. Homolog serie av karboxylsyror.
Beredning av karboxylsyror
Karboxylsyror erhålls genom oxidation av mättade kolväten, alkoholer och aldehyder. Till exempel ättiksyra - genom att oxidera etanol med en lösning av kaliumpermanganat i en sur miljö vid upphettning:
Kemiska egenskaper hos karboxylsyror
De kemiska egenskaperna hos karboxylsyror bestäms främst av särdragen hos deras struktur. Sålunda kan vattenlösliga syror dissociera till joner:
R-COOH↔R-COO - + H+.
På grund av närvaron av H + jon i vatten har de en sur smak, kan ändra färgen på indikatorer och leda elektrisk ström. I vattenlösning är dessa syror svaga elektrolyter.
Karboxylsyror har kemiska egenskaper som är karakteristiska för lösningar av oorganiska syror, d.v.s. interagerar med metaller (1), deras oxider (2), hydroxider (3) och svaga salter (4):
2CH3-COOh + Zn → (CH3COO)2Zn + H2(1);
2CH3-COOH + CuO→ (CH3COO)2Cu + H2O (2);
R-COOH + KOH → R-COOK + H2O (3);
2CH3-COOH + NaHCO3 → CH3COONa + H2O + CO2 (4).
En specifik egenskap hos mättade och omättade karboxylsyror, manifesterad av den funktionella gruppen, är interaktion med alkoholer.
Karboxylsyror reagerar med alkoholer vid upphettning och i närvaro av koncentrerad svavelsyra. Till exempel, om etylalkohol och lite svavelsyra tillsätts till ättiksyra, uppträder lukten av etylättiksyra (etylacetat) när den värms upp:
CH3-COOH + C2H5OH ↔CH3-C(O)-O-C2H5 + H2O.
En specifik egenskap hos mättade karboxylsyror, manifesterad av radikalen, är halogeneringsreaktionen (kloreringsreaktionen).

Applicering av karboxylsyror
Karboxylsyror tjänar som råmaterial för produktion av ketoner, syrahalogenider, vinylestrar och andra viktiga klasser av organiska föreningar.
Myrsyra används i stor utsträckning för att erhålla estrar som används i parfymer, inom läderindustrin (garvningsläder), inom textilindustrin (som betningsmedel för färgning), som lösningsmedel och konserveringsmedel.
En vattenlösning (70-80%) av ättiksyra kallas vinägeressens, och en 3-9% vattenlösning kallas bordsvinäger. Essensen används ofta för att få vinäger hemma genom utspädning.
Exempel på problemlösning
EXEMPEL 1
| Träning | Vilka kemiska reaktioner kan användas för att utföra följande omvandlingar: a) CH4 → CH3Cl → CH3OH → HCHO → HCOOH → HCOOK. Skriv reaktionsekvationerna och ange villkoren för deras uppkomst. |
| Svar | a) Klorering av metan i ljuset leder till produktion av klormetan: CH4 + Cl2 → CH3CI + HCl. Halogenderivat av alkaner genomgår hydrolys i ett vattenhaltigt eller alkaliskt medium för att bilda alkoholer: CH3Cl + NaOH → CH3OH + NaCl. Som ett resultat av oxidationen av primära alkoholer, till exempel med kaliumdikromat i en sur miljö i närvaro av en katalysator (Cu, CuO, Pt, Ag), bildas aldehyder: CH3OH+ [O] →HCHO. Aldehyder oxideras lätt till motsvarande karboxylsyror, till exempel med kaliumpermanganat: HCHO + [O] → HCOOH. Karboxylsyror uppvisar alla egenskaper som finns i svaga mineralsyror, d.v.s. kan interagera med aktiva metaller för att bilda salter: 2HCOOH+ 2K→2HCOOH+H2. |
EXEMPEL 2
| Träning | Skriv reaktionsekvationerna mellan följande ämnen: a) 2-metylpropansyra och klor; b) ättiksyra och propanol-2; c) akrylsyra och bromvatten; d) 2-metylbutansyra och fosfor(V)klorid. Specificera reaktionsbetingelserna. |
| Svar | a) som ett resultat av reaktionen mellan 2-metylpropansyra och klor ersätts väteatomen i kolväteradikalen i a-positionen; 2-metyl-2-klorpropansyra bildas H3C-C(CH3)H-COOH + Cl2 → H3C-C(CH3)Cl-COOH + HCl (kat = P). b) som ett resultat av reaktionen mellan ättiksyra och propanol-2, bildas en ester - isopropylester av ättiksyra. CH3-COOH + CH3-C(OH)H-CH3 -> CH3-C(O)-O-C(CH3)-CH3. c) som ett resultat av interaktionsreaktionen mellan akrylsyra och bromvatten, tillsats av en halogen vid platsen för dubbelbindningen i enlighet med Markovnikovs regel; 2,3-dibrompropansyra bildas CH2=CH-COOH + Br2 -> CH2Br-CHBr-COOH d) som ett resultat av reaktionen mellan 2-metylbutansyra och fosfor(V)klorid, bildas motsvarande syraklorid CH3-CH2-C(CH3)H-COOH + PCl5 →CH3-CH2-C(CH3)H-COOCl + POCI3 + HCl. |
Karboxylsyror- organiska ämnen vars molekyler innehåller en eller flera karboxylgrupper.
Karboxylgruppen (förkortad COOH) är en funktionell grupp av karboxylsyror och består av en karbonylgrupp och en associerad hydroxylgrupp.
Baserat på antalet karboxylgrupper delas karboxylsyror in i monobasiska, dibasiska, etc.
Den allmänna formeln för monobasiska karboxylsyror är R—COOH. Ett exempel på en tvåbasisk syra är oxalsyra HOOC—COOH.
Baserat på typen av radikal delas karboxylsyror in i mättad (till exempel ättiksyra CH 3 COOH), omättad [till exempel akrylsyra CH 2 =CH—COOH, oljesyra CH 3 —(CH 2) 7 —CH =CH—(CH2)7-COOH] och aromatiska (till exempel bensoisk C6H5-COOH).
Isomerer och homologer
Monobasiska mättade karboxylsyror R-COOH är isomerer av estrar (förkortat R"-COOR") med samma antal kolatomer. Den allmänna formeln för båda är C n H 2 n O2.
| G | HCOOH metan (myra) |
||||
| CH3COOH etan (ättiksyra) | HCOOCH 3 myrsyrametylester |
||||
| CH3CH2COOH propan (propionsyra) |
HCOOCH 2 CH 3 etylmyrsyra |
CH 3 COOCH 3 ättiksyrametylester | |||
| CH3(CH2)2COOH butan (olja) |
2-metylpropan |
HCOOCH 2 CH 2 CH 3 propylester av myrsyra |
CH 3 COOCH 2 CH 3 Etylacetat |
CH 3 CH 2 COOCH 3 propionsyrametylester |
|
| isomerer | |||||
Algoritm för att sammanställa namnen på karboxylsyror
- Hitta kolets ryggrad - detta är den längsta kedjan av kolatomer, inklusive kolatomen i karboxylgruppen.
- Numrera kolatomerna i huvudkedjan, börja med karboxylkolatomen.
- Namnge föreningen med hjälp av algoritmen för kolväten.
- I slutet av namnet lägger du till suffixet "-ov", ändelsen "-aya" och ordet "syra".
I molekyler av karboxylsyror sid-elektroner av syreatomerna i hydroxylgruppen interagerar med elektroner i -bindningen av karbonylgruppen, vilket resulterar i att polariteten hos O-H-bindningen ökar, -bindningen i karbonylgruppen stärks, den partiella laddningen (+) på kolatomen minskar och den partiella laddningen (+) på väteatomen ökar .
Det senare främjar bildningen av starka vätebindningar mellan karboxylsyramolekyler.
De fysikaliska egenskaperna hos mättade enbasiska karboxylsyror beror till stor del på närvaron av starka vätebindningar mellan molekyler (starkare än mellan alkoholmolekyler). Därför är syrors kokpunkter och löslighet i vatten högre än motsvarande alkoholer.
Syrors kemiska egenskaper
Förstärkning av -bindningen i karbonylgruppen leder till att additionsreaktioner är okarakteristiska för karboxylsyror.
- Förbränning:
CH 3 COOH + 2O 2 2CO 2 + 2H 2 O
- Sura egenskaper.
På grund av O-H-bindningens höga polaritet dissocierar karboxylsyror i en vattenlösning märkbart (mer exakt, reagerar reversibelt med den):HCOOH HCOO - + H + (mer exakt HCOOH + H 2 O HCOO - + H 3 O +)
Alla karboxylsyror är svaga elektrolyter. När antalet kolatomer ökar, minskar syrornas styrka (på grund av en minskning av polariteten hos O-H-bindningen); tvärtom leder införandet av halogenatomer i kolväteradikalen till en ökning av syrans styrka. Ja, på radHCOOH CH 3 COOH C 2 H 5 COOH
styrkan av syror minskar, och i serienÖkande.
Karboxylsyror uppvisar alla egenskaper som är inneboende i svaga syror:
Mg + 2CH 3 COOH (CH 3 COO) 2 Mg + H 2
CaO + 2CH 3 COOH (CH 3 COO) 2 Ca + H 2 O
NaOH + CH 3 COOH CH 3 COONa + H 2 O
K 2 CO 3 + 2CH 3 COOH 2CH 3 COOK + H 2 O + CO 2 - Förestring (reaktion av karboxylsyror med alkoholer som leder till bildandet av en ester):
Flervärda alkoholer, såsom glycerol, kan också ingå i förestringsreaktionen. Estrar som bildas av glycerol och högre karboxylsyror (fettsyror) är fetter.Fetter är blandningar av triglycerider. Mättade fettsyror (palmitsyra C 15 H 31 COOH, stearin C 17 H 35 COOH) bildar fasta fetter av animaliskt ursprung, och omättade fettsyror (oljesyra C 17 H 33 COOH, linolsyra C 17 H 31 COOH, etc.) bildar flytande fetter (oljor) av vegetabiliskt ursprung.
- Substitution i en kolväteradikal:
Substitution sker i positionen -.Det speciella med myrsyra HCOOH är att detta ämne är en bifunktionell förening; det är både en karboxylsyra och en aldehyd:
Därför reagerar bland annat myrsyra med en ammoniaklösning av silveroxid (silverspegelreaktion; kvalitativ reaktion):HCOOH + Ag 2 O (ammoniaklösning) CO 2 + H 2 O + 2 Ag
Beredning av karboxylsyror
.
O
//
Gruppen av -C-atomer kallas en karboxylgrupp eller karboxyl.
\
ÅH
Organiska syror som innehåller en karboxylgrupp i molekylen är monobasiska. Den allmänna formeln för dessa syror är RCOOH.
Karboxylsyror som innehåller två karboxylgrupper kallas dibasiska. Dessa inkluderar till exempel oxalsyra och bärnstenssyror.
Det finns också flerbasiska karboxylsyror som innehåller mer än två karboxylgrupper. Dessa inkluderar till exempel tribasisk citronsyra. Beroende på arten av kolväteradikalen delas karboxylsyror in i mättade, omättade och aromatiska.
Mättade, eller mättade, karboxylsyror är till exempel propansyra (propionsyra) eller den redan kända bärnstenssyran.
Uppenbarligen innehåller mättade karboxylsyror inte P-binder i en kolväteradikal.
I molekyler av omättade karboxylsyror är karboxylgruppen associerad med en omättad, omättad kolväteradikal, till exempel i molekyler av akryl(propen) CH2=CH-COOH eller oljesyra CH3-(CH2)7-CH=CH-(CH2) 7-COOH och andra syror.
Som framgår av formeln för bensoesyra är den aromatisk, eftersom den innehåller en aromatisk (bensen) ring i molekylen.
Nomenklatur och isomerism
Vi har redan övervägt de allmänna principerna för bildandet av namnen på karboxylsyror, såväl som andra organiska föreningar. Låt oss uppehålla oss mer i detalj vid nomenklaturen för mono- och dibasiska karboxylsyror. Namnet på en karboxylsyra bildas av namnet på motsvarande alkan (alkan med samma antal kolatomer i molekylen) med tillägg av suffixet -ov, ändelsen -aya och ordet syra. Numreringen av kolatomer börjar med karboxylgruppen. Till exempel:
Många syror har också historiskt etablerade, eller triviala, namn (tabell 6). 
Efter vår första bekantskap med den mångfaldiga och intressanta världen av organiska syror, kommer vi att överväga mer detaljerat de mättade monobasiska karboxylsyrorna.
Det är tydligt att sammansättningen av dessa syror kommer att återspeglas av den allmänna formeln C n H 2 n O2, eller C n H 2n +1 COOH, eller RCOOH.
Fysikaliska egenskaper hos mättade monobasiska karboxylsyror
Lägre syror, det vill säga syror med en relativt liten molekylvikt som innehåller upp till fyra kolatomer per molekyl, är vätskor med en karakteristisk stickande lukt (kom ihåg lukten av ättiksyra). Syror som innehåller från 4 till 9 kolatomer är trögflytande oljiga vätskor med en obehaglig lukt; som innehåller mer än 9 kolatomer per molekyl - fasta ämnen som inte löser sig i vatten. Kokpunkterna för mättade enbasiska karboxylsyror ökar med ökande antal kolatomer i molekylen och följaktligen med ökande relativ molekylvikt. Till exempel är kokpunkten för myrsyra 101 °C, ättiksyra är 118 °C och propionsyra är 141 °C.
Den enklaste karboxylsyran, myr HCOOH, med en liten relativ molekylvikt (46), är under normala förhållanden en vätska med en kokpunkt på 100,8 °C. Samtidigt är butan (MR(C4H10) = 58) under samma förhållanden gasformigt och har en kokpunkt på -0,5 °C. Denna diskrepans mellan kokpunkter och relativa molekylvikter förklaras av bildandet av karboxylsyradimerer, i vilka två syramolekyler är sammanlänkade med två vätebindningar. Förekomsten av vätebindningar blir tydlig när man överväger strukturen hos karboxylsyramolekyler.
Molekyler av mättade monobasiska karboxylsyror innehåller en polär grupp av atomer - karboxyl (tänk på vad som orsakar polariteten hos denna funktionella grupp) och en praktiskt taget opolär kolväteradikal. Karboxylgruppen attraheras av vattenmolekyler och bildar vätebindningar med dem.
Myr- och ättiksyror är obegränsat lösliga i vatten. Det är uppenbart att med en ökning av antalet atomer i en kolväteradikal minskar lösligheten av karboxylsyror.
Genom att känna till sammansättningen och strukturen hos karboxylsyramolekyler kommer det inte att vara svårt för oss att förstå och förklara de kemiska egenskaperna hos dessa ämnen.
Kemiska egenskaper
De allmänna egenskaperna som är karakteristiska för klassen av syror (både organiska och oorganiska) beror på närvaron i molekylerna av en hydroxylgrupp som innehåller en mycket polär bindning mellan väte- och syreatomer. Dessa egenskaper är välkända för dig. Låt oss överväga dem igen med exemplet med vattenlösliga organiska syror.
1. Dissociation med bildning av vätekatjoner och anjoner av syraresten. Mer exakt beskrivs denna process av en ekvation som tar hänsyn till deltagandet av vattenmolekyler i den.
Dissociationsjämvikten för karboxylsyror förskjuts åt vänster, de allra flesta av dem är svaga elektrolyter. Ändå förklaras den sura smaken av till exempel myr- och ättiksyror av dissociationen till vätekatjoner och anjoner av sura rester.
Det är uppenbart att närvaron av "surt" väte i molekylerna av karboxylsyror, d.v.s. vätet i karboxylgruppen, också bestämmer andra karakteristiska egenskaper.
2. Interaktion med metaller i det elektrokemiska spänningsområdet upp till väte. Således reducerar järn väte från ättiksyra:
2CH3-COOH + Fe -> (CHgCOO)2Fe + H2
3. Interaktion med basiska oxider för att bilda salt och vatten:
2R-COOH + CaO -> (R-COO)2Ca + H20
4. Reaktion med metallhydroxider för att bilda salt och vatten (neutraliseringsreaktion):
R-COOH + NaOH -> R-COONa + H20 3R-COOH + Ca(OH)2 -> (R-COO)2Ca + 2H20
5. Interaktion med salter av svagare syror, med bildningen av de senare. Således ersätter ättiksyra stearinsyra från natriumstearat och kolsyra från kaliumkarbonat.
6. Interaktionen mellan karboxylsyror och alkoholer för att bilda estrar är den förestringsreaktion som du redan känner till (en av de viktigaste reaktionerna som är karakteristiska för karboxylsyror). Interaktionen mellan karboxylsyror och alkoholer katalyseras av vätekatjoner.
Förestringsreaktionen är reversibel. Jämvikten skiftar mot bildandet av estern i närvaro av avvattningsämnen och avlägsnande av ester från reaktionsblandningen.
I den omvända reaktionen av förestring, kallad esterhydrolys (reagera en ester med vatten), bildas en syra och en alkohol. Det är uppenbart att flervärda alkoholer, till exempel glycerol, också kan reagera med karboxylsyror, d.v.s. ingå i en förestringsreaktion: 
Alla karboxylsyror (utom myrsyra), tillsammans med karboxylgruppen, innehåller en kolväterest i sina molekyler. Naturligtvis kan detta inte annat än påverka syrornas egenskaper, vilka bestäms av kolväteresternas natur.
7. Additionsreaktioner vid en multipelbindning - omättade karboxylsyror kommer in i dem; till exempel är reaktionen av vätetillsats hydrogenering. När oljesyra hydreras bildas mättad stearinsyra.
Omättade karboxylsyror, liksom andra omättade föreningar, tillsätter halogener via en dubbelbindning. Till exempel missfärgar akrylsyra bromvatten.
8. Substitutionsreaktioner (med halogener) - mättade karboxylsyror kan komma in i det; till exempel, genom att reagera ättiksyra med klor, kan olika klorerade syror erhållas:

Vid halogenering av karboxylsyror som innehåller mer än en kolatom i kolväterest är bildningen av produkter med olika positioner av halogenen i molekylen möjlig. När en reaktion sker via en fri radikalmekanism kan alla väteatomer i kolväteresten ersättas. Om reaktionen utförs i närvaro av små mängder röd fosfor, fortsätter den selektivt - väte ersätts endast i A-position (vid kolatomen närmast den funktionella gruppen) i syramolekylen. Du kommer att lära dig orsakerna till denna selektivitet när du studerar kemi vid en högre utbildningsinstitution.
Karboxylsyror bildar olika funktionella derivat när de ersätter hydroxylgruppen. När dessa derivat hydrolyseras bildas karboxylsyra igen.
Karboxylsyraklorid kan framställas genom att omsätta fosfor(III)klorid eller tionylklorid (SOCl2) med syra. Karboxylsyraanhydrider framställs genom att omsätta kloranhydrider med karboxylsyrasalter. Estrar bildas genom förestring av karboxylsyror med alkoholer. Förestringen katalyseras av oorganiska syror.
Denna reaktion initieras av protonering av karboxylgruppen - interaktionen av en vätekatjon (proton) med det ensamma elektronparet i syreatomen. Protonering av en karboxylgrupp innebär en ökning av den positiva laddningen på kolatomen i den:

Metoder för att erhålla
Karboxylsyror kan erhållas genom oxidation av primära alkoholer och aldehyder.
Aromatiska karboxylsyror bildas genom oxidation av bensenhomologer.
Hydrolys av olika karboxylsyraderivat producerar också syror. Således producerar hydrolysen av en ester en alkohol och en karboxylsyra. Som nämnts ovan är syrakatalyserade förestrings- och hydrolysreaktioner reversibla. Hydrolys av estern under inverkan av en vattenlösning av alkali fortskrider irreversibelt, i detta fall bildas inte en syra, utan dess salt från estern. Vid hydrolysen av nitriler bildas först amider som sedan omvandlas till syror. Karboxylsyror bildas genom interaktion av organiska magnesiumföreningar med kolmonoxid (IV).
Individuella representanter för karboxylsyror och deras betydelse
Myrsyra (metan) HCOOH är en vätska med en stickande lukt och en kokpunkt på 100,8 °C, mycket löslig i vatten. Myrsyra är giftig och orsakar brännskador om den kommer i kontakt med huden! Den stickande vätskan som utsöndras av myror innehåller denna syra. Myrsyra har desinficerande egenskaper och finner därför sin användning inom livsmedels-, läder- och läkemedelsindustrin samt medicin. Det används också för att färga tyger och papper.
Ättiksyra (etansyra) CH3COOH är en färglös vätska med en karakteristisk stickande lukt, blandbar med vatten i valfritt förhållande. Vattenhaltiga lösningar av ättiksyra marknadsförs under namnet vinäger (3-5% lösning) och vinäger essence (70-80% lösning) och används i stor utsträckning inom livsmedelsindustrin. Ättiksyra är ett bra lösningsmedel för många organiska ämnen och används därför inom färgning, garvning och färg- och lackindustrin. Dessutom är ättiksyra ett råmaterial för produktion av många tekniskt viktiga organiska föreningar: till exempel erhålls ämnen som används för att bekämpa ogräs - herbicider - från den. 
Ättiksyra är huvudkomponenten i vinäger, vars karakteristiska lukt beror på det. Det är en produkt av etanoloxidation och bildas av det när vin lagras i luft.
De viktigaste representanterna för högre mättade monobasiska syror är palmitin C15H31COOH och stearin C17H35COOH syror. Till skillnad från lägre syror är dessa ämnen fasta och svårlösliga i vatten.
Deras salter - stearater och palmitater - är dock mycket lösliga och har en tvättmedelseffekt, varför de också kallas för tvålar. Det är tydligt att dessa ämnen produceras i stor skala.
Av de omättade högre karboxylsyrorna är oljesyra C17H33COOH, eller (CH2)7COOH, av största vikt. Det är en oljeliknande vätska utan smak eller lukt. Dess salter används i stor utsträckning inom teknik.
Den enklaste representanten för dibasiska karboxylsyror är oxalsyra (etandisyra) HOOC-COOH, vars salter finns i många växter, till exempel syra och syra. Oxalsyra är ett färglöst kristallint ämne som är mycket lösligt i vatten. Det används för polering av metaller inom träbearbetnings- och läderindustrin.
1. Omättad elaidinsyra C17H33COOH är en transisomer av oljesyra. Skriv strukturformeln för detta ämne.
2. Skriv en ekvation för hydreringsreaktionen av oljesyra. Namnge produkten av denna reaktion.
3. Skriv en ekvation för stearinsyras förbränningsreaktion. Vilken volym syre och luft (n.a.) kommer att krävas för att bränna 568 g stearinsyra?
4. En blandning av fasta fettsyror - palmitin och stearin - kallas stearin (det är av detta som stearin suppositorier tillverkas). Vilken volym luft (n.a.) kommer att krävas för att bränna ett tvåhundragrams stearinljus om stearin innehåller lika stora mängder palmitin- och stearinsyra? Vilken volym koldioxid (n.o.) och massa vatten bildas i detta fall?
5. Lös det föregående problemet förutsatt att ljuset innehåller lika stora mängder (samma antal mol) stearin- och palmitinsyra.
6. För att ta bort rostfläckar, behandla dem med en lösning av ättiksyra. Gör molekylära och joniska ekvationer för de reaktioner som sker i detta fall, med hänsyn till att rost innehåller järn(III)oxid och hydroxid - Fe2O3 och Fe(OH)3. Varför tas inte sådana fläckar bort med vatten? Varför försvinner de när de behandlas med en syralösning?
7. Bakpulver NaHC03 tillsatt till den jästfria degen "släcks" först med ättiksyra. Gör denna reaktion hemma och skriv dess ekvation, med vetskap om att kolsyra är svagare än ättiksyra. Förklara bildandet av skum.
8. Genom att veta att klor är mer elektronegativt än kol, ordna följande syror: ättiksyra, propionsyra, klorättiksyra, diklorättiksyra och triklorättiksyra i ordningsföljd efter ökande sura egenskaper. Motivera ditt resultat.
9. Hur kan vi förklara att myrsyra reagerar i en "silverspegel"-reaktion? Skriv en ekvation för denna reaktion. Vilken gas kan släppas ut i detta fall?
10. När 3 g mättad enbasisk karboxylsyra reagerade med överskott av magnesium, frigjordes 560 ml (n.s.) väte. Bestäm formeln för syran.
11. Ge reaktionsekvationer som kan användas för att beskriva ättiksyrans kemiska egenskaper. Nämn produkterna av dessa reaktioner.
12. Föreslå en enkel laboratoriemetod genom vilken du kan känna igen propan- och akrylsyror.
13. Skriv en ekvation för reaktionen för att producera metylformiat - en ester av metanol och myrsyra. Under vilka förhållanden ska denna reaktion utföras?
14. Skapa strukturformler för ämnen med sammansättningen C3H602. Vilka klasser av ämnen kan de klassificeras i? Ge reaktionsekvationerna som är karakteristiska för var och en av dem.
15. Ämne A - en isomer av ättiksyra - är olöslig i vatten, men kan genomgå hydrolys. Vad är strukturformeln för ämne A? Nämn produkterna från dess hydrolys.
16. Skapa strukturformlerna för följande ämnen:
a) metylacetat;
b) oxalsyra;
c) myrsyra;
d) diklorättiksyra;
e) magnesiumacetat;
f) etylacetat;
g) etylformiat;
h) akrylsyra.
17*. Ett prov av mättad enbasisk organisk syra som vägde 3,7 g neutraliserades med en vattenlösning av natriumbikarbonat. Genom att leda den frigjorda gasen genom kalkvatten erhölls 5,0 g sediment. Vilken syra togs och hur mycket gas som frigjordes?
Karboxylsyror i naturen
Karboxylsyror är mycket vanliga i naturen. De finns i frukter och växter. De finns i nålar, svett, urin och nässeljuice. Du vet, det visar sig att huvuddelen av syrorna bildar estrar, som luktar. Således lockar lukten av mjölksyra, som finns i mänsklig svett, myggor, de känner av den på ett ganska stort avstånd. Därför, hur mycket du än försöker driva bort den irriterande myggan, så känner den fortfarande sitt offer bra. Förutom mänsklig svett finns mjölksyra i saltgurka och surkål.
Och apor, för att locka till sig en hane, utsöndrar ättiksyra och propionsyra. En hunds känsliga nos kan lukta smörsyra, som har en koncentration på 10–18 g/cm3.
Många växtarter är kapabla att producera ättiksyra och smörsyra. Och vissa ogräs drar fördel av detta och, genom att släppa ämnen, eliminera sina konkurrenter, undertrycka deras tillväxt och ibland orsaka deras död.
Indianerna använde också syra. För att förstöra fienden blötlade de pilarna med ett dödligt gift, som visade sig vara ett derivat av ättiksyra.
Och här uppstår en naturlig fråga: utgör syror en fara för människors hälsa? Trots allt har oxalsyra, som är utbredd i naturen och finns i syra, apelsiner, vinbär och hallon, av någon anledning inte funnit användning i livsmedelsindustrin. Det visar sig att oxalsyra är tvåhundra gånger starkare än ättiksyra, och kan till och med fräta på rätter, och dess salter, som ackumuleras i människokroppen, bildar stenar.
Syror har funnit bred användning i alla sfärer av mänskligt liv. De används inom medicin, kosmetologi, livsmedelsindustri, jordbruk och för hushållsbehov.
För medicinska ändamål används organiska syror som mjölksyra, vinsyra och askorbinsyra. Förmodligen använde var och en av er C-vitamin för att stärka kroppen - det här är just askorbinsyra. Det hjälper inte bara att stärka immunförsvaret, utan har också förmågan att ta bort cancerframkallande ämnen och gifter från kroppen. Mjölksyra används för kauterisering, eftersom den är mycket hygroskopisk. Men vinsyra fungerar som ett milt laxermedel, som ett motgift mot alkaliförgiftning och som en komponent som är nödvändig för att förbereda plasma för blodtransfusioner.
Men fans av kosmetiska procedurer bör veta att fruktsyror som finns i citrusfrukter har en gynnsam effekt på huden, eftersom de tränger djupt in och kan påskynda processen för hudförnyelse. Dessutom har lukten av citrusfrukter en tonisk effekt på nervsystemet.
Har du märkt att bär som tranbär och lingon lagras länge och håller sig fräscha. Vet du varför? Det visar sig att de innehåller bensoesyra, som är ett utmärkt konserveringsmedel.
Men inom jordbruket har bärnstenssyra fått stor användning, eftersom den kan användas för att öka produktiviteten hos odlade växter. Det kan också stimulera växttillväxt och påskynda deras utveckling.
1.Karboxylsyror – dessa är syrehaltiga organiska ämnen vars molekyler innehåller en eller flera karboxylgrupper
(-CO OOH ) kopplad till en kolradikal eller väteatom.
Karboxylgruppen innehåller två funktionella grupper - karbonyl >C=O och hydroxyl-OH, direkt bundna till varandra:
2. Klassificering
A) Med antalet karboxylgrupper i molekylen
|
namn |
Exempel |
|
1) Monobasic |
Metan ny , myrsyra Etan ny , ättiksyra |
|
2) Dibasic |
HOOC-COOH Oxalsyra |
|
3) Polybasic |
B) Av kolväteradikalens natur
|
namn |
Exempel |
|
1) Gräns (mättad) |
HCOOH Metan ny , myrsyra CH3COOH Etan ny , ättiksyra |
|
2) Obegränsad |
Akrylsyra CH2 = CHCOOH Krotonsyra CH3-CH=CH-COOH Oljesyra CH 3 –(CH 2) 7 –CH=CH–(CH 2) 7 –COOH Linolsyra CH 3 –(CH 2) 4 –(CH=CH–CH 2) 2 –(CH 2) 6 –COOH Linolen CH 3 –CH 2 –(CH=CH–CH 2) 3 –(CH 2) 6 –COOH |
|
3) Aromatisk |
C 6 H 5 COOH – bensoesyra NOOS–C 6 H 4 –COOH Par-tereftalsyra |
3. Isomerism och nomenklatur
jag . Strukturell
A) Isomerism av kolskelettet (med början från C 4 )
B) Interklass med estrar R - CO - O - R 1 (med början från C 2)
Till exempel: för C 3 H 6 O 2
CH3-CH2-COOH propionsyra
MED H3-CO-OCH3-metylester av ättiksyra
II . Rumslig
A) Optisk
Till exempel:
B) Cis-trans-isomerism för omättade syror
Exempel:
4. Karboxylsyrors nomenklatur
Systematiska namn på syror ges av namnet på motsvarande kolväte med tillägg av ett suffix -ny och ord syra.
För att indikera positionen för substituenten (eller radikalen) börjar numreringen av kolkedjan från kolatomen i karboxylgruppen. Till exempel kallas en förening med en grenad kolkedja (CH 3) 2 CH-CH 2 -COOH 3-metylbutansyra. Triviala namn används också ofta för organiska syror, som vanligtvis återspeglar den naturliga källan där föreningarna först upptäcktes.
Vissa monobasiska syror
|
Formel |
Syranamn R-COOH |
Restnamn RCOO - |
|
|
systematisk |
trivial |
||
|
HCOOH |
metan |
myra |
formatera |
|
CH3COOH |
etan |
vinäger |
acetat |
|
C2H5COOH |
propan |
propionsyra |
propionat |
|
C3H7COOH |
butan |
olja |
butyrat |
|
C4H9COOH |
pentan |
vänderot |
valerate |
|
C5H11COOH |
hexan |
nylon |
caprat |
|
C15H31COOH |
hexadekan |
palmitin- |
palmitat |
|
C17H35COOH |
oktadekan |
stearin- |
stearat |
|
C6H5COOH |
bensenkolsyra |
bensoin |
bensoat |
|
CH2=CH-COOH |
propen |
akryl |
akrylat |
Suffix används för flerbasiska syror -diovaya, -triovaya etc.
Till exempel:
HOOC-COOH- etandisyra (oxal)syra;
HOOC-CH 2 -COOH - propandisyra (malonsyra).
BEGRÄNS MONOBAS KARBOXYLSYROR
CnH 2 n +1 - COOHellerCnH 2 nO 2
Homolog serie
|
namn |
Formel syror |
t pl. |
t kip. |
ρ |
|
|
syror |
|||||
|
myra |
metan |
HCOOH |
100,5 |
1,22 |
|
|
vinäger |
etan |
CH3COOH |
16,8 |
1,05 |
|
|
propionsyra |
propan |
CH3CH2COOH |
0,99 |
||
|
olja |
butan |
CH3(CH2)2COOH |
0,96 |
||
Karboxylgruppens struktur
Karboxylgruppen kombinerar två funktionella grupper - karbonyl > C = O och hydroxyl -OH, som ömsesidigt påverkar varandra:
De sura egenskaperna hos karboxylsyror beror på en förskjutning i elektrondensitet till karbonylsyre och den resulterande ytterligare (jämfört med alkoholer) polarisering av O–H-bindningen.
I en vattenlösning dissocierar karboxylsyror till joner:
Löslighet i vatten och höga kokpunkter för syror beror på bildandet av intermolekylära vätebindningar.
Med ökande molekylvikt minskar syrors löslighet i vatten.
Fysikaliska egenskaper hos mättade monobasiska syror
De nedre delarna av denna serie är under normala förhållanden vätskor med en karakteristisk stickande lukt. Till exempel har etansyra (ättiksyra) en karakteristisk "ättiksyra" lukt. Vattenfri ättiksyra är en vätska vid rumstemperatur; vid 17 °C fryser det och förvandlas till ett iskallt ämne som kallas "isättika". De mellersta representanterna för denna homologa serie är trögflytande, "oljiga" vätskor; utgående från C10 - fasta ämnen.
Den enklaste aromatiska syran - bensoesyra C 6 H 5 COOH (smp 122,4 ° C) - sublimerar lätt, d.v.s. förvandlas till ett gasformigt tillstånd, förbi det flytande tillståndet. När den kyls sublimeras dess ångor till kristaller. Denna egenskap används för att rena ett ämne från föroreningar.
DEFINITION
Karboxylsyror– organiska föreningar vars molekyler innehåller en eller flera funktionella karboxylgrupper – COOH, associerad med en kolväteradikal.
Karboxylgruppen består av en karbonylgrupp > C= O och den associerade hydroxylgruppen -OH.
Den allmänna formeln för karboxylsyror är R-COOH.
De sura egenskaperna hos karboxylsyror beror på en förskjutning i elektrondensitet till karbonylsyren, vilket orsakar uppkomsten av en partiell positiv laddning på atomen.
Som ett resultat ökar polariteten hos O–H-bindningen, och dissociationsprocessen blir möjlig:
Den resulterande anjonen stabiliseras på grund av laddningsdelokalisering:

Lägre karboxylsyror som innehåller upp till 3 kolatomer är färglösa vätskor med en karakteristisk stickande lukt, blandbara med vatten i vilket förhållande som helst. De flesta syror som innehåller 4–9 atomer är oljiga vätskor med en obehaglig lukt. Syror som innehåller mer än 10 väteatomer är fasta ämnen som är olösliga i vatten.
Karboxylsyrors löslighet i vatten och höga kokpunkter är förknippade med bildandet av intermolekylära vätebindningar. I fast tillstånd finns karboxylsyror huvudsakligen i form av cykliska dimerer, och i flytande tillstånd förekommer linjär association:
Typer av karboxylsyror
Beroende på strukturen hos kolväteradikalen delas karboxylsyror in i:
- aromatisk (bensoesyra)
- alifatisk (mättad (kapronsyra) och omättad (akrylsyra))
- alicyklisk (kininsyra)
- heterocyklisk (nikotinsyra).
Baserat på antalet karboxylgrupper delas karboxylsyror in i:
- monobas()
- dibasisk (oxalsyra)
- polybasisk (citronsyra).
När andra funktionella grupper (–OH, =CO, –NH2, etc.) införs i syramolekylen, bildas andra klasser av föreningar: hydroxi, ketosyror, etc.
Allmän formel för mättade monobasiska karboxylsyror:
MED n H2nO2 (n= 1,2,3...) eller Cn H2n+1 COOH (n = 0,1,2…)
Allmän formel för omättade monobasiska karboxylsyror:
MED n H 2 n –2 O 2 (n= 1,2,3...) eller CnH 2 n –1 COOH (n = 0,1,2…)
Allmän formel för mättade tvåbasiska karboxylsyror:
C n H 2n–2 O 4 (n = 2,3…)
Namn och formler för vissa karboxylsyror
|
Karboxylsyraformel |
IUPAC namn |
Trivialt namn |
|---|---|---|
|
Mättade monobasiska karboxylsyror |
||
|
Omättade monobasiska karboxylsyror |
||
|
Dibasiska karboxylsyror |
||
Exempel på problemlösning
EXEMPEL 1
| Träning | Tre identiska provrör utan signaturer innehåller tre syror: myrsyra, ättiksyra och saltsyra. Baserat på skillnaderna i deras kemiska egenskaper, hur kan du avgöra vilken syra som finns i varje provrör? |
| Lösning | Myrsyra uppvisar också vissa egenskaper (reduktiv). Därför kan det bestämmas till exempel genom reaktionen med koppar(II)hydroxid; i fallet med myrsyra bildas röd koppar(I)oxid: De återstående syrorna kan särskiljas genom reaktion med silvernitrat. När det gäller saltsyra faller en vit fällning av silverklorid ut: Silveracetat löser sig i vatten, så inga förändringar kommer att ske i provröret. Det återstående provröret innehåller alltså ättiksyra. |
EXEMPEL 2
| Träning | Bestäm om, vid hydrolys av ett prov som väger 2,64 g, 1,38 g alkohol och 1,8 g monobasisk karboxylsyra frigörs. |
| Lösning | Den allmänna formeln för en ester som består av en alkohol och en syra med olika antal kolatomer är: Således är alkoholformeln: och formeln för syran är: Låt oss skriva ekvationen för esterhydrolys: I enlighet med lagen om bevarande av massa av ämnen är massan av reaktionsprodukter lika med massan av utgångsämnena. Låt oss beräkna massan: M(syra) + m(alkohol) – m(eter) g Låt oss beräkna mängden vattenämne: Enligt reaktionsekvationen n(syra) = n(alkohol) mol |
 Rörelse av kroppar under påverkan av gravitationen
Rörelse av kroppar under påverkan av gravitationen Troper och stilfigurer
Troper och stilfigurer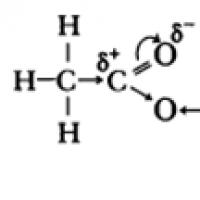 §12. Karboxylsyror. Karboxylsyror: fysikaliska egenskaper. Salter av karboxylsyror Den enklaste karboxylsyran är myrsyra
§12. Karboxylsyror. Karboxylsyror: fysikaliska egenskaper. Salter av karboxylsyror Den enklaste karboxylsyran är myrsyra Samtal med ex-flickvän
Samtal med ex-flickvän Varför drömmer du om din bästa vän, ex-vän eller barndomsvän?
Varför drömmer du om din bästa vän, ex-vän eller barndomsvän? Drömtolkning av en gravid kvinna drömmer om ett barn
Drömtolkning av en gravid kvinna drömmer om ett barn Varför drömmer du om gnistström? Varför drömmer du om gnistor? Vad skriver de i drömböcker
Varför drömmer du om gnistström? Varför drömmer du om gnistor? Vad skriver de i drömböcker