Lydymosi temperatūra ni. Nikelio panaudojimo sritys. Pažiūrėkite, kas yra „nikelis“ kituose žodynuose
Jis pasižymi puikiu atsparumu korozijai, dideliu stiprumu, estetiniu patrauklumu ir galimybe įgauti bet kokią jam suteiktą formą. Dėl savo savybių šis . Daugiau nei 60% nikelio patenka į nerūdijančio plieno gamybą.
Nikelis naudojamas namų statybai, įdomiems architektūriniams projektams, sienų dekoravimui ir kanalizacijos vamzdžių gamybai. Nikelio yra visur mūsų gyvenime. Todėl šiandien pažvelgsime į jo sudėtį, struktūrą ir nikelio savybes.
Nikelis yra baltas su sidabriniu atspalviu. Šis metalas dažnai derinamas su kitomis medžiagomis. Dėl to susidaro lydiniai.
- Nikelio yra maiste, žemės plutoje, vandenyje ir net ore.
- Nikelis turi į veidą orientuotą kubinę gardelę (a = 3,5236A). Įprastoje būsenoje jis pateikiamas β modifikacijos pavidalu. Katodo purškimo metu jis transformuojasi į α modifikaciją su šešiakampe gardele. Jei toliau kaitinsite nikelį iki 200°C, jo grotelės taps kubinės.
- Nikelis turi nebaigtą 3d elektronų apvalkalą, todėl jis priskiriamas pereinamiesiems metalams.
- Elementas nikelis yra dalis svarbiausių magnetinių lydinių ir medžiagų, kurių šiluminio plėtimosi koeficientas yra minimalus.
Nikelis, kuris nėra perdirbtas ir išgaunamas iš gamtos, susideda iš 5 stabilių izotopų. Mendelejevo periodinėje lentelėje nikelis sunumeruotas 28. Šio elemento atominė masė yra 58,70.
Nikelio savybės
Tankis ir masė
Nikelis priklauso daugeliui sunkiųjų metalų. Jo tankis yra du kartus didesnis nei titano metalo, bet skaitiniu tankiu lygus .
Nikelio savitojo tankio skaitinė reikšmė yra 8902 kg/m3. Nikelio atominė masė: 58,6934 a. e.m. (g/mol).
Mechaninės charakteristikos
Nikelis turi gerą plastiškumą ir lankstumą. Dėl šių savybių jį galima lengvai susukti. Iš jo gana lengva pagaminti plonus lakštus ir mažus vamzdžius.
Esant temperatūrai nuo 0 iki 631 K, nikelis tampa feromagnetinis. Šis procesas vyksta dėl ypatingos nikelio atomo išorinių apvalkalų struktūros.
Yra žinomos šios mechaninės nikelio charakteristikos:
- Padidėjusi jėga.
- Tempiamasis stipris lygus 450 MPa.
- Labai plastikinė medžiaga.
- Atsparumas korozijai.
- Aukšta lydymosi temperatūra.
- Didelis katalizinis gebėjimas.
Aprašyto metalo mechaninės charakteristikos priklauso nuo priemaišų buvimo. Pavojingiausios ir kenksmingiausios yra siera, bismutas ir stibis. Jei nikelis yra prisotintas dujomis, jo mechaninės savybės pablogės.
Šilumos ir elektros laidumas
- Nikelio metalas turi tokį šilumos laidumą: 90,1 W/(m K) (esant 25°C temperatūrai).
- Nikelio elektrinis laidumas yra 11 500 000 Sim/m.
Atsparumas korozijai
Atsparumas korozijai reiškia metalo gebėjimą atsispirti sunaikinimui, kai jis yra veikiamas agresyvios aplinkos. Nikelis yra medžiaga, pasižyminti dideliu atsparumu korozijai.
Nikelis nerūdys šiose aplinkose:
- Aplinkos atmosfera. Nikelis turi gerą atsparumą aukštai temperatūrai. Jei nikelis yra veikiamas pramoninėje atmosferoje, jis visada yra padengtas plona plėvele, dėl kurios nikelis susitepa.
- Karštos ir šaltos formos šarmai, taip pat jų išlydytos būsenos.
- Organinės rūgštys.
- Neorganinės rūgštys.
Be to, nikelis nerūdija karštuose alkoholiuose ir riebalų rūgštyse. Dėl šios priežasties šis metalas plačiai naudojamas maisto pramonėje.
Chemijos pramonė taip pat plačiai naudoja nikelį. Taip yra dėl nikelio atsparumo korozijai aukštai temperatūrai ir didelėms tirpalų koncentracijoms.
Nikelis yra jautrus korozijai tokiomis aplinkos sąlygomis:
- Jūros vanduo.
- Šarminiai hipochloritų tirpalai.
- Siera arba bet kokia terpė, kurioje yra sieros.
- Oksiduojančių druskų tirpalai.
- Amoniako hidratas ir amoniako vanduo.
Nikelio toksiškumas aptariamas toliau.
Temperatūros
 Yra žinomos šios termodinaminės nikelio savybės:
Yra žinomos šios termodinaminės nikelio savybės:
- Nikelio lydymosi temperatūra: 1726 K arba 2647 °F arba 1453 °C.
- Nikelio virimo temperatūra: 3005 K arba 4949 °F arba 2732 °C.
- Liejimo temperatūra: 1500-1575 °C.
- Atkaitinimo temperatūra: 750 – 900 °C.
Toksiškumas ir ekologiškumas
Dideliais kiekiais nikelis daro toksišką poveikį organizmui. Jei kalbame apie jo vartojimą su maistu, padidėjęs šio elemento kiekis tikrai kels grėsmę sveikatai.
Dažnai sutinkama neigiama nikelio pertekliaus pasekmė yra alergija. Taip pat, paveikus šį metalą (dideliais kiekiais) ant kūno, atsiranda skrandžio ir žarnyno sutrikimai, būtinai padidėja raudonųjų kraujo kūnelių kiekis. Nikelis gali sukelti lėtinį bronchitą, inkstų stresą ir plaučių funkcijos sutrikimą. Nikelio perteklius provokuoja plaučių vėžį.
Jei geriamajame vandenyje yra 250 dalių nikelio milijonui dalių vandens, toks kiekis gali sukelti kraujo ligas ir inkstų sutrikimus. Tačiau tai gana reta.
Nikelio randama tabako dūmuose. Įkvėpus šių nikelio turinčių dūmų ar dulkių, išsivysto bronchitas ir pablogėja plaučių funkcija. Šią medžiagą galima gauti nepalankiomis sąlygomis arba aplinkai nepalankiose vietose.
Nikelio toksiškumas kelia pavojų tik tada, kai į žmogaus organizmą jo patenka dideliais kiekiais. Jei nikelis naudojamas pramonėje ir statybose, jis nėra pavojingas.
Kitos charakteristikos
Nikelis taip pat turi šias savybes:
- Nikelio elektrinė varža yra 68,8 nomm.
- Cheminiu požiūriu nikelis yra panašus į geležį, kobaltą, varį ir kai kuriuos tauriuosius metalus.
- Nikelis reaguoja su deguonimi 500 C temperatūroje.
- Jei nikelis pasiskirsto smulkiai, jis gali savaime užsidegti.
- Nikelis nereaguoja su azotu net esant labai aukštai temperatūrai.
- Nikelis tirpsta lėčiau nei geležis rūgštyse.
Dar gerokai iki nikelio atradimo Saksonijos kalnakasiai žinojo mineralą, kuris buvo panašus į vario rūdą ir buvo naudojamas stiklo gamyboje, norint nuspalvinti stiklą žaliai. Visi bandymai iš jo gauti vario buvo nesėkmingi, todėl jis gavo pavadinimą „kupfernickel“, kuris maždaug reiškia „Varinis velnias“ (plg. vok. Nickel - išdykęs). Šį mineralą (raudonojo nikelio pirito NiAs) 1751 m. ištyrė švedų mineralogas ir chemikas Kronstedtas. Jam pavyko gauti žaliąjį oksidą, o pastarąjį redukuojant – naują metalą, vadinamą nikeliu.
Būnant gamtoje, gauti:
Nikelis gamtoje yra gana paplitęs – jo kiekis žemės plutoje yra 0,01 % (masės). Geležies meteorituose (iki 8%). Augaluose vidutiniškai 5 * 10 -5 svorio procentai, jūros gyvūnuose - 1,6 * 10 -4, sausumos gyvūnuose - 1 * 10 -6, žmogaus organizme - 1 ... 2 * 10 -6
Didžioji nikelio dalis gaunama iš garnierito ir magnetinių piritų keliais būdais:
1. Sukamosiose vamzdžių krosnyse silikato rūda redukuojama anglies dulkėmis iki geležies-nikelio granulių (5-8 % Ni), kurios vėliau išvalomos nuo sieros, kalcinuojamos ir apdorojamos amoniako tirpalu. Parūgštinus tirpalą, iš jo elektrolitiniu būdu gaunamas metalas.
2. Karbonilo metodas (Mond metodas). Pirma, vario-nikelio matinis sluoksnis gaunamas iš sulfido rūdos, per kurią aukštu slėgiu praleidžiamas CO. Labai lakus tetrakarbonilnikelis susidaro terminio skilimo metu, dėl kurio išsiskiria ypač grynas metalas.
3. Aliuminioterminis metodas. Nikelio redukcija iš oksidinės rūdos aliuminiu: 3NiO + 2Al = 3Ni +Al 2 O 3.
Fizinės savybės:
Nikelio metalas yra sidabrinės spalvos su gelsvu atspalviu, labai kietas, kietas ir kalus, gerai poliruojasi, traukia magnetas. Paprastos medžiagos tankis Nr. 8,902 g/cm 3, lydymosi temperatūra = 1726 K, virimo temperatūra = 3005 K.
Cheminės savybės:
Esant normaliai temperatūrai, nikelis pasižymi dideliu atsparumu korozijai – jis yra stabilus ore, vandenyje, šarmuose ir daugelyje rūgščių. Reaguoja su azoto rūgštimi, sudarydamas nikelio(II) nitratą Ni(NO 3) 2 ir atitinkamą azoto oksidą.
Kaitinamas nikelis reaguoja su daugeliu nemetalų: halogenais, siera, fosforu, anglimi. Esant atmosferos deguoniui 800°C temperatūroje, nikelis sudaro oksidą NiO.
Nikelis gali absorbuoti didelius vandenilio kiekius, todėl nikelyje susidaro kieti vandenilio tirpalai.
Su anglies (II) monoksidu nikelis lengvai sudaro lakų ir labai toksišką karbonilo Ni(CO)4.
Svarbiausios jungtys:
Junginiuose kobalto oksidacijos būsena yra +3, +2, 0.
Nikelio(II) oksidas, NiO- kieta medžiaga nuo šviesios iki tamsiai žalios arba juodos spalvos. Vyrauja pagrindinės savybės, jis redukuojamas į metalą vandeniliu ir kitais reduktoriais.
Nikelio (II) hidroksidas, Ni (OH) 2- žalios spalvos, mažai tirpsta vandenyje ir šarmuose, gerai daug rūgščių, vyrauja bazinės savybės. Kaitinamas, jis suyra ir susidaro NiO.
Nikelio(II) druskos- dažniausiai gaunamas NiO arba Ni(OH) 2 reaguojant su įvairiomis rūgštimis. Vandenyje tirpios nikelio druskos dažniausiai sudaro kristalinius hidratus, pavyzdžiui, NiSO 4 *7H 2 O, Ni(NO 3) 2 *6H 2 O. Netirpūs nikelio junginiai apima Ni 3 (PO 4) 2 fosfatą ir Ni 2 SiO 4 silikatą. Kristaliniai hidratai ir tirpalai dažniausiai būna žalios spalvos, o bevandenės druskos – geltonos arba rusvai geltonos spalvos.
Nikelio(II) kompleksiniai junginiai labai daug (skaičius = 6). Jų susidarymas paaiškina, pavyzdžiui, nikelio oksido ištirpimą amoniako tirpale. Nikelio dimetilglioksimatas Ni(C 4 H 6 N 2 O 2) 2, kuris rūgštinėje aplinkoje suteikia skaidrią raudoną spalvą, naudojamas kaip kokybinė reakcija į nikelio (II) jonus.
Nikelio(III) junginiai- mažiau būdingas. Pavyzdžiui, žinoma oksidas Ni 2 O 3 * H 2 O, juoda medžiaga, gaunama oksiduojant nikelio(II) hidroksidą šarminėje terpėje su hipochloritu arba halogenais:
2Ni(OH)2 + 2NaOH + Br2 = Ni 2O3 *H2O + 2NaBr + H2O
Stiprus oksidatorius.
Taip pat yra nikelio(III) kompleksiniai junginiai Pavyzdžiui, K 3.
Nikelio karbonilas, Ni(CO) 4. Diamagnetinis bespalvis skystis, labai lakus ir toksiškas. Kietėja esant -23°C, o pakaitinus iki 180-200°C skyla į metalinį nikelį ir anglies oksidą (II). Ni(CO) 4 mažai tirpsta vandenyje, gerai organiniuose tirpikliuose, nereaguoja su atskiestomis rūgštimis ir šarmais.
Taikymas:
Nikelis yra daugelio lydinių komponentas – karščiui atsparių, atsparių lydinių (nichromas: 60% Ni + 40% Cr), papuošalų (baltojo aukso, vario nikelio), monetų.
Nikelis taip pat naudojamas nikeliavimui – sukuriant korozijai atsparią dangą ant kito metalo paviršiaus. Jie taip pat naudojami baterijų gamybai, muzikos instrumentų stygų vyniojimui...
Nikelis yra vienas iš mikroelementų, būtinų normaliam gyvų organizmų vystymuisi. Yra žinoma, kad jis dalyvauja gyvūnų ir augalų fermentinėse reakcijose.
Nikelis gali sukelti alergiją (kontaktinį dermatitą) metalams, kurie liečiasi su oda (juvelyriniai dirbiniai, laikrodžiai, džinsinio audinio kniedės). Europos Sąjunga riboja nikelio kiekį gaminiuose, kurie liečiasi su žmogaus oda.
Rudagina Olga
HF Tiumenės valstybinis universitetas, 581gr., 2011 m
Šaltiniai: Vikipedija: http://ru.wikipedia.org/wiki/Ni ir kt.,
Populiari cheminių elementų biblioteka. Nikelis. http://n-t.ru/ri/ps/pb028.htm
Rusijos chemijos technikos universiteto Bendrosios ir neorganinės chemijos katedros svetainė. DI. Mendelejevas. Lentelė D.I. Mendelejevas: Nikelis
Nikelis
NIKELIS-Aš; m.[vokiečių kalba Nikelis] Cheminis elementas (Ni), sidabriškai baltas, ugniai atsparus metalas, turintis stiprų blizgesį (naudojamas pramonėje).
◁ Nikelis, oi, oi. N. mano. N-oji rūda. N-tieji lydiniai. N-oji danga.
nikelio(lot. Niccolum), periodinės lentelės VIII grupės cheminis elementas. Pavadinimas kilęs iš vokiško Nikelio – piktosios dvasios, kuri tariamai trukdė kalnakasiams, pavadinimas. Sidabro baltumo metalas; tankis 8,90 g/cm 3, t pl 1455°C; feromagnetinis (Curie taškas 358°C). Labai atsparus orui ir vandeniui. Pagrindiniai mineralai yra nikelitas, milleritas, pentlanditas. Apie 80% nikelio naudojama nikelio lydiniams. Jis taip pat naudojamas baterijų, cheminės įrangos gamybai, antikorozinėms dangoms (nikeliavimui), kaip daugelio cheminių procesų katalizatorius.
NIKELISNIKELIS (lot. Niсsolum), Ni, cheminis elementas, kurio atominis skaičius 28, atominė masė 58,69. Cheminis elemento Ni simbolis tariamas taip pat, kaip ir paties elemento pavadinimas. Natūralus nikelis susideda iš penkių stabilių nuklidų (cm. NUKLIDAS): 58 Ni (67,88 % masės), 60 Ni (26,23 %), 61 Ni (1,19 %), 62 Ni (3,66 %) ir 64 Ni (1,04 %). Periodinėje D. I. Mendelejevo sistemoje nikelis yra įtrauktas į VIIIB grupę ir kartu su geležimi (cm. GELEŽIS) ir kobalto (cm. COBALTAS) 4-ajame šios grupės periode jis sudaro panašių savybių pereinamųjų metalų triadą. Dviejų išorinių elektroninių nikelio atomo sluoksnių konfigūracija 3 s 2
p 6
d 8
4s 2
. Jis dažniausiai sudaro junginius oksidacijos būsenoje +2 (valentas II), rečiau oksidacijos būsenoje +3 (valentas III) ir labai retai oksidacijos būsenose +1 ir +4 (atitinkamai I ir IV valentingumas).
Neutralaus nikelio atomo spindulys yra 0,124 nm, Ni 2+ jono spindulys yra nuo 0,069 nm (koordinacijos numeris 4) iki 0,083 nm (koordinacijos skaičius 6). Nikelio atomo nuoseklios jonizacijos energijos yra 7,635, 18,15, 35,17, 56,0 ir 79 eV. Pagal Paulingo skalę nikelio elektronegatyvumas yra 1,91. Standartinis elektrodo potencialas Ni 0 /Ni 2+ –0,23 V.
Paprasta medžiaga nikelis kompaktiškos formos yra blizgus sidabriškai baltas metalas.
Atradimų istorija
Jau nuo XVII a. Saksonijos (Vokietija) kalnakasiai žinojo apie rūdą, kuri savo išvaizda priminė vario rūdą, tačiau lydant vario negavo. Jis buvo vadinamas kupfernickel (vok. Kupfer – varis, o nikelis – nykštuko, kuris kalnakasiams nuslydo ne vario rūdos, o uolienų atliekų) vardas. Kaip vėliau paaiškėjo, kupfernikelis yra nikelio ir arseno junginys NiAs. Nikelio atradimo istorija tęsėsi beveik pusę amžiaus. Pirmąją išvadą apie naujo „pusmetalo“ buvimą kupfernikelyje (tai yra pagal to meto terminologiją paprasta medžiaga, savo savybėmis tarpinė tarp metalų ir nemetalų) padarė švedų metalurgas A. F. Kronstedtas. (cm. KRONSTEDT Axel Fredrik) 1751 metais. Tačiau daugiau nei dvidešimt metų šis atradimas buvo ginčijamas ir vyravo požiūris, kad Kronstedtas gavo ne naują paprastą medžiagą, o kažkokį junginį su siera iš geležies, bismuto, kobalto ar kito metalo.
Tik 1775 m., praėjus 10 metų po Kronstedto mirties, švedas T. Bergmanas atliko tyrimus, kurie leido padaryti išvadą, kad nikelis yra paprasta medžiaga. Tačiau nikelis kaip elementas galutinai įsitvirtino tik XIX amžiaus pradžioje, 1804 m., po kruopštaus vokiečių chemiko I. Richterio tyrimų. (cm. RICHTERIS Jeremijas Benjaminas), kuris gryninimui atliko 32 nikelio sulfato (nikelio sulfato) perkristalizacijas ir dėl išgavimo gavo gryną metalą.
Buvimas gamtoje
Žemės plutoje nikelio yra apie 8,10–3 % masės. Gali būti, kad milžiniški nikelio kiekiai – apie 17 10 19 tonų – yra Žemės šerdyje, kurią, remiantis viena paplitusia hipoteze, sudaro geležies ir nikelio lydinys. Jei taip, tada Žemę sudaro maždaug 3% nikelio, o tarp planetą sudarančių elementų nikelis užima penktą vietą – po geležies, deguonies, silicio ir magnio. Nikelio randama kai kuriuose meteorituose, kurie yra nikelio ir geležies lydinys (vadinami geležies ir nikelio meteoritais). Žinoma, tokie meteoritai neturi jokios reikšmės kaip praktinis nikelio šaltinis. Svarbiausi nikelio mineralai: nikelis (cm. NIKELINAS)(šiuolaikinis kupfernickel pavadinimas) NiAs, pentlanditas (cm. PENTLANDITAS)[nikelio ir geležies sulfido sudėtis (Fe,Ni) 9 S 8 ], milleritas (cm. MILLERIT) NiS, garnierite (cm. GARNIERIT)(Ni, Mg) 6 Si 4 O 10 (OH) 2 ir kiti nikelio turintys silikatai. Jūros vandenyje nikelio yra maždaug 1,10 -8 -5,10 -8 %.
Kvitas
Didelė nikelio dalis gaunama iš sulfido vario-nikelio rūdų. Iš praturtintų žaliavų pirmiausia paruošiamas matinis - sulfidinė medžiaga, kurioje, be nikelio, yra ir geležies, kobalto, vario ir daugelio kitų metalų priemaišų. Flotacijos metodu (cm. FLOTACIJA) gaunamas nikelio koncentratas. Toliau matinis paprastai apdorojamas, kad būtų pašalintos geležies ir vario priemaišos, o po to deginamas ir susidaręs oksidas redukuojamas į metalą. Taip pat yra hidrometalurginių nikelio gamybos metodų, kai amoniako tirpalas naudojamas jam išgauti iš rūdos. (cm. AMONIAKAS) arba sieros rūgštis (cm. SIEROS RŪGŠTIES). Papildomam valymui neapdorotas nikelis yra apdorojamas elektrocheminiu būdu.
Fizinės ir cheminės savybės
Nikelis yra kalus ir kalus metalas. Jame yra į kubinį paviršių orientuota kristalinė gardelė (parametras a = 0,35238 nm). Lydymosi temperatūra 1455°C, virimo temperatūra apie 2900°C, tankis 8,90 kg/dm3. Nikelis yra feromagnetinis (cm. FERROMAGNETINIS), Curie taškas (cm. CURIE TAŠKAS) apie 358°C
Kompaktiškas nikelis yra stabilus ore, o labai dispersinis nikelis yra piroforinis (cm. PIROFORINIAI METALAI). Nikelio paviršius padengtas plona NiO oksido plėvele, kuri tvirtai apsaugo metalą nuo tolesnės oksidacijos. Nikelis taip pat nereaguoja su vandeniu ir vandens garais, esančiais ore. Nikelis praktiškai nesąveikauja su tokiomis rūgštimis kaip sieros, fosforo, vandenilio fluorido ir kai kurios kitos.
Nikelio metalas reaguoja su azoto rūgštimi, todėl susidaro nikelio(II) nitratas Ni(NO 3) 2 ir išsiskiria atitinkamas azoto oksidas, pvz.:
3Ni + 8HNO3 = 3Ni(NO3)2 + 2NO + 4H2O
Tik kaitinamas ore iki aukštesnės nei 800°C temperatūros, nikelio metalas pradeda reaguoti su deguonimi, sudarydamas oksidą NiO.
Nikelio oksidas turi pagrindinių savybių. Egzistuoja dvi polimorfinės modifikacijos: žemos temperatūros (šešiakampė gardelė) ir aukštos temperatūros (kubinė gardelė, stabili aukštesnėje nei 252°C temperatūroje). Yra pranešimų apie nikelio oksido fazių, kurių sudėtis NiO 1,33-2,0, sintezę.
Kaitinamas nikelis reaguoja su visais halogenais (cm. HALOGENAS) susidarant dihalogenidams NiHal 2. Kaitinant nikelio ir sieros miltelius, susidaro nikelio sulfidas NiS. Ir vandenyje tirpius nikelio dihalogenidus, ir vandenyje netirpusį nikelio sulfidą iš vandeninių tirpalų galima gauti ne tik „sausus“, bet ir „šlapius“.
Su grafitu nikelis sudaro karbidą Ni 3 C, su fosforu - Ni 5 P 2, Ni 2 P, Ni 3 P kompozicijų fosfidus. Nikelis taip pat reaguoja su kitais nemetalais, įskaitant (ypatingomis sąlygomis) su azotu. Įdomu tai, kad nikelis gali absorbuoti didelius vandenilio kiekius, todėl nikelyje susidaro kieti vandenilio tirpalai.
Yra žinomos tokios vandenyje tirpios nikelio druskos kaip NiSO 4 sulfatas, Ni(NO 3) 2 nitratas ir daugelis kitų. Dauguma šių druskų, kristalizuojantis iš vandeninių tirpalų, sudaro kristalinius hidratus, pavyzdžiui, NiSO 4 .7H 2 O, Ni(NO 3) 2 .6H 2 O. Netirpūs nikelio junginiai apima Ni 3 (PO 4) 2 fosfatą ir Ni 2 SiO silikatas 4 .
Kai į nikelio(II) druskos tirpalą įpilama šarmo, iškrenta žalios nikelio hidroksido nuosėdos:
Ni(NO 3) 2 + 2NaOH = Ni(OH) 2 + 2NaNO 3
Ni(OH)2 turi silpnai bazines savybes. Jei Ni(OH) 2 suspensija šarminėje terpėje yra veikiama stipriu oksidatoriumi, pavyzdžiui, bromu, atsiranda nikelio(III) hidroksidas:
2Ni(OH)2 + 2NaOH + Br2 = 2Ni(OH)3 + 2NaBr
Nikeliui būdingas kompleksų susidarymas. Taigi Ni 2+ katijonas su amoniaku sudaro heksaamino kompleksą 2+ ir diakvatetraamino kompleksą 2+. Šie kompleksai su anijonais sudaro mėlynus arba violetinius junginius.
Kai fluoras F2 veikia NiCl2 ir KCl mišinį, atsiranda sudėtingų junginių, kuriuose yra didelės oksidacijos būsenos nikelio: +3 – (K3) ir +4 – (K2).
Nikelio milteliai reaguoja su anglies monoksidu (II) CO ir susidaro lengvai lakus tetrakarbonilo Ni(CO) 4, kuris puikiai pritaikomas nikelio dangų dengimui, didelio grynumo dispersinio nikelio ruošimui ir kt.
Dėl būdingos Ni 2+ jonų reakcijos su dimetilglioksimu susidaro rausvai raudonas nikelio dimetilglioksimatas. Ši reakcija naudojama kiekybiniam nikelio nustatymui, o reakcijos produktas naudojamas kaip pigmentas kosmetinėse medžiagose ir kitais tikslais.
Taikymas
Didžioji dalis lydyto nikelio išleidžiama įvairių lydinių gamybai. Taigi, pridėjus nikelio į plieną, padidėja lydinio cheminis atsparumas, o visi nerūdijantys plienai būtinai turi nikelio. Be to, nikelio lydiniai pasižymi dideliu tvirtumu ir yra naudojami patvariems šarvams gaminti. Geležies ir nikelio lydinys, kuriame yra 36-38% nikelio, turi stebėtinai mažą šiluminio plėtimosi koeficientą (tai vadinamasis Invar lydinys), jis naudojamas įvairių prietaisų kritinių dalių gamyboje.
Gaminant elektromagnetines šerdis, plačiai naudojami lydiniai bendriniu pavadinimu permalloy. (cm. PERMALLOY). Šiuose lydiniuose, be geležies, yra nuo 40 iki 80% nikelio. Gerai žinomos įvairiuose šildytuvuose naudojamos nichromo spiralės, susidedančios iš chromo (10-30%) ir nikelio. Monetos kaldinamos iš nikelio lydinių. Bendras įvairių nikelio lydinių skaičius praktikoje siekia kelis tūkstančius.
Didelis nikelio dangų atsparumas korozijai leidžia naudoti plonus nikelio sluoksnius, siekiant apsaugoti įvairius metalus nuo korozijos nikeliavimu. Tuo pačiu metu nikeliavimas suteikia gaminiams gražią išvaizdą. Šiuo atveju elektrolizei naudojamas dvigubo amonio ir nikelio sulfato (NH 4) 2 Ni(SO 4) 2 vandeninis tirpalas.
Nikelis plačiai naudojamas įvairios cheminės įrangos gamyboje, laivų statyboje, elektrotechnikoje, šarminių baterijų gamyboje ir daugeliui kitų tikslų.
Specialiai paruoštas dispersinis nikelis (vadinamasis Raney nikelis) plačiai naudojamas kaip įvairių cheminių reakcijų katalizatorius. Nikelio oksidai naudojami feritinių medžiagų gamyboje ir kaip stiklo, glazūros ir keramikos pigmentai; oksidai ir kai kurios druskos yra įvairių procesų katalizatoriai.
Biologinis vaidmuo
Nikelis yra vienas iš mikroelementų (cm. MIKROELEMENTAI) būtini normaliam gyvų organizmų vystymuisi. Tačiau mažai žinoma apie jo vaidmenį gyvuose organizmuose. Yra žinoma, kad nikelis dalyvauja gyvūnų ir augalų fermentinėse reakcijose. Gyvūnams jis kaupiasi keratinizuotuose audiniuose, ypač plunksnose. Padidėjęs nikelio kiekis dirvožemyje sukelia endemines ligas – augaluose atsiranda negražių formų, o gyvūnams – akių ligos, susijusios su nikelio kaupimu ragenoje. Toksiška dozė (žiurkėms) - 50 mg. Ypač kenksmingi yra lakieji nikelio junginiai, ypač jo tetrakarbonilo Ni(CO) 4 . Didžiausia leistina nikelio junginių koncentracija ore svyruoja nuo 0,0002 iki 0,001 mg/m 3 (įvairiems junginiams).
enciklopedinis žodynas. 2009 .
Sinonimai:Pažiūrėkite, kas yra „nikelis“ kituose žodynuose:
NIKELIS- (simbolis Ni), metalas, kurio atominė masė yra 58,69, serijos numeris 28, kartu su kobaltu ir geležimi priklauso Mendelejevo periodinės sistemos VIII grupei ir 4 eilutei. Ud. V. 8,8, lydymosi temperatūra 1452°. Įprastuose jų ryšiuose N...... Didžioji medicinos enciklopedija
- (simbolis Ni), sidabriškai baltas metalas, PEREINAMASIS ELEMENTAS, atrastas 1751 m. Jo pagrindinės rūdos yra nikelio sulfido geležies rūdos (pentlanditas) ir nikelio arsenidas (nikelis). Nikelis turi sudėtingą valymo procesą, įskaitant diferencijuotą skilimą. Mokslinis ir techninis enciklopedinis žodynas
- (vokiškas nikelis). Metalas yra sidabriškai baltos spalvos ir nėra grynos formos. Pastaruoju metu jis buvo naudojamas stalo ir virtuvės reikmenims gaminti. Užsienio žodžių žodynas, įtrauktas į rusų kalbą. Chudinovas A.N., 1910. NIKELIS Vok. Nikelis... Rusų kalbos svetimžodžių žodynas
Nikelis- yra gana kietas pilkšvai baltas metalas, kurio lydymosi temperatūra yra 1453 laipsniai. C. Jis yra feromagnetinis, pasižymintis lankstumu, lankstumu, stiprumu ir atsparumu korozijai bei oksidacijai. Nikelis daugiausia yra... Oficiali terminija
Nikelio sąveika organizme
Pagrindinis nikelio šaltinis, patenkantis į žmogaus organizmą, yra maistas ir vanduo. Iš maisto pasisavinama iki 10% nikelio, iš vandens greičiau ir pilniau – medžiagos pasisavinimas padidėja iki 25%. Jau skrandyje esanti druskos rūgštis pradeda veikti nikelį, skatindama jo įsisavinimą į kraują, o likusi medžiaga absorbuojama plonojoje žarnoje. Toliau nikelis susijungia su kraujo plazmoje esančiais serumo baltymais (alfa1-glikoproteinu, nikeloplazminu ir kt.) ir krauju nunešamas į organus. Beveik visas likęs nikelis pasišalina per žarnyną su išmatomis, su šlapimu ir tulžimi pasišalina tik 5% nikelio likučio.
Nepaisant mažo nikelio cheminio aktyvumo, organizme vyksta gana aktyvios sąveikos reakcijos, į kurias naudinga atsižvelgti norint kontroliuoti šios medžiagos įsisavinimą. Esant vitaminui B12, nikelis skatina raumenų skaidulų susitraukimą ir augimą (o jei šio vitamino organizme mažai, nikelis, priešingai, mažina raumenų tonusą. Vitamino C buvimas blogina nikelio pasisavinimą. įtakojantis steroidinių hormonų pertekliaus pašalinimą, nikelis tariamai neleidžia susilaikyti natrio ir vandens, šalina edemą, taip pat sulaiko kalcį kauliniame audinyje, užkertant kelią osteoporozei.Jei organizme trūksta geležies, šio elemento vietą pakeičia nikelio molekulės Nikelio absorbcija didėja nėštumo ir žindymo laikotarpiu, o tai paaiškinama šio cheminio elemento poreikiu hormonų, atsakingų už nėštumą ir žindymą, sintezei.
Maisto produktuose ir bioaktyviuose papilduose esantis cinkas, selenas ir siera blogina nikelio pasisavinimą. Nikelis kartu su variu ir kobaltu dalyvauja raudonųjų kraujo kūnelių ir kitų kraujo elementų sintezėje.
Pagrindinės organizmo funkcijos

Žmogaus organizme nikelis daugiausia koncentruojasi hipofizėje, kasoje ir antinksčiuose – svarbiausiose endokrininės sistemos liaukose, gaminančiose endorfiną, augimo hormoną ir kitus hormonus, atliekančius šias funkcijas:
- yra atsakingi už vaiko gimdymą ir maitinimą;
- skatinti melanino – odos pigmento, saugančio ją nuo UV spindulių, – gamybą;
- suaktyvinti skydliaukę;
- pagerinti raumenų susitraukimą;
- padeda gaminti insuliną.
Nikelio vaidmuo endokrininės sistemos hormonų formavimo veikloje vis dar tiriamas, tačiau yra duomenų, kad nikelis ramina nervų sistemą, mažina adrenalino aktyvumą. Nikelio dėka inkstai padidina hormono eritropoetino, atsakingo už raudonųjų kraujo kūnelių, eritrocitų gamybą ir visų audinių aprūpinimą deguonimi, gamybą. Patvirtinta nikelio vaidmuo reguliuojant steroidinių hormonų pertekliaus antinksčių gaminamo šlapimo kaupimąsi ir išsiskyrimą. Dėl to sumažėja kraujospūdis, reguliuojamas gliukozės kiekis kraujyje, pagreitėja audinių regeneracija organizme.
Kitas nikelio kaupimo organas yra kepenys, o čia elementas dalyvauja organizmui būtinų aminorūgščių, kurios yra ląstelės DNR ir RNR struktūros dalis, stiprina imuninę sistemą, gerina organizmo funkcionavimą, sintezėje. širdį ir kraujagysles, kovoja su uždegimu ir pagreitina audinių atsigavimą po jo, kontroliuoja kūno svorį, užkerta kelią nekontroliuojamam ląstelių dalijimuisi.
Nikelis dalyvauja įvairių organizmo veiklai svarbių organinių junginių oksidacijos ir redukcijos reakcijose, būtinas tam tikrų fermentų gamybai, be kurių negali pasisavinti vitaminai, riebalai ir angliavandeniai.
Nikelio nauda organizmui
Nikelio nauda organizmui yra menkai suprantama, tačiau kadangi jis aktyviai veikia daugelį svarbiausių organų ir sistemų procesų, galima išskirti šias naudingas savybes:
- sumažina arterinės hipertenzijos pasireiškimą;
- reguliuoja riebalų ir angliavandenių apykaitą, turi įtakos svorio metimui;
- pašalina nervinį susijaudinimą;
- padidina hemoglobino kiekį kraujyje;
- pagerina insulino absorbciją;
- padidina imunitetą;
- stiprina širdies ir kraujagyslių sistemą.
Preparatai, kurių sudėtyje yra nikelio, aktyviai naudojami trichologijoje - šis elementas padidina kraujotaką plaukų folikulų srityje ir pagerina jų aprūpinimą deguonimi, o tai padeda sumažinti plaukų slinkimą.
Vaidmuo įvairių ligų atsiradime ir eigoje
Nikelio poveikis insulino aktyvacijai įrodytas. Jei sergant cukriniu diabetu ši medžiaga vartojama iš karto po insulino, vaisto hipoglikeminis aktyvumas žymiai sustiprėja, jį galima vartoti rečiau. Vyresnio amžiaus žmonėms nikelis pradeda kauptis plaučiuose ir, atsižvelgiant į tikėtiną šios medžiagos ryšį su hormonine organizmo veikla, mokslininkai siūlo nikelio įtaką su amžiumi susijusiam plaučių hormonų aktyvumui, o tai gali padidinti apraiškas. sergant bronchine astma.
Per didelis nikelio kaupimasis organizme provokuoja odos depigmentaciją – vitiligo. Nikelio poveikis histamino gamybai organizme pavertė šį metalą vienu žinomiausių alergenų: apie 15% žmonių pasaulyje yra alergiški nikelio junginiams, kurie naudojami papuošaluose, laikrodžiuose, tvirtinimo detalėse ir drabužių kniedėse. esant odos dirginimui ir niežėjimui.
Kokiuose maisto produktuose yra nikelio?

Ketvirtadalis nikelio, kuris kasdien patenka į mūsų organizmą, gaunamas iš vandens iš čiaupo. Ypač daug šio cheminio elemento vandenyje būna ryte, kai jis ilgą laiką stovėjo vamzdyne. Nikelio kiekio čempionai yra kakavos milteliai (980 mcg/100 g produkto svorio), juodasis šokoladas (260 mcg) ir pieniškas šokoladas (120 mcg). Tokio didelio nikelio kiekio šiuose gaminiuose priežastimis laikomas nikeliuotos įrangos ir indų naudojimas šokolado žaliavų laikymui ir perdirbimui.
Nikelis kai kuriuose maisto produktuose (µg 100 g)
| Grūdai | Ankštiniai augalai, riešutai | Mėsa žuvis | Daržovės vaisiai | ||||
| Kukurūzų kruopos | 80 | Anakardžiai | 510 | Jautienos kepenys | 63 | Špinatai | 390 |
| Grūdai | 50 | Sojos pupelės | 304 | Rūkyta skumbrė | 28 | Abrikosai | 32 |
| Ryžiai | 50 | Žaliasis žirnis | 250 | Šprotai aliejuje | 14 | Kriaušė | 18 |
| Kvieciai | 40 | Pupelės | 170 | Kiauliena | 12 | Vynuogė | 16 |
| Rugiai | 30 | Lęšiai | 160 | menkė | 9 | Baltasis kopūstas | 15 |
| perlinės kruopos | 20 | Pistacijos | 40 | Jautiena | 8 | Pomidorai | 13 |
Gydytojo patarimas. Tie, kurie laikosi augalinių baltymų dietos, savo valgiaraštyje turi racionaliai paskirstyti baltymų turinčius ankštinius augalus ir javus, kad neperdozuotų nikelio.
Nikeliui alergiški žmonės turėtų stengtis vengti maisto produktų, kuriuose yra daug nikelio.
Kaip išsaugoti nikelį maiste
Produktų, kuriuose yra daug nikelio (grūdų, ankštinių augalų), negalima laikyti atvirų tiesioginiuose saulės spinduliuose, nes metalas gali sudaryti įvairius oksidus, kurie gali kauptis organizme. Kita vertus, nikeliuotuose induose negalima laikyti maisto ilgiau nei dvi dienas – padidėja rizika, kad nikelis pateks į maistą ir per didelis mineralo kaupimasis organuose bei audiniuose.
Mineralinis virškinamumas
Alergiškieji taip pat turėtų atsiminti, kad gėrimuose su kofeinu ir aluje yra nikelio, kuris prastai įsisavinamas ir gali sustiprinti odos sudirgimus.
Nikelio pasisavinimas žymiai pablogėja, jei geriate arbatą, kavą, pieną, apelsinų sultis kartu su jo turinčiais produktais arba papildote savo maistą vaisių ir uogų desertais iš citrusinių vaisių, kivių, juodųjų serbentų ir kitų produktų, kuriuose yra daug askorbo. rūgšties.
Derinys su kitomis maistinėmis medžiagomis
Nikelis lengvai sąveikauja su baltymais ir organinėmis rūgštimis (citrinų, obuolių, acto ir kt.), padėdamas jiems pasisavinti. Svarbu derinti nikelį su maisto produktais, kuriuose yra daug riebalų ir angliavandenių. Be nikelio maistinėmis medžiagomis aprūpinami riebalai nesuskaidomi į lengvai pasisavinamas riebalų rūgštis ir glicerolį, neišsiskiria organizmui reikalinga energija iš angliavandenių.
Kasdieniai nikelio standartai

Biologinis nikelio vaidmuo žmogaus organizme dar nėra tiksliai nustatytas, todėl moksliškai pagrįstų šio metalo vartojimo standartų nėra, o jo poreikiai pagrindžiami daugiausiai stebėjimų pagrindu. Dienos nikelio norma žmonėms nustatoma nuo 100 iki 300 mcg. Su maistu ir vandeniu kasdien gauname apie 600 mcg nikelio, tačiau pasisaviname ne daugiau kaip ketvirtadalį gaunamo kiekio, todėl subalansuotai maitinantis šios medžiagos trūkumas ar perteklius – retas reiškinys.
Nikelio trūkumo priežastys ir pasekmės
Jei organizmas per dieną gauna mažiau nei 50 mcg nikelio, gali išsivystyti trūkumo būklė. Nikelio trūkumo priežastimi, be netinkamos mitybos (pavyzdžiui, dietos, paremtos tik vaisiais ar sultimis, grikiais ar kava), gali būti kai kurios skrandžio ir žarnyno ligos, pabloginančios nikelio pasisavinimą, sunki anemija, širdies liga. liga.
Gydytojo patarimas. Sergant lėtinio nuovargio sindromu, esant fiziniam ir psichiniam stresui, po infekcinių ligų organizmui reikia daugiau nikelio iš maisto.
Mitybą nikeliu būtina papildyti, pasitarus su gydytoju, sergant arterine hipertenzija, cukriniu diabetu, kai kuriomis dermatologinėmis ligomis. Nėščios ir žindančios moterys turėtų būti ypač atsargios, dirbdamos su nikeliu. Viena vertus, nikelis skatina nėštumą ir turi įtakos žindymui, kita vertus, jis yra toksiškas elementas, todėl bet kokie maisto papildai, vitaminų kompleksai ir net valgiaraščio keitimas nikelio turinčio maisto naudai turi būti aptartas su gydytoju.
Nikelio trūkumo požymiai yra raumenų silpnumas ir bendras vangumas bei noro judėti stoka. Sumažėja organizmo atsparumas virusams ir bakterijoms, dažnai vystosi infekcinės ligos, kurios yra ilgalaikės ir sunkios. Ilgai nesiimant priemonių, labai sumažės hemoglobino kiekis, padidės cukraus kiekis kraujyje, sutriks širdies veikla, vystysis kepenų patologijos, dermatozės.
Nikelio perteklius organizme
Per didelis nikelio kaupimasis organizme vyksta daug dažniau nei trūkumo sąlygos ir atsiranda dėl kelių priežasčių:
- nuolatinis nikeliuotų indų naudojimas ir maisto laikymas juose;
- valgyti daug maisto, kuriame gausu nikelio;
- padidėjęs nikelio kiekis daržovėse ir vaisiuose dėl jų auginimo šiuo elementu užterštose dirvose ir vandenyse;
- didelis nikelio kiekis vandentiekio vandenyje;
- piktnaudžiavimas konservais (jose yra daug nikelio iš skardinės metalo);
- nešioti papuošalus, laikrodžius iš nikelio lydinių;
- nekokybiški protezai ar breketai su iš jų išsiskiriančiu nikeliu;
- tabako dūmų, išmetamųjų dujų įkvėpimas;
- piktnaudžiavimas elektroninėmis cigaretėmis.
Nikelio perdozavimas gali būti gautas įkvėpus garų ar dulkių, kurių sudėtyje yra šio elemento junginių pramoninės gamybos sąlygomis arba dirbant su vaistais, nes nikelis gali kauptis organizme. Pavojingiausi yra nikelio sulfatas ir chloridas – šie junginiai ištirpsta vandenyje ir greitai pasisavinami.
Nikelio oksalatai, silikatai ir fosfatai netirpsta vandenyje, todėl yra mažiau toksiški.
Ūmus apsinuodijimas dėl nikelio pertekliaus gali pasireikšti, kai į organizmą patenka daugiau nei 50 mg medžiagos vienkartinė dozė. Tokiu atveju atsiranda skausmas dešinėje hipochondrijoje, dusulys, pykinimas ir galvos skausmas.
Svarbu! Didelis nikelio kiekis kraujyje laboratorinio tyrimo metu gali būti pirmasis besivystančio miokardo infarkto požymis
Lėtinis apsinuodijimas nikeliu pasireiškia:
- odos uždegimai – keratitas, kontaktinis dermatitas;
- opos ant akių ragenos;
- dažnas kraujavimas iš nosies;
- rinitas, kvėpavimo takų ligos;
- nervų sutrikimai, dirglumas ir susijaudinimas;
- širdies ritmo sutrikimai;
- virškinimo problemos.
Išsivysčiusiomis formomis nikelio perteklius kelia grėsmę smegenų ir plaučių edemai, riebioms kepenims, inkstų nepakankamumui ir plaučių bei skrandžio vėžio išsivystymui.
Pirmoji pagalba ūminiam apsinuodijimui nikeliu gali būti unitiolio (natrio ditiolpropansulfonato), kuris tvirtai suriša ir pašalina nikelį. Pagal indikacijas taikoma simptominė terapija, o maisto produktai, kurių sudėtyje yra nikelio, neįtraukiami į racioną.
Preparatai, kurių sudėtyje yra mineralų
Jei neįmanoma kompensuoti nikelio trūkumo iš dietos, gydytojas gali rekomenduoti maisto papildus ar vitaminų kompleksus, kurių sudėtyje yra nikelio (pavyzdžiui, Vitalgin, Vitrum). Paprastai vaisto tabletės ar kapsulės vartojamos vieną kartą per dieną valgio metu, tačiau vartojimo trukmę ir dozę turi pasirinkti gydytojas, nes nikelis yra toksiškas metalas, turintis nemalonų šalutinį poveikį.
Nikelio naudojimas lydiniuose
Nikelis yra daugumos karščiui atsparių medžiagų, naudojamų aviacijos ir kosmoso pramonėje jėgainių dalims, pagrindas.
- Monel metalas (65 - 67% Ni + 30 - 32% Cu + 1% Mn), atsparus karščiui iki 500 °C, labai atsparus korozijai;
- nichromas, atsparus lydinys (60% Ni + 40% Cr);
- permalloy (76% Ni + 17% Fe + 5% Cu + 2% Cr), pasižymi dideliu magnetiniu jautrumu ir labai mažais histerezės nuostoliais;
- invar (65% Fe + 35% Ni), kaitinant beveik nepailgėja.
- Be to, nikelio lydiniai apima nikelio ir chromo-nikelio plienus, nikelio sidabrą ir įvairius atsparumo lydinius, tokius kaip konstantanas, nikelis ir manganinas.
Visi nerūdijantys plienai būtinai turi nikelio, nes... Nikelis padidina lydinio cheminį atsparumą. Nikelio lydiniai taip pat pasižymi dideliu tvirtumu ir naudojami patvariems šarvams gaminti. Įvairių prietaisų svarbiausių dalių gamyboje naudojamas nikelio-geležies lydinys (36-38% nikelio), kuris turi mažą šiluminio plėtimosi koeficientą.
Gaminant elektromagnetines šerdis, plačiai naudojami lydiniai bendriniu pavadinimu permalloy. Šiuose lydiniuose, be geležies, yra nuo 40 iki 80% nikelio. Monetos kaldinamos iš nikelio lydinių. Bendras įvairių nikelio lydinių skaičius praktikoje siekia kelis tūkstančius.
Metalų dengimas nikeliuNikelis gryna forma daugiausia naudojamas kaip apsauginė danga nuo korozijos įvairiose cheminėse aplinkose. Geležies ir kitų metalų apsauginės dangos gaunamos dviem gerai žinomais būdais: apvalkalu ir galvanizavimu. Pirmuoju būdu plakiruotas sluoksnis sukuriamas karštai valcuojant ploną nikelio plokštę su storu geležies lakštu. Nikelio ir dengiamo metalo storio santykis yra maždaug 1:10. Siūlių valcavimo procese dėl abipusės difuzijos šie lakštai suvirinami ir gaunamas monolitinis dvisluoksnis ar net trisluoksnis metalas, kurio nikelio paviršius apsaugo šią medžiagą nuo korozijos.
Šis karštas apsauginių nikelio dangų kūrimo būdas yra plačiai naudojamas geležies ir nelegiruoto plieno apsaugai nuo korozijos. Tai žymiai sumažina daugelio gaminių ir prietaisų, pagamintų ne iš gryno nikelio, o iš palyginti pigios geležies ar plieno, bet padengtų plonu apsauginiu nikelio sluoksniu, savikainą. Didelės talpyklos gaminamos iš nikeliuotų geležies lakštų, skirtų transportuoti ir laikyti, pavyzdžiui, šarminius šarmus, kurie taip pat naudojami įvairiose chemijos pramonės šakose.
Galvanizacijos metodas, skirtas apsauginėms dangoms su nikeliu sukurti, yra vienas iš seniausių elektrocheminių procesų metodų. Ši operacija, technologijoje plačiai žinoma kaip nikeliavimas, iš esmės yra gana paprastas technologinis procesas. Tai apima tam tikrą parengiamąjį darbą, kai labai kruopščiai nuvalomas padengto metalo paviršius ir paruošiama elektrolitinė vonia, susidedanti iš parūgštinto nikelio druskos, dažniausiai nikelio sulfato, tirpalo. Dengiant elektrolitiniu būdu, dengiama medžiaga yra katodas, o nikelio plokštė – anodas. Galvaninėje grandinėje nikelis nusėda ant katodo lygiaverčiu perėjimu nuo anodo iki tirpalo. Nikeliavimo metodas plačiai naudojamas inžinerijoje ir šiam tikslui sunaudojama daug nikelio.
Pastaruoju metu elektrolitinio nikeliavimo metodas buvo naudojamas apsauginėms aliuminio, magnio, cinko ir ketaus dangoms sukurti. Straipsnyje aprašomas nikeliavimo metodas aliuminio ir magnio lydiniams, ypač sraigtu varomų orlaivių duraliuminio menčių apsaugai. Kitame straipsnyje aprašomas nikeliuotų ketaus džiovinimo būgnų naudojimas popieriaus gamyboje; Nustatyta, kad žymiai padidėjo būgnų atsparumas korozijai ir pagerėjo popieriaus kokybė ant nikeliuotų būgnų, palyginti su įprastais ketaus būgnais be nikeliavimo.
Nikeliavimas atliekamas galvanizuojant naudojant elektrolitus, kurių sudėtyje yra nikelio (II) sulfato, natrio chlorido, boro hidroksido, aktyviųjų paviršiaus medžiagų ir baliklių bei tirpių nikelio anodų. Susidariusio nikelio sluoksnio storis yra 12 - 36 mikronai. Stabilų paviršiaus blizgesį galima užtikrinti vėliau chromuojant (chromo sluoksnio storis 0,3 mikrono).
Be srovės nikeliavimas atliekamas nikelio(II) chlorido ir natrio hipofosfito mišinio tirpale, esant natrio citratui:
NiCl 2 + NaH 2 PO 2 + H 2 O = Ni + NaH 2 PO 3 + 2HCl
Procesas atliekamas esant pH 4 - 6 ir 95 °C temperatūrai.
Nikelio naudojimas baterijų gamybojeGeležies-nikelio, nikelio-kadmio, nikelio-cinko, nikelio-vandenilio baterijų gamyba.
Dažniausi cheminių srovės šaltinių „trūkumai“ yra cinkas, kadmis, geležis, o labiausiai paplitę „už“ yra sidabro, švino, mangano ir nikelio oksidai. Nikelio junginiai naudojami šarminių baterijų gamyboje. Beje, geležies-nikelio bateriją 1900 metais išrado Thomas Alva Edison.
Teigiami elektrodai nikelio oksidų pagrindu turi gana didelį teigiamą krūvį, jie yra stabilūs elektrolite, yra lengvai apdorojami, yra palyginti nebrangūs, tarnauja ilgai ir nereikalauja ypatingos priežiūros. Dėl šio savybių rinkinio nikelio elektrodai tapo labiausiai paplitę. Kai kurios baterijos, ypač cinko-sidabro baterijos, pasižymi geresnėmis specifinėmis savybėmis nei geležies-nikelio arba nikelio-kadmio baterijos. Tačiau nikelis yra daug pigesnis nei sidabras, o brangios baterijos tarnauja daug mažiau.
Šarminių baterijų nikelio oksido elektrodai yra pagaminti iš pastos, kurioje yra nikelio oksido hidrato ir grafito miltelių. Kartais vietoj grafito laidžiojo priedo funkcijas atlieka ploni nikelio žiedlapiai, tolygiai paskirstyti nikelio hidrokside. Ši aktyvi masė supakuota į įvairios konstrukcijos laidžias plokštes.
Pastaraisiais metais plačiai paplito kitas nikelio elektrodų gamybos būdas. Plokštės presuojamos iš labai smulkių nikelio oksidų miltelių su reikalingais priedais. Antrasis gamybos etapas – masės sukepinimas vandenilio atmosferoje. Šiuo metodu gaunami porėti elektrodai su labai išvystytu paviršiumi, ir kuo didesnis paviršius, tuo didesnė srovė. Šiuo būdu pagamintos baterijos su elektrodais yra galingesnės, patikimesnės, lengvesnės, bet ir brangesnės. Todėl jie naudojami svarbiausiuose objektuose – radioelektroninėse grandinėse, srovės šaltiniuose erdvėlaiviuose ir kt.
Nikelio elektrodai, pagaminti iš geriausių miltelių, taip pat naudojami kuro elementuose. Čia ypatingą reikšmę įgyja katalizinės nikelio ir jo junginių savybės. Nikelis yra puikus katalizatorius sudėtingiems procesams, vykstantiems šiuose dabartiniuose šaltiniuose. Beje, kuro elementuose iš nikelio ir jo junginių galima padaryti ir „pliusą“, ir „minusą“. Vienintelis skirtumas yra prieduose.
Nikelis radiacinėse technologijoseNuklido 63 Ni, išskiriančio β+ daleles, pusinės eliminacijos laikas yra 100,1 metų, jis naudojamas kritronuose. Neseniai mechaniniuose neutronų pluošto pertraukikliuose vietoj kadmio plokščių buvo naudojamos nikelio plokštės, siekiant gauti didelės energijos vertės neutronų impulsus.
Nikelio naudojimas medicinoje- Naudojamas kronšteinų sistemų gamyboje.
- Protezavimas
Raudonų nuosėdų susidarymas, kai į analizuojamo mišinio amoniako tirpalą pridedama dimetilglioksimo, yra geriausia reakcija kokybiniam ir kiekybiniam nikelio nustatymui. Tačiau nikelio dimetilglioksimatas reikalingas ne tik analitikams. Graži gili šio sudėtingo junginio spalva patraukė parfumerių dėmesį: nikelio dimetilglioksimatas įtrauktas į lūpų dažų sudėtį. Kai kurie junginiai, tokie kaip nikelio dimetilglioksimatas, yra labai šviesai atsparių dažų pagrindas.
Kiti nikelio panaudojimo būdaiYra įdomių nuorodų apie nikelio plokščių naudojimą ultragarso įrenginiuose, tiek elektriniuose, tiek mechaniniuose, taip pat šiuolaikiniuose telefonų aparatų konstrukcijoje.
Kai kuriose technologijos srityse grynas nikelis naudojamas arba tiesiogiai miltelių pavidalu, arba įvairių produktų, gaunamų iš gryno nikelio miltelių, pavidalu.
Viena iš miltelių pavidalo nikelio panaudojimo sričių yra kataliziniai procesai nesočiųjų angliavandenilių, ciklinių aldehidų, alkoholių ir aromatinių angliavandenilių hidrinimo reakcijose.
Nikelio katalizinės savybės yra panašios į platinos ir paladžio. Taigi čia atsispindi tos pačios periodinės lentelės grupės elementų cheminė analogija. Nikelis, kaip metalas, pigesnis už paladį ir platiną, plačiai naudojamas kaip katalizatorius hidrinimo procesuose.
Šiems tikslams patartina naudoti labai smulkių miltelių pavidalo nikelį. Jis gaunamas specialiu nikelio oksido redukcijos vandeniliu režimu 300-350° temperatūros diapazone.
 Lydymosi temperatūra ni
Lydymosi temperatūra ni Kuo meteoritas skiriasi nuo meteorito?
Kuo meteoritas skiriasi nuo meteorito? Rostovas: „Pinigų nėra - bent jau paskandink!
Rostovas: „Pinigų nėra - bent jau paskandink!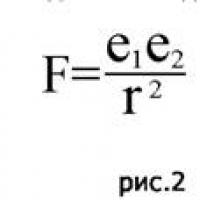 Ar egzistuoja antigravitacija?
Ar egzistuoja antigravitacija? Kvantinis susipainiojimas paprastais žodžiais
Kvantinis susipainiojimas paprastais žodžiais Judantys mirties slėnio akmenys Paslaptingi judantys akmenys
Judantys mirties slėnio akmenys Paslaptingi judantys akmenys Kokia Lel yra Snieguolė pasakoje?
Kokia Lel yra Snieguolė pasakoje?