§12. Karboksilne kiseline. Karboksilne kiseline: fizikalna svojstva. Soli karboksilnih kiselina Najjednostavnija karboksilna kiselina je mravlja
DEFINICIJA
Nazivaju se organske tvari čije molekule sadrže jednu ili više karboksilnih skupina povezanih s ugljikovodičnim radikalom karboksilne kiseline.
Prva tri člana homolognog niza karboksilnih kiselina, uključujući propionsku kiselinu, su tekućine koje imaju oštar miris i vrlo su topive u vodi. Sljedeći homolozi, počevši od maslačne kiseline, također su tekućine koje imaju jak neugodan miris, ali su slabo topljive u vodi. Više kiseline, s brojem ugljikovih atoma 10 ili više, su krute, bez mirisa, netopljive u vodi. Općenito, u nizu homologa, s povećanjem molekularne težine, topljivost u vodi se smanjuje, gustoća se smanjuje, a vrelište se povećava (Tablica 1).
Tablica 1. Homologne serije karboksilnih kiselina.
Dobivanje karboksilnih kiselina
Karboksilne kiseline se dobivaju oksidacijom zasićenih ugljikovodika, alkohola i aldehida. Na primjer, octena kiselina - oksidacijom etanola s otopinom kalijevog permanganata u kiselom okruženju kada se zagrijava:
Kemijska svojstva karboksilnih kiselina
Kemijska svojstva karboksilnih kiselina određena su prvenstveno osobitostima njihove strukture. Dakle, kiseline topljive u vodi mogu disocirati na ione:
R-COOH↔R-COO - + H + .
Zbog prisutnosti H + iona u vodi, imaju kiseli okus, mogu promijeniti boju indikatora i provoditi električnu struju. U vodenoj otopini ove kiseline su slabi elektroliti.
Karboksilne kiseline imaju kemijska svojstva karakteristična za otopine anorganskih kiselina, tj. međusobno djeluju s metalima (1), njihovim oksidima (2), hidroksidima (3) i slabim solima (4):
2CH3-COOh + Zn → (CH3COO) 2Zn + H2 (1);
2CH3-COOH + CuO→ (CH3COO) 2Cu + H2O (2);
R-COOH + KOH → R-COOK + H 2 O (3);
2CH 3 -COOH + NaHCO 3 → CH 3 COONa + H 2 O + CO 2 (4).
Posebno svojstvo zasićenih i nezasićenih karboksilnih kiselina, koje se očituje funkcionalnom skupinom, je interakcija s alkoholima.
Karboksilne kiseline reagiraju s alkoholima pri zagrijavanju iu prisutnosti koncentrirane sumporne kiseline. Na primjer, ako se octenoj kiselini doda etilni alkohol i malo sumporne kiseline, tada se pri zagrijavanju pojavljuje miris etil octene kiseline (etil acetat):
CH3-COOH + C2H5OH ↔CH3-C(O)-O-C2H5 + H2O.
Specifično svojstvo zasićenih karboksilnih kiselina, koje se očituje radikalom, je reakcija halogeniranja (kloriranja).

Primjena karboksilnih kiselina
Karboksilne kiseline služe kao sirovina za proizvodnju ketona, kiselih halogenida, vinil estera i drugih važnih klasa organskih spojeva.
Mravlja kiselina ima široku primjenu za dobivanje estera koji se koriste u parfumeriji, u industriji kože (štavljenje kože), u tekstilnoj industriji (kao sredstvo za bojenje), kao otapalo i konzervans.
Vodena otopina (70-80%) octene kiseline naziva se octena esencija, a 3-9% vodena otopina naziva se stolni ocat. Esencija se često koristi za dobivanje octa kod kuće razrjeđivanjem.
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | Koje se kemijske reakcije mogu koristiti za izvođenje sljedećih transformacija: a) CH 4 → CH 3 Cl → CH 3 OH → HCHO → HCOOH → HCOOK. Napišite jednadžbe reakcija i navedite uvjete za njihovo odvijanje. |
| Odgovor | a) Kloriranje metana na svjetlu dovodi do proizvodnje klorometana: CH 4 + Cl 2 → CH 3 Cl + HCl. Halogeni derivati alkana podliježu hidrolizi u vodenom ili alkalnom mediju da bi se formirali alkoholi: CH 3 Cl + NaOH → CH 3 OH + NaCl. Kao rezultat oksidacije primarnih alkohola, na primjer, s kalijevim dikromatom u kiseloj sredini u prisutnosti katalizatora (Cu, CuO, Pt, Ag), nastaju aldehidi: CH 3 OH+ [O] →HCHO. Aldehidi se lako oksidiraju u odgovarajuće karboksilne kiseline, na primjer, s kalijevim permanganatom: HCHO + [O] → HCOOH. Karboksilne kiseline pokazuju sva svojstva svojstvena slabim mineralnim kiselinama, tj. sposobni djelovati s aktivnim metalima u obliku soli: 2HCOOH+ 2K→2HCOOK + H 2 . |
PRIMJER 2
| Vježbajte | Napišite jednadžbe reakcija između sljedećih tvari: a) 2-metilpropanske kiseline i klora; b) octena kiselina i propanol-2; c) akrilna kiselina i bromna voda; d) 2-metilbutanska kiselina i fosfor (V) klorid. Navedite uvjete reakcije. |
| Odgovor | a) kao rezultat reakcije između 2-metilpropanske kiseline i klora, atom vodika je zamijenjen u radikalu ugljikovodika koji se nalazi u a-položaju; Nastaje 2-metil-2-kloropropanoična kiselina H 3 C-C(CH 3)H-COOH + Cl 2 → H 3 C-C(CH 3)Cl-COOH + HCl (kat = P). b) kao rezultat reakcije octene kiseline i propanola-2 nastaje ester – izopropil ester octene kiseline. CH 3 -COOH + CH 3 -C(OH)H-CH 3 → CH 3 -C(O)-O-C(CH 3)-CH 3 . c) kao rezultat reakcije interakcije između akrilne kiseline i bromne vode, dodavanje halogena na mjesto dvostruke veze u skladu s Markovnikovljevim pravilom; Nastaje 2,3-dibrompropanoična kiselina CH 2 =CH-COOH + Br 2 → CH 2 Br-CHBr-COOH d) kao rezultat reakcije između 2-metilbutanske kiseline i fosfor (V) klorida nastaje odgovarajući kiseli klorid CH 3 -CH 2 -C(CH 3)H-COOH + PCl 5 →CH 3 -CH 2 -C(CH 3)H-COOCl + POCl 3 + HCl. |
Karboksilne kiseline- organske tvari čije molekule sadrže jednu ili više karboksilnih skupina.
Karboksilna skupina (skraćeno COOH) je funkcionalna skupina karboksilnih kiselina i sastoji se od karbonilne skupine i pridružene hidroksilne skupine.
Prema broju karboksilnih skupina karboksilne kiseline dijelimo na jednobazične, dvobazične itd.
Opća formula jednobazičnih karboksilnih kiselina je R—COOH. Primjer dibazične kiseline je oksalna kiselina HOOC—COOH.
Na temelju vrste radikala karboksilne kiseline se dijele na zasićene (npr. octena kiselina CH 3 COOH), nezasićene [npr. akrilna kiselina CH 2 =CH—COOH, oleinska kiselina CH 3 —(CH 2) 7 —CH =CH-(CH2)7-COOH] i aromatski (na primjer, benzojev C6H5-COOH).
Izomeri i homolozi
Jednobazične zasićene karboksilne kiseline R-COOH su izomeri estera (skraćeno R"-COOR") s istim brojem ugljikovih atoma. Opća formula za obje je C n H 2 n O2.
| G | HCOOH metan (mrav) |
||||
| CH3COOH etan (octena) | HCOOCH 3 metil ester mravlje kiseline |
||||
| CH3CH2COOH propan (propionski) |
HCOOCH 2 CH 3 etil mravlje kiseline |
CH 3 COOCH 3 metil ester octene kiseline | |||
| CH3(CH2)2COOH butan (ulje) |
2-metilpropan |
HCOOCH 2 CH 2 CH 3 propil ester mravlje kiseline |
CH 3 COOCH 2 CH 3 etil acetat |
CH 3 CH 2 COOCH 3 metil ester propionske kiseline |
|
| izomeri | |||||
Algoritam za sastavljanje naziva karboksilnih kiselina
- Pronađite ugljikovu okosnicu - ovo je najduži lanac ugljikovih atoma, uključujući ugljikov atom karboksilne skupine.
- Numerirajte ugljikove atome u glavnom lancu, počevši od karboksilnog ugljikovog atoma.
- Imenujte spoj koristeći algoritam za ugljikovodike.
- Na kraju imena dodajte sufiks "-ov", završetak "-aya" i riječ "kiselina".
U molekulama karboksilnih kiselina str-elektroni atoma kisika hidroksilne skupine stupaju u interakciju s elektronima -veze karbonilne skupine, uslijed čega se povećava polaritet O-H veze, jača -veza u karbonilnoj skupini, parcijalni naboj (+) na atomu ugljika se smanjuje, a parcijalni naboj (+) na atomu vodika raste .
Potonji potiče stvaranje jakih vodikovih veza između molekula karboksilne kiseline.
Fizička svojstva zasićenih monobazičnih karboksilnih kiselina uvelike su posljedica prisutnosti jakih vodikovih veza između molekula (jačih nego između molekula alkohola). Stoga su vrelišta i topljivost kiselina u vodi viši od onih odgovarajućih alkohola.
Kemijska svojstva kiselina
Jačanje -veze u karbonilnoj skupini dovodi do činjenice da su reakcije adicije nekarakteristične za karboksilne kiseline.
- Izgaranje:
CH3COOH + 2O22CO2 + 2H2O
- Kisela svojstva.
Zbog velike polarnosti O-H veze, karboksilne kiseline u vodenoj otopini zamjetno disociraju (točnije, reverzibilno s njom reagiraju):HCOOH HCOO - + H + (točnije HCOOH + H 2 O HCOO - + H 3 O +)
Sve karboksilne kiseline su slabi elektroliti. Povećanjem broja ugljikovih atoma jakost kiselina opada (zbog smanjenja polariteta O-H veze); naprotiv, uvođenje atoma halogena u ugljikovodični radikal dovodi do povećanja jakosti kiseline. Da, u nizuHCOOH CH 3 COOH C 2 H 5 COOH
jakost kiselina opada, a u nizuPovećavajući se.
Karboksilne kiseline pokazuju sva svojstva svojstvena slabim kiselinama:
Mg + 2CH3COOH (CH3COO) 2 Mg + H2
CaO + 2CH 3 COOH (CH 3 COO) 2 Ca + H 2 O
NaOH + CH3COOH CH3COONa + H2O
K 2 CO 3 + 2CH 3 COOH 2CH 3 KUHANJE + H 2 O + CO 2 - Esterifikacija (reakcija karboksilnih kiselina s alkoholima koja dovodi do stvaranja estera):
Polihidrični alkoholi, poput glicerola, također mogu ući u reakciju esterifikacije. Esteri nastali od glicerola i viših karboksilnih kiselina (masnih kiselina) su masti.Masti su mješavine triglicerida. Zasićene masne kiseline (palmitinska C 15 H 31 COOH, stearinska C 17 H 35 COOH) tvore čvrste masti životinjskog porijekla, a nezasićene masne kiseline (oleinska C 17 H 33 COOH, linolna C 17 H 31 COOH i dr.) tvore tekuće masti. (ulja) biljnog podrijetla.
- Supstitucija u ugljikovodičnom radikalu:
Zamjena se događa u - poziciji.Osobitost mravlje kiseline HCOOH je da je ova tvar bifunkcionalni spoj; to je i karboksilna kiselina i aldehid:
Dakle, mravlja kiselina, između ostalog, reagira s amonijačnom otopinom srebrovog oksida (reakcija srebrnog zrcala; kvalitativna reakcija):HCOOH + Ag 2 O (otopina amonijaka) CO 2 + H 2 O + 2Ag
Dobivanje karboksilnih kiselina
.
O
//
Skupina -C atoma naziva se karboksilna skupina ili karboksil.
\
OH
Organske kiseline koje sadrže jednu karboksilnu skupinu u molekuli su jednobazične. Opća formula ovih kiselina je RCOOH.
Karboksilne kiseline koje sadrže dvije karboksilne skupine nazivaju se dibazične. To uključuje, na primjer, oksalnu i jantarnu kiselinu.
Postoje i polibazične karboksilne kiseline koje sadrže više od dvije karboksilne skupine. To uključuje, na primjer, trobazičnu limunsku kiselinu. Ovisno o prirodi ugljikovodičnog radikala, karboksilne kiseline se dijele na zasićene, nezasićene i aromatske.
Zasićene, odnosno zasićene, karboksilne kiseline su npr. propanska (propionska) kiselina ili već poznata sukcinatna kiselina.
Očito, zasićene karboksilne kiseline ne sadrže P-veze u ugljikovodičnom radikalu.
U molekulama nezasićenih karboksilnih kiselina, karboksilna skupina je povezana s nezasićenim, nezasićenim radikalom ugljikovodika, na primjer u molekulama akrilne (propenske) CH2=CH-COOH ili oleinske CH3-(CH2)7-CH=CH-(CH2) 7-COOH i druge kiseline.
Kao što se može vidjeti iz formule benzojeve kiseline, ona je aromatična, jer sadrži aromatski (benzenski) prsten u molekuli.
Nomenklatura i izomerija
Već smo razmotrili opće principe formiranja naziva karboksilnih kiselina, kao i drugih organskih spojeva. Zadržimo se detaljnije na nomenklaturi mono- i dibazičnih karboksilnih kiselina. Naziv karboksilne kiseline tvori se od naziva odgovarajućeg alkana (alkana s istim brojem atoma ugljika u molekuli) uz dodatak sufiksa -ov, završetka -aya i riječi kiselina. Obrojčavanje ugljikovih atoma počinje karboksilnom skupinom. Na primjer:
Mnoge kiseline također imaju povijesno utvrđena ili trivijalna imena (Tablica 6). 
Nakon prvog upoznavanja s raznolikim i zanimljivim svijetom organskih kiselina, detaljnije ćemo razmotriti zasićene jednobazične karboksilne kiseline.
Jasno je da će se sastav ovih kiselina odražavati općom formulom C n H 2n O2, ili C n H 2n +1 COOH, ili RCOOH.
Fizikalna svojstva zasićenih jednobazičnih karboksilnih kiselina
Niže kiseline, tj. kiseline relativno male molekulske mase koje sadrže do četiri ugljikova atoma po molekuli, tekućine su karakterističnog oštrog mirisa (sjetimo se mirisa octene kiseline). Kiseline koje sadrže od 4 do 9 atoma ugljika su viskozne uljaste tekućine neugodnog mirisa; koji sadrže više od 9 atoma ugljika po molekuli – krutine koje se ne otapaju u vodi. Vrelišta zasićenih monobazičnih karboksilnih kiselina rastu s povećanjem broja atoma ugljika u molekuli i, posljedično, s povećanjem relativne molekularne težine. Na primjer, vrelište mravlje kiseline je 101 °C, octene kiseline je 118 °C, a propionske kiseline je 141 °C.
Najjednostavnija karboksilna kiselina, mravlja HCOOH, male relativne molekulske mase (46), u normalnim je uvjetima tekućina s vrelištem od 100,8 °C. Istovremeno, butan (MR(C4H10) = 58) pod istim uvjetima je plinovit i ima vrelište od -0,5 °C. Ova razlika između vrelišta i relativne molekularne težine objašnjava se stvaranjem dimera karboksilne kiseline, u kojima su dvije molekule kiseline povezane dvjema vodikovim vezama. Pojava vodikovih veza postaje jasna kada se uzme u obzir struktura molekula karboksilne kiseline.
Molekule zasićenih jednobazičnih karboksilnih kiselina sadrže polarnu skupinu atoma - karboksil (razmislite što uzrokuje polaritet ove funkcionalne skupine) i praktički nepolarni ugljikovodični radikal. Karboksilnu skupinu privlače molekule vode, stvarajući s njima vodikove veze.
Mravlja i octena kiselina neograničeno su topljive u vodi. Očito je da se s povećanjem broja atoma u radikalu ugljikovodika smanjuje topljivost karboksilnih kiselina.
Poznavajući sastav i strukturu molekula karboksilne kiseline, neće nam biti teško razumjeti i objasniti kemijska svojstva tih tvari.
Kemijska svojstva
Opća svojstva karakteristična za klasu kiselina (i organskih i anorganskih) posljedica su prisutnosti hidroksilne skupine u molekulama koja sadrži visoko polarnu vezu između atoma vodika i kisika. Ova svojstva su vam dobro poznata. Razmotrimo ih ponovno na primjeru organskih kiselina topivih u vodi.
1. Disocijacija uz stvaranje vodikovih kationa i aniona kiselinskog ostatka. Točnije, ovaj proces opisuje jednadžba koja uzima u obzir sudjelovanje molekula vode u njemu.
Ravnoteža disocijacije karboksilnih kiselina pomaknuta je ulijevo; velika većina njih su slabi elektroliti. Ipak, kiseli okus, na primjer, mravlje i octene kiseline objašnjava se disocijacijom na vodikove katione i anione kiselih ostataka.
Očito je da prisutnost "kiselog" vodika u molekulama karboksilnih kiselina, odnosno vodika karboksilne skupine, određuje i druga karakteristična svojstva.
2. Interakcija s metalima u elektrokemijskom području napona do vodika. Dakle, željezo reducira vodik iz octene kiseline:
2CH3-COOH + Fe -> (CHgCOO)2Fe + H2
3. Interakcija s bazičnim oksidima pri čemu nastaju sol i voda:
2R-COOH + CaO -> (R-COO)2Ca + H20
4. Reakcija s metalnim hidroksidima pri čemu nastaju sol i voda (reakcija neutralizacije):
R-COOH + NaOH -> R-COONa + H20 3R-COOH + Ca(OH)2 -> (R-COO)2Ca + 2H20
5. Interakcija sa solima slabijih kiselina, uz nastanak potonjih. Tako octena kiselina istiskuje stearinsku kiselinu iz natrijevog stearata i ugljičnu kiselinu iz kalijevog karbonata.
6. Međudjelovanje karboksilnih kiselina s alkoholima pri čemu nastaju esteri je vama već poznata reakcija esterifikacije (jedna od najvažnijih reakcija karakterističnih za karboksilne kiseline). Interakciju karboksilnih kiselina s alkoholima kataliziraju vodikovi kationi.
Reakcija esterifikacije je reverzibilna. Ravnoteža se pomiče prema stvaranju estera u prisutnosti sredstava za uklanjanje vode i uklanjanja estera iz reakcijske smjese.
U obrnutoj reakciji esterifikacije, koja se naziva hidroliza estera (reakcija estera s vodom), nastaju kiselina i alkohol. Očito je da polihidrični alkoholi, na primjer glicerol, također mogu reagirati s karboksilnim kiselinama, tj. ući u reakciju esterifikacije: 
Sve karboksilne kiseline (osim mravlje kiseline), uz karboksilnu skupinu, sadrže ugljikovodični ostatak u svojim molekulama. Naravno, to ne može utjecati na svojstva kiselina, koja su određena prirodom ostatka ugljikovodika.
7. Reakcije adicije na višestrukoj vezi – u njih ulaze nezasićene karboksilne kiseline; na primjer, reakcija adicije vodika je hidrogenacija. Kada se oleinska kiselina hidrogenira, nastaje zasićena stearinska kiselina.
Nezasićene karboksilne kiseline, kao i drugi nezasićeni spojevi, dodaju halogene putem dvostruke veze. Na primjer, akrilna kiselina obezboji bromnu vodu.
8. Reakcije supstitucije (s halogenima) - u njega mogu ući zasićene karboksilne kiseline; na primjer, reakcijom octene kiseline s klorom mogu se dobiti različite klorirane kiseline:

Kod halogeniranja karboksilnih kiselina koje sadrže više od jednog ugljikovog atoma u ugljikovodikovom ostatku, moguće je stvaranje produkata s različitim položajem halogena u molekuli. Kada se reakcija odvija putem mehanizma slobodnih radikala, svi atomi vodika u ostatku ugljikovodika mogu se zamijeniti. Ako se reakcija odvija u prisutnosti malih količina crvenog fosfora, tada se odvija selektivno - vodik se zamjenjuje samo u A-položaj (na ugljikovom atomu najbližem funkcionalnoj skupini) u molekuli kiseline. O razlozima te selektivnosti saznat ćete tijekom studija kemije na visokoškolskoj ustanovi.
Karboksilne kiseline tvore različite funkcionalne derivate pri zamjeni hidroksilne skupine. Kad se ti derivati hidroliziraju, ponovno nastaje karboksilna kiselina.
Klorid karboksilne kiseline može se pripraviti reakcijom fosfor(III) klorida ili tionil klorida (SOCl 2) s kiselinom. Anhidridi karboksilnih kiselina dobivaju se reakcijom anhidrida klora sa solima karboksilnih kiselina. Esteri nastaju esterifikacijom karboksilnih kiselina s alkoholima. Esterifikacija je katalizirana anorganskim kiselinama.
Ova reakcija započinje protoniranjem karboksilne skupine – interakcijom vodikovog kationa (protona) s usamljenim elektronskim parom atoma kisika. Protoniranje karboksilne skupine povlači za sobom povećanje pozitivnog naboja na ugljikovom atomu u njoj:

Metode dobivanja
Karboksilne kiseline mogu se dobiti oksidacijom primarnih alkohola i aldehida.
Aromatske karboksilne kiseline nastaju oksidacijom homologa benzena.
Hidrolizom raznih derivata karboksilnih kiselina također nastaju kiseline. Dakle, hidrolizom estera nastaju alkohol i karboksilna kiselina. Kao što je gore spomenuto, reakcije esterifikacije i hidrolize katalizirane kiselinom su reverzibilne. Hidroliza estera pod utjecajem vodene otopine lužine nastavlja se nepovratno, u ovom slučaju iz estera ne nastaje kiselina, već njezina sol. Tijekom hidrolize nitrila prvo nastaju amidi koji se zatim pretvaraju u kiseline. Karboksilne kiseline nastaju interakcijom organskih magnezijevih spojeva s ugljikovim monoksidom (IV).
Pojedini predstavnici karboksilnih kiselina i njihov značaj
Mravlja (metanska) kiselina HCOOH je tekućina oštrog mirisa i vrelišta 100,8 °C, vrlo topiva u vodi. Mravlja kiselina je otrovna i u dodiru s kožom izaziva opekline! Tekućina od žara koju luče mravi sadrži ovu kiselinu. Mravlja kiselina ima dezinfekcijska svojstva i stoga nalazi svoju primjenu u prehrambenoj, kožnoj i farmaceutskoj industriji te medicini. Također se koristi za bojanje tkanina i papira.
Octena (etanska) kiselina CH3COOH je bezbojna tekućina karakterističnog oštrog mirisa, miješa se s vodom u bilo kojem omjeru. Vodene otopine octene kiseline nalaze se na tržištu pod nazivom ocat (3-5% otopina) i octena esencija (70-80% otopina) i imaju široku primjenu u prehrambenoj industriji. Octena kiselina je dobro otapalo za mnoge organske tvari i stoga se koristi u bojanju, štavljenju i industriji boja i lakova. Osim toga, octena kiselina je sirovina za proizvodnju mnogih tehnički važnih organskih spojeva: iz nje se, primjerice, dobivaju tvari za suzbijanje korova - herbicidi. 
Octena kiselina glavni je sastojak vinskog octa, čiji karakterističan miris duguje. Produkt je oksidacije etanola i iz njega nastaje skladištenjem vina na zraku.
Najvažniji predstavnici viših zasićenih jednobazičnih kiselina su palmitinska C15H31COOH i stearinska C17H35COOH kiselina. Za razliku od nižih kiselina, ove su tvari krute i slabo topive u vodi.
No, njihove soli - stearati i palmitati - vrlo su topljive i imaju detergentni učinak, zbog čega se nazivaju i sapunima. Jasno je da se te tvari proizvode u velikim količinama.
Od nezasićenih viših karboksilnih kiselina najveći značaj ima oleinska kiselina C17H33COOH, odnosno (CH2)7COOH. To je tekućina slična ulju bez okusa i mirisa. Njegove soli imaju široku primjenu u tehnologiji.
Najjednostavniji predstavnik dibazičnih karboksilnih kiselina je oksalna (etandioična) kiselina HOOC-COOH, čije se soli nalaze u mnogim biljkama, na primjer, kiselici i kiselici. Oksalna kiselina je bezbojna kristalna tvar koja je visoko topljiva u vodi. Koristi se za poliranje metala, u drvnoj i kožarskoj industriji.
1. Nezasićena elaidinska kiselina C17H33COOH je trans-izomer oleinske kiseline. Napiši strukturnu formulu ove tvari.
2. Napišite jednadžbu reakcije hidrogenacije oleinske kiseline. Imenuj produkt ove reakcije.
3. Napišite jednadžbu za reakciju gorenja stearinske kiseline. Koliki će volumen kisika i zraka (n.a.) biti potreban za spaljivanje 568 g stearinske kiseline?
4. Mješavina čvrstih masnih kiselina - palmitinske i stearinske - naziva se stearin (od njega se prave stearinski čepići). Koliki će volumen zraka (n.p.) biti potreban za sagorijevanje stearinske svijeće od dvije stotine grama ako stearin sadrži jednake mase palmitinske i stearinske kiseline? Koliki volumen ugljičnog dioksida (n.o.) i masa vode pritom nastaju?
5. Riješite prethodni zadatak pod uvjetom da svijeća sadrži jednake količine (isti broj molova) stearinske i palmitinske kiseline.
6. Za uklanjanje mrlja od hrđe tretirajte ih otopinom octene kiseline. Sastavite molekularne i ionske jednadžbe za reakcije koje se odvijaju u ovom slučaju, uzimajući u obzir da hrđa sadrži željezov(III) oksid i hidroksid - Fe2O3 i Fe(OH)3. Zašto se takve mrlje ne uklanjaju vodom? Zašto nestaju kada se tretiraju otopinom kiseline?
7. Soda bikarbona (bikarbona) NaHC03 dodana u tijesto bez kvasca prvo se “ugasi” octenom kiselinom. Izvedite ovu reakciju kod kuće i napišite njezinu jednadžbu, znajući da je ugljična kiselina slabija od octene kiseline. Objasnite nastanak pjene.
8. Znajući da je klor elektronegativniji od ugljika, rasporedi sljedeće kiseline: octenu, propionsku, klorooctenu, dikloroctenu i trikloroctenu kiselinu prema rastućim kiselinskim svojstvima. Obrazložite svoj rezultat.
9. Kako možemo objasniti da mravlja kiselina reagira u reakciji "srebrnog zrcala"? Napiši jednadžbu za ovu reakciju. Koji plin se u tom slučaju može osloboditi?
10. Kada je 3 g zasićene monobazične karboksilne kiseline reagiralo s viškom magnezija, oslobodilo se 560 ml (n.s.) vodika. Odredite formulu kiseline.
11. Navedite jednadžbe reakcija kojima se mogu opisati kemijska svojstva octene kiseline. Imenuj produkte tih reakcija.
12. Predložite jednostavnu laboratorijsku metodu kojom možete prepoznati propansku i akrilnu kiselinu.
13. Napišite jednadžbu reakcije nastajanja metil formata - estera metanola i mravlje kiseline. Pod kojim uvjetima treba provesti ovu reakciju?
14. Sastavite strukturne formule tvari sastava C3H602. U koje klase tvari se mogu svrstati? Navedite jednadžbe reakcije karakteristične za svaku od njih.
15. Supstanca A - izomer octene kiseline - nije topljiva u vodi, ali može biti podvrgnuta hidrolizi. Koja je strukturna formula tvari A? Navedite produkte njegove hidrolize.
16. Sastavite strukturne formule sljedećih tvari:
a) metil acetat;
b) oksalna kiselina;
c) mravlja kiselina;
d) dikloroctena kiselina;
e) magnezijev acetat;
f) etil acetat;
g) etil format;
h) akrilna kiselina.
17*. Uzorak zasićene jednobazne organske kiseline mase 3,7 g neutraliziran je vodenom otopinom natrijeva bikarbonata. Propuštanjem oslobođenog plina kroz vapnenu vodu dobiveno je 5,0 g taloga. Koja je kiselina uzeta i koliki je volumen ispuštenog plina?
Karboksilne kiseline u prirodi
Karboksilne kiseline su vrlo česte u prirodi. Nalaze se u voću i biljkama. Ima ih u iglama, znoju, urinu i soku od koprive. Znate, ispada da većina kiselina tvori estere, koji imaju mirise. Dakle, miris mliječne kiseline, koji se nalazi u ljudskom znoju, privlači komarce, oni ga osjećaju na priličnoj udaljenosti. Stoga, koliko god pokušavali otjerati dosadnog komarca, on svejedno dobro osjeća svoju žrtvu. Osim u ljudskom znoju, mliječna kiselina se nalazi u kiselim krastavcima i kiselom kupusu.
I ženke majmuna, da bi privukle mužjaka, luče octenu i propionsku kiselinu. Osjetljivi nos psa može osjetiti miris maslačne kiseline, čija je koncentracija 10-18 g/cm3.
Mnoge biljne vrste sposobne su proizvoditi octenu i maslačnu kiselinu. A neki korovi to iskorištavaju i otpuštanjem tvari eliminiraju svoje konkurente, potiskujući njihov rast, a ponekad i uzrokujući njihovu smrt.
Indijanci su također koristili kiselinu. Kako bi uništili neprijatelja, strijele su natopili smrtonosnim otrovom, za koji se pokazalo da je derivat octene kiseline.
I ovdje se postavlja prirodno pitanje: predstavljaju li kiseline opasnost za ljudsko zdravlje? Uostalom, oksalna kiselina, koja je široko rasprostranjena u prirodi i nalazi se u kiselici, narančama, ribizlima i malinama, iz nekog razloga nije našla primjenu u prehrambenoj industriji. Ispostavilo se da je oksalna kiselina dvjesto puta jača od octene kiseline i može čak nagrizati posuđe, a njezine soli, nakupljajući se u ljudskom tijelu, stvaraju kamenje.
Kiseline su našle široku primjenu u svim sferama ljudskog života. Koriste se u medicini, kozmetologiji, prehrambenoj industriji, poljoprivredi i za potrebe kućanstva.
U medicinske svrhe koriste se organske kiseline kao što su mliječna, vinska i askorbinska. Vjerojatno je svatko od vas koristio vitamin C za jačanje tijela - to je upravo askorbinska kiselina. Ne samo da pomaže u jačanju imunološkog sustava, već također ima sposobnost uklanjanja kancerogenih tvari i toksina iz tijela. Za kauterizaciju se koristi mliječna kiselina, jer je vrlo higroskopna. Ali vinska kiselina djeluje kao blagi laksativ, kao protuotrov kod trovanja alkalijama i kao komponenta neophodna za pripremu plazme za transfuziju krvi.
Ali ljubitelji kozmetičkih postupaka trebaju znati da voćne kiseline sadržane u agrumima imaju blagotvoran učinak na kožu, jer prodirući duboko, mogu ubrzati proces obnove kože. Osim toga, miris agruma ima tonički učinak na živčani sustav.
Jeste li primijetili da se bobičasto voće kao što su brusnice i brusnice dugo čuvaju i ostaju svježe. Znaš li zašto? Ispostavilo se da sadrže benzojevu kiselinu koja je odličan konzervans.
Ali u poljoprivredi, jantarna kiselina je pronašla široku primjenu, jer se može koristiti za povećanje produktivnosti kultiviranih biljaka. Također može potaknuti rast biljaka i ubrzati njihov razvoj.
1.Karboksilne kiseline – to su organske tvari koje sadrže kisik čije molekule sadrže jednu ili više karboksilnih skupina
(-C OOH ), povezan s ugljikovim radikalom ili atomom vodika.
Karboksilna skupina sadrži dvije funkcionalne skupine - karbonil >C=O i hidroksil -OH, izravno povezane jedna s drugom:
2. Klasifikacija
A) Brojem karboksilnih skupina u molekuli
|
Ime |
Primjeri |
|
1) Jednobazni |
Metan novi , mravlja kiselina Etan novi , octena kiselina |
|
2) dvobazični |
HOOC-COOH Oksalna kiselina |
|
3) Polibazični |
B) Po prirodi ugljikovodičnog radikala
|
Ime |
Primjeri |
|
1) Limit (zasićeno) |
HCOOH Metan novi , mravlja kiselina CH3COOH Etan novi , octena kiselina |
|
2) Neograničeno |
Akrilna kiselina CH2 = CHCOOH Krotonska kiselina CH 3 –CH=CH–COOH Oleinska CH 3 –(CH 2) 7 –CH=CH–(CH 2) 7 –COOH Linolni CH 3 – (CH 2) 4 – (CH=CH–CH 2) 2 – (CH 2) 6 –COOH Linolenski CH 3 –CH 2 – (CH=CH–CH 2) 3 – (CH 2) 6 –COOH |
|
3) Aromatičan |
C 6 H 5 COOH – benzojeva kiselina NOOS–C 6 H 4 –COOH Par-tereftalna kiselina |
3. Izomerija i nomenklatura
ja . Strukturalni
A) Izomerija ugljikovog skeleta (počevši od C 4 )
B) Interklasa s esterima R - CO – O - R 1 (počevši od C 2)
Na primjer: za C3H6O2
CH3-CH2-COOH propionska kiselina
S H3-CO-OCH3 metil ester octene kiseline
II . Prostorno
A) Optički
Na primjer:
B) Cis-trans izomerija za nezasićene kiseline
Primjer:
4. Nomenklatura karboksilnih kiselina
Sustavni nazivi kiselina daju se imenom odgovarajućeg ugljikovodika uz dodatak sufiksa -novi i riječi kiselina.
Da bi se označio položaj supstituenta (ili radikala), numeriranje ugljikovog lanca počinje od ugljikovog atoma karboksilne skupine. Na primjer, spoj s razgranatim ugljikovim lancem (CH 3) 2 CH-CH 2 -COOH naziva se 3-metilbutanska kiselina. Trivijalni nazivi također se naširoko koriste za organske kiseline, koji obično odražavaju prirodni izvor gdje su spojevi prvi put otkriveni.
Neke monobazične kiseline
|
Formula |
Naziv kiseline R-COOH |
Naziv ostatka RCOO - |
|
|
sustavan |
trivijalno |
||
|
HCOOH |
metan |
mrav |
formatizovati |
|
CH3COOH |
etan |
ocat |
acetat |
|
C2H5COOH |
propan |
propionski |
propionat |
|
C3H7COOH |
butan |
ulje |
butirat |
|
C4H9COOH |
pentan |
odoljen |
valerat |
|
C5H11COOH |
heksan |
najlon |
kaprat |
|
C15H31COOH |
heksadekan |
palmitinska |
palmitat |
|
C17H35COOH |
oktadekan |
stearinska |
stearat |
|
C6H5COOH |
benzenkarbonski |
benzoin |
benzoat |
|
CH2=CH-COOH |
propen |
akril |
akrilat |
Sufiksi se koriste za višebazične kiseline -diovaya, -triovaya itd.
Na primjer:
HOOC-COOH- etandioična (oksalna) kiselina;
HOOC-CH 2 -COOH - propandioinska (malonska) kiselina.
GRANIČNE MONOBAZNE KARBOKSILNE KISELINE
CnH 2 n +1 - COOHiliCnH 2 nO 2
Homologne serije
|
Ime |
Formula kiseline |
t mn. |
t kip. |
ρ |
|
|
kiseline |
|||||
|
mrav |
metan |
HCOOH |
100,5 |
1,22 |
|
|
ocat |
etan |
CH3COOH |
16,8 |
1,05 |
|
|
propionski |
propan |
CH3CH2COOH |
0,99 |
||
|
ulje |
butan |
CH3(CH2)2COOH |
0,96 |
||
Struktura karboksilne skupine
Karboksilna skupina spaja dvije funkcionalne skupine - karbonil >C=O i hidroksil -OH, koje međusobno utječu jedna na drugu:
Kisela svojstva karboksilnih kiselina posljedica su pomaka u gustoći elektrona prema karbonilnom kisiku i rezultirajuće dodatne (u usporedbi s alkoholima) polarizacije O–H veze.
U vodenoj otopini karboksilne kiseline disociraju na ione:
Topivost u vodi i visoka vrelišta kiselina posljedica su stvaranja međumolekulskih vodikovih veza.
S povećanjem molekulske mase smanjuje se topljivost kiselina u vodi.
Fizikalna svojstva zasićenih jednobazičnih kiselina
Niži članovi ove serije, u normalnim uvjetima, su tekućine karakterističnog oštrog mirisa. Na primjer, etanska (octena) kiselina ima karakterističan "octeni" miris. Bezvodna octena kiselina je tekućina na sobnoj temperaturi; na 17 °C se smrzava, pretvarajući se u ledenu tvar koja se naziva "ledena" octena kiselina. Srednji predstavnici ove homologne serije su viskozne, "uljne" tekućine; počevši od C 10 – čvrste tvari.
Najjednostavnija aromatska kiselina - benzojeva kiselina C 6 H 5 COOH (tt 122,4 ° C) - lako sublimira, tj. prelazi u plinovito stanje, zaobilazeći tekuće stanje. Kada se ohladi, njegove pare sublimiraju u kristale. Ovo se svojstvo koristi za pročišćavanje tvari od nečistoća.
DEFINICIJA
Karboksilne kiseline– organski spojevi čije molekule sadrže jednu ili više funkcionalnih karboksilnih skupina – COOH, povezanih s ugljikovodičnim radikalom.
Karboksilna skupina sastoji se od karbonilne skupine > C= O a pripadajuća hidroksilna skupina –OH.
Opća formula karboksilnih kiselina je R–COOH.
Kisela svojstva karboksilnih kiselina posljedica su pomaka gustoće elektrona prema karbonilnom kisiku, što uzrokuje pojavu djelomičnog pozitivnog naboja na atomu.
Kao rezultat toga, polaritet O-H veze se povećava i proces disocijacije postaje moguć:
Nastali anion se stabilizira zbog delokalizacije naboja:

Niže karboksilne kiseline koje sadrže do 3 ugljikova atoma su bezbojne tekućine s karakterističnim oštrim mirisom, miješaju se s vodom u bilo kojem omjeru. Većina kiselina koje sadrže 4-9 atoma su uljaste tekućine neugodnog mirisa. Kiseline koje sadrže više od 10 atoma vodika su krute tvari netopljive u vodi.
Topljivost karboksilnih kiselina u vodi i visoka vrelišta povezani su s stvaranjem međumolekulskih vodikovih veza. U čvrstom stanju karboksilne kiseline postoje uglavnom u obliku cikličkih dimera, au tekućem stanju dolazi i do linearne asocijacije:
Vrste karboksilnih kiselina
Ovisno o strukturi ugljikovodičnog radikala, karboksilne kiseline se dijele na:
- aromatski (benzojeva kiselina)
- alifatski (zasićeni (kaproinska kiselina) i nezasićeni (akrilna kiselina))
- aliciklička (kininska kiselina)
- heterociklički (nikotinska kiselina).
Prema broju karboksilnih skupina karboksilne kiseline dijelimo na:
- monobaza()
- dibazična (oksalna kiselina)
- polibazična (limunska kiselina).
Kada se druge funkcionalne skupine (–OH, =CO, –NH2 itd.) uvedu u molekulu kiseline, nastaju druge klase spojeva: hidroksi, ketokiseline itd.
Opća formula zasićenih monobazičnih karboksilnih kiselina:
S n H2nO2 (n= 1,2,3...) ili Cn H 2n+1 COOH (n = 0,1,2…)
Opća formula nezasićenih monobazičnih karboksilnih kiselina:
S n H 2 n –2 O 2 (n= 1,2,3...) ili CnH 2 n –1 COOH (n = 0,1,2…)
Opća formula zasićenih dibazičnih karboksilnih kiselina:
C n H 2n–2 O 4 (n = 2,3…)
Imena i formule nekih karboksilnih kiselina
|
Formula karboksilne kiseline |
IUPAC naziv |
Trivijalno ime |
|---|---|---|
|
Zasićene monobazične karboksilne kiseline |
||
|
Nezasićene monobazične karboksilne kiseline |
||
|
Dibazične karboksilne kiseline |
||
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | Tri jednake epruvete bez signatura sadrže tri kiseline: mravlju, octenu i klorovodičnu. Na temelju razlika u njihovim kemijskim svojstvima, kako možete odrediti koja se kiselina nalazi u svakoj epruveti? |
| Riješenje | Mravlja kiselina također pokazuje neka svojstva (reduktivna). Stoga se može odrediti, na primjer, reakcijom s bakrovim (II) hidroksidom; u slučaju mravlje kiseline nastaje crveni bakrov (I) oksid: Preostale kiseline mogu se razlikovati reakcijom sa srebrovim nitratom. U slučaju klorovodične kiseline, taloži se bijeli talog srebrovog klorida: Srebrni acetat se otapa u vodi, pa u epruveti neće doći do promjena. Dakle, preostala epruveta sadrži octenu kiselinu. |
PRIMJER 2
| Vježbajte | Utvrdite da li se pri hidrolizi uzorka mase 2,64 g oslobađa 1,38 g alkohola i 1,8 g monobazične karboksilne kiseline. |
| Riješenje | Opća formula estera koji se sastoji od alkohola i kiseline s različitim brojem ugljikovih atoma je: Dakle, formula alkohola je: a formula kiseline je: Napišimo jednadžbu za hidrolizu estera: Sukladno zakonu održanja mase tvari, masa produkata reakcije jednaka je masi polaznih tvari. Izračunajmo masu: M(kiselina) + m(alkohol) – m(eter) g Izračunajmo količinu vodene tvari: Prema jednadžbi reakcije n(kiselina) = n(alkohol) mol |
 Gibanje tijela pod utjecajem sile teže
Gibanje tijela pod utjecajem sile teže Tropi i stilske figure
Tropi i stilske figure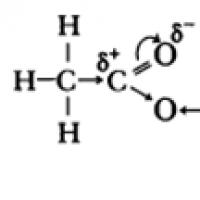 §12. Karboksilne kiseline. Karboksilne kiseline: fizikalna svojstva. Soli karboksilnih kiselina Najjednostavnija karboksilna kiselina je mravlja
§12. Karboksilne kiseline. Karboksilne kiseline: fizikalna svojstva. Soli karboksilnih kiselina Najjednostavnija karboksilna kiselina je mravlja Razgovor s bivšom djevojkom
Razgovor s bivšom djevojkom Zašto sanjate svog najboljeg prijatelja, bivšeg prijatelja ili prijatelja iz djetinjstva?
Zašto sanjate svog najboljeg prijatelja, bivšeg prijatelja ili prijatelja iz djetinjstva? Tumačenje snova trudna žena sanja dijete
Tumačenje snova trudna žena sanja dijete Zašto sanjate struju iskre? Zašto sanjate iskre? Što pišu u knjigama snova
Zašto sanjate struju iskre? Zašto sanjate iskre? Što pišu u knjigama snova