§12. Karboksilik kislotalar. Karboksilik kislotalar: fizik xossalari. Karboksilik kislotalarning tuzlari Eng oddiy karboksilik kislota formikdir
TA’RIF
Molekulalarida uglevodorod radikali bilan bog'langan bir yoki bir nechta karboksil guruhlari bo'lgan organik moddalar deyiladi. karboksilik kislotalar.
Karboksilik kislotalarning gomologik seriyasining dastlabki uchta a'zosi, jumladan, propion kislotasi, o'tkir hidli va suvda yaxshi eriydigan suyuqliklardir. Butirik kislotadan boshlangan quyidagi gomologlar ham kuchli yoqimsiz hidga ega, ammo suvda yomon eriydigan suyuqliklardir. Uglerod atomlari soni 10 yoki undan ortiq bo'lgan yuqori kislotalar qattiq, hidsiz, suvda erimaydi. Umuman olganda, bir qator gomologlarda molekulyar og'irlik ortishi bilan suvda eruvchanlik pasayadi, zichlik pasayadi va qaynash nuqtasi ortadi (1-jadval).
Jadval 1. Karboksilik kislotalarning gomologik qatori.
Karboksilik kislotalarni tayyorlash
Karboksilik kislotalar toʻyingan uglevodorodlar, spirtlar va aldegidlarning oksidlanishi natijasida olinadi. Masalan, sirka kislotasi - qizdirilganda kislotali muhitda etanolni kaliy permanganat eritmasi bilan oksidlash orqali:
Karboksilik kislotalarning kimyoviy xossalari
Karboksilik kislotalarning kimyoviy xossalari, birinchi navbatda, ularning tuzilishining o'ziga xos xususiyatlari bilan belgilanadi. Shunday qilib, suvda eruvchan kislotalar ionlarga ajralishi mumkin:
R-COOH↔R-COO - + H +.
Suvda H + ioni mavjudligi sababli ular nordon ta'mga ega, indikatorlarning rangini o'zgartirishga va elektr tokini o'tkazishga qodir. Suvli eritmada bu kislotalar kuchsiz elektrolitlardir.
Karboksilik kislotalar noorganik kislotalarning eritmalariga xos bo'lgan kimyoviy xususiyatlarga ega, ya'ni. metallar (1), ularning oksidlari (2), gidroksidlar (3) va kuchsiz tuzlar (4) bilan o'zaro ta'sir qiladi:
2CH 3 -COOh + Zn → (CH 3 COO) 2 Zn + H 2 (1);
2CH 3 -COOH + CuO→ (CH 3 COO) 2 Cu + H 2 O (2);
R-COOH + KOH → R-COOK + H 2 O (3);
2CH 3 -COOH + NaHCO 3 → CH 3 COONa + H 2 O + CO 2 (4).
Funktsional guruh tomonidan namoyon bo'ladigan to'yingan va to'yinmagan karboksilik kislotalarning o'ziga xos xususiyati spirtlar bilan o'zaro ta'sir qilishdir.
Karboksilik kislotalar qizdirilganda va konsentrlangan sulfat kislota ishtirokida spirtlar bilan reaksiyaga kirishadi. Masalan, sirka kislotasiga etil spirti va ozgina sulfat kislota qo'shilsa, qizdirilganda etil sirka kislotasi (etil asetat) hidi paydo bo'ladi:
CH 3 -COOH + C 2 H 5 OH ↔CH 3 -C(O)-O-C 2 H 5 + H 2 O.
To'yingan karboksilik kislotalarning radikal bilan namoyon bo'ladigan o'ziga xos xususiyati galogenlanish (xlorlash) reaktsiyasidir.

Karboksilik kislotalarni qo'llash
Karboksilik kislotalar ketonlar, kislota galogenidlari, vinil efirlari va boshqa muhim organik birikmalar sinflarini ishlab chiqarish uchun xom ashyo sifatida xizmat qiladi.
Chumoli kislota parfyumeriya, charm sanoati (terini ko'nlash), to'qimachilik sanoatida (bo'yash uchun mordan sifatida), erituvchi va konservant sifatida ishlatiladigan efirlarni olish uchun keng qo'llaniladi.
Sirka kislotasining suvdagi eritmasi (70-80%) sirka mohiyati, 3-9% li suvli eritmasi esa stol sirkasi deb ataladi. Mohiyat ko'pincha suyultirish orqali uyda sirka olish uchun ishlatiladi.
Muammoni hal qilishga misollar
MISOL 1
| Mashq qilish | Quyidagi o'zgarishlarni amalga oshirish uchun qanday kimyoviy reaktsiyalardan foydalanish mumkin: a) CH 4 → CH 3 Cl → CH 3 OH → HCHO → HCOOH → HCOOK. Reaksiya tenglamalarini yozing va ularning yuzaga kelish shartlarini ko'rsating. |
| Javob | a) Metanning yorug'likda xlorlanishi xlorometan hosil bo'lishiga olib keladi: CH 4 + Cl 2 →CH 3 Cl + HCl. Alkanlarning galogen hosilalari suvli yoki ishqoriy muhitda gidrolizlanib, spirt hosil qiladi: CH 3 Cl + NaOH → CH 3 OH + NaCl. Birlamchi spirtlarning oksidlanishi natijasida, masalan, kislotali muhitda katalizator (Cu, CuO, Pt, Ag) ishtirokida kaliy dixromat bilan aldegidlar hosil bo'ladi: CH 3 OH+ [O] →HCHO. Aldegidlar mos keladigan karboksilik kislotalarga oson oksidlanadi, masalan, kaliy permanganat bilan: HCHO + [O] → HCOOH. Karboksilik kislotalar zaif mineral kislotalarga xos bo'lgan barcha xususiyatlarni namoyon qiladi, ya'ni. Tuzlarni hosil qilish uchun faol metallar bilan o'zaro ta'sir qilish qobiliyatiga ega: 2HCOOH+ 2K→2HCOOK + H 2. |
2-MISA
| Mashq qilish | Quyidagi moddalar orasidagi reaksiya tenglamalarini yozing: a) 2-metilpropan kislota va xlor; b) sirka kislotasi va propanol-2; v) akril kislota va bromli suv; d) 2-metilbutan kislotasi va fosfor (V) xlorid. Reaksiya sharoitlarini belgilang. |
| Javob | a) 2-metilpropan kislota va xlor o'rtasidagi reaksiya natijasida a-holatda joylashgan uglevodorod radikalida vodorod atomi almashtiriladi; 2-metil-2-xloropropanoik kislota hosil bo'ladi H 3 C-C (CH 3) H-COOH + Cl 2 → H 3 C-C (CH 3) Cl-COOH + HCl (kat = P). b) sirka kislotasi va propanol-2 o'rtasidagi reaksiya natijasida efir hosil bo'ladi - sirka kislotasining izopropil efiri. CH 3 -COOH + CH 3 -C (OH) H-CH 3 → CH 3 -C (O) - O-C (CH 3) - CH 3 . v) akril kislota va bromli suv o'rtasidagi o'zaro ta'sir reaktsiyasi natijasida Markovnikov qoidasiga muvofiq qo'sh bog'lanish joyiga galogen qo'shilishi; 2,3-dibromopropan kislotasi hosil bo'ladi CH 2 =CH-COOH + Br 2 → CH 2 Br-CHBr-COOH d) 2-metilbutan kislotasi va fosfor (V) xlorid o'rtasidagi reaksiya natijasida tegishli kislota xlorid hosil bo'ladi. CH 3 -CH 2 -C(CH 3)H-COOH + PCl 5 →CH 3 -CH 2 -C(CH 3)H-COOCl + POCl 3 + HCl. |
Karboksilik kislotalar- molekulalarida bir yoki bir nechta karboksil guruhi bo'lgan organik moddalar.
Karboksil guruhi (qisqartirilgan COOH) karboksilik kislotalarning funktsional guruhi bo'lib, karbonil guruhi va bog'langan gidroksil guruhidan iborat.
Karboksil guruhlarning soniga ko'ra, karboksilik kislotalar bir asosli, ikki asosli va boshqalarga bo'linadi.
Bir asosli karboksilik kislotalarning umumiy formulasi R—COOH. Ikki asosli kislotaga misol oksalat kislotasi HOOC-COOH.
Radikal turiga ko'ra karboksilik kislotalar to'yingan (masalan, sirka kislotasi CH 3 COOH), to'yinmagan (masalan, akril kislota CH 2 =CH—COOH, oleyk kislota CH 3 —(CH 2) 7 —CH bo'linadi. =CH—(CH 2) 7 -COOH] va aromatik (masalan, benzoy C 6 H 5 -COOH).
Izomerlar va gomologlar
Bir asosli to‘yingan karboksilik kislotalar R-COOH bir xil miqdordagi uglerod atomlariga ega efirlarning izomerlari (qisqartirilgan R"-COOR").Har ikkisining umumiy formulasi C. n H 2 n O2.
| G | HCOOH metan (chumoli) |
||||
| CH3COOH etan (sirka) | HCOOCH 3 formik kislota metil efiri |
||||
| CH3CH2COOH propan (propion) |
HCOOCH 2 CH 3 etil formik kislota |
CH 3 COOCH 3 sirka kislotasi metil esteri | |||
| CH3(CH2)2COOH butan (moy) |
2-metilpropan |
HCOOCH 2 CH 2 CH 3 formik kislotaning propil efiri |
CH 3 COOCH 2 CH 3 etil asetat |
CH 3 CH 2 COOCH 3 propion kislotasi metil esteri |
|
| izomerlar | |||||
Karboksilik kislotalarning nomlarini tuzish algoritmi
- Uglerod magistralini toping - bu uglerod atomlarining eng uzun zanjiri, shu jumladan karboksil guruhining uglerod atomi.
- Karboksil uglerod atomidan boshlab asosiy zanjirdagi uglerod atomlarini raqamlang.
- Uglevodorodlar algoritmidan foydalanib birikmani nomlang.
- Ismning oxiriga "-ov" qo'shimchasini, "-aya" oxirini va "kislota" so'zini qo'shing.
Karboksilik kislotalar molekulalarida p-gidroksil guruhi kislorod atomlarining elektronlari karbonil guruhining -bog'i elektronlari bilan o'zaro ta'sir qiladi, buning natijasida O-H bog'ining qutbliligi ortadi, karbonil guruhidagi -bog' kuchayadi, qisman zaryad (+) uglerod atomidagi qism kamayadi va vodorod atomidagi qisman zaryad (+) ortadi.
Ikkinchisi karboksilik kislota molekulalari o'rtasida kuchli vodorod aloqalarining shakllanishiga yordam beradi.
To'yingan bir asosli karboksilik kislotalarning fizik xossalari ko'p jihatdan molekulalar o'rtasida kuchli vodorod aloqalarining mavjudligi bilan bog'liq (spirtli molekulalar orasidagidan kuchliroq). Shuning uchun kislotalarning qaynash va suvda eruvchanligi tegishli spirtlarnikidan yuqori.
Kislotalarning kimyoviy xossalari
Karbonil guruhidagi -bog'ning kuchayishi qo'shilish reaktsiyalarining karboksilik kislotalar uchun xarakterli bo'lmasligiga olib keladi.
- Yonish:
CH 3 COOH + 2O 2 2CO 2 + 2H 2 O
- Kislota xossalari.
O-H aloqasining yuqori qutbliligi tufayli suvli eritmadagi karboksilik kislotalar sezilarli darajada ajralib chiqadi (aniqrog'i, u bilan teskari reaksiyaga kirishadi):HCOOH HCOO - + H + (aniqrog'i HCOOH + H 2 O HCOO - + H 3 O +)
Barcha karboksilik kislotalar kuchsiz elektrolitlardir. Uglerod atomlari soni ortishi bilan kislotalarning kuchi pasayadi (O-H bog'lanish qutbliligining pasayishi tufayli); aksincha, uglevodorod radikaliga galogen atomlarining kiritilishi kislota kuchining oshishiga olib keladi. Ha, ketma-ketHCOOH CH 3 COOH C 2 H 5 COOH
kislotalarning kuchi pasayadi va ketma-ketlikdaOrtib bormoqda.
Karboksilik kislotalar zaif kislotalarga xos bo'lgan barcha xususiyatlarni namoyon qiladi:
Mg + 2CH 3 COOH (CH 3 COO) 2 Mg + H 2
CaO + 2CH 3 COOH (CH 3 COO) 2 Ca + H 2 O
NaOH + CH 3 COOH CH 3 COONa + H 2 O
K 2 CO 3 + 2CH 3 COOH 2CH 3 COOK + H 2 O + CO 2 - Esterifikatsiya (karboksilik kislotalarning spirtlar bilan reaktsiyasi, ester hosil bo'lishiga olib keladi):
Glitserin kabi ko'p atomli spirtlar ham esterlanish reaktsiyasiga kirishi mumkin. Glitserin va yuqori karboksilik kislotalar (yog 'kislotalari) tomonidan hosil qilingan efirlar yog'lardir.Yog'lar triglitseridlarning aralashmasidir. To'yingan yog' kislotalari (palmitik C 15 H 31 COOH, stearin C 17 H 35 COOH) hayvonlarning qattiq yog'larini, to'yinmagan yog'li kislotalar (oleik C 17 H 33 COOH, linoleik C 17 H 31 COOH va boshqalar) suyuq yog'larni hosil qiladi. (yog'lar) o'simlik kelib chiqishi.
- Uglevodorod radikalida almashtirish:
Almashtirish - pozitsiyasida sodir bo'ladi.Formik kislota HCOOH ning o'ziga xos xususiyati shundaki, bu modda ikki funktsiyali birikma bo'lib, u ham karboksilik kislota, ham aldegiddir:
Shuning uchun, formik kislota, boshqa narsalar qatorida, kumush oksidning ammiak eritmasi bilan reaksiyaga kirishadi (kumush oyna reaktsiyasi; sifatli reaktsiya):HCOOH + Ag 2 O (ammiak eritmasi) CO 2 + H 2 O + 2Ag
Karboksilik kislotalarni tayyorlash
.
O
//
-C atomlari guruhiga karboksil guruhi yoki karboksil deyiladi.
\
OH
Molekulasida bitta karboksil guruhi bo'lgan organik kislotalar bir asosli. Ushbu kislotalarning umumiy formulasi RCOOH.
Ikki karboksil guruhini o'z ichiga olgan karboksilik kislotalar ikki asosli deb ataladi. Bularga, masalan, oksalat va süksin kislotalari kiradi.
Ikki dan ortiq karboksil guruhini o'z ichiga olgan ko'p asosli karboksilik kislotalar ham mavjud. Bularga, masalan, tribasik limon kislotasi kiradi. Uglevodorod radikalining tabiatiga ko'ra, karboksilik kislotalar to'yingan, to'yinmagan va aromatiklarga bo'linadi.
To'yingan yoki to'yingan, karboksilik kislotalar, masalan, propanik (propion) kislota yoki allaqachon tanish bo'lgan süksin kislotasi.
Shubhasiz, to'yingan karboksilik kislotalar mavjud emas P-uglevodorod radikalidagi bog'lanishlar.
To'yinmagan karboksilik kislotalarning molekulalarida karboksil guruhi to'yinmagan, to'yinmagan uglevodorod radikali bilan bog'liq, masalan, akril (propenik) CH2=CH-COOH yoki oleyk CH3-(CH2)7-CH=CH-(CH2) molekulalarida. 7-COOH va boshqa kislotalar.
Benzoik kislota formulasidan ko'rinib turibdiki, u aromatikdir, chunki uning molekulasida aromatik (benzol) halqasi mavjud.
Nomenklatura va izomeriya
Biz allaqachon karboksilik kislotalarning, shuningdek, boshqa organik birikmalarning nomlarini hosil qilishning umumiy tamoyillarini ko'rib chiqdik. Keling, bir va ikki asosli karboksilik kislotalarning nomenklaturasiga batafsil to'xtalib o'tamiz. Karboksilik kislotaning nomi mos keladigan alkan (molekulasida bir xil miqdordagi uglerod atomiga ega alkan) nomidan -ov qo'shimchasi, -aya oxiri va kislota so'zi qo'shilishi bilan hosil bo'ladi. Uglerod atomlarini raqamlash karboksil guruhidan boshlanadi. Masalan:
Ko'pgina kislotalarning tarixan o'rnatilgan yoki ahamiyatsiz nomlari ham bor (6-jadval). 
Organik kislotalarning xilma-xil va qiziqarli dunyosi bilan birinchi tanishganimizdan so'ng, biz to'yingan monobazik karboksilik kislotalarni batafsil ko'rib chiqamiz.
Bu kislotalarning tarkibi C n H 2n O2 yoki C n H 2n +1 COOH yoki RCOOH umumiy formulasi bilan aks etishi aniq.
To'yingan bir asosli karboksilik kislotalarning fizik xususiyatlari
Pastki kislotalar, ya'ni molekulasida to'rttagacha uglerod atomini o'z ichiga olgan nisbatan kichik molekulyar og'irlikdagi kislotalar xarakterli o'tkir hidga ega suyuqliklardir (sirka kislotasining hidini eslang). 4 dan 9 gacha uglerod atomlarini o'z ichiga olgan kislotalar yoqimsiz hidli yopishqoq yog'li suyuqliklardir; har bir molekulada 9 dan ortiq uglerod atomini o'z ichiga olgan - suvda erimaydigan qattiq moddalar. To'yingan bir asosli karboksilik kislotalarning qaynash nuqtalari molekuladagi uglerod atomlari sonining ko'payishi va shuning uchun nisbiy molekulyar og'irlikning oshishi bilan ortadi. Masalan, chumoli kislotaning qaynash harorati 101 °C, sirka kislotasi 118 °C, propion kislotasi 141 °C.
Oddiy sharoitlarda kichik nisbiy molekulyar og'irlikka (46) ega bo'lgan eng oddiy karboksilik kislota, formik HCOOH, qaynash nuqtasi 100,8 ° C bo'lgan suyuqlikdir. Shu bilan birga, xuddi shu sharoitda butan (MR(C4H10) = 58) gazsimon va -0,5 ° C qaynash nuqtasiga ega. Qaynish nuqtalari va nisbiy molekulyar og'irliklar o'rtasidagi bu nomuvofiqlik ikki kislota molekulasi ikkita vodorod aloqasi bilan bog'langan karboksilik kislota dimerlarining shakllanishi bilan izohlanadi. Vodorod aloqalarining paydo bo'lishi karboksilik kislota molekulalarining tuzilishini ko'rib chiqishda aniq bo'ladi.
To'yingan monobazik karboksilik kislotalarning molekulalarida atomlarning qutbli guruhi - karboksil (ushbu funktsional guruhning qutblanishiga nima sabab bo'lganini o'ylab ko'ring) va amalda qutbsiz uglevodorod radikali mavjud. Karboksil guruhi suv molekulalariga tortilib, ular bilan vodorod aloqalarini hosil qiladi.
Chumoli va sirka kislotalari suvda cheksiz eriydi. Ko'rinib turibdiki, uglevodorod radikalidagi atomlar sonining ko'payishi bilan karboksilik kislotalarning eruvchanligi pasayadi.
Karboksilik kislota molekulalarining tarkibi va tuzilishini bilgan holda, bu moddalarning kimyoviy xususiyatlarini tushunish va tushuntirish biz uchun qiyin bo'lmaydi.
Kimyoviy xossalari
Kislotalar sinfiga (ham organik, ham noorganik) xos bo'lgan umumiy xususiyatlar vodorod va kislorod atomlari o'rtasida yuqori qutbli aloqani o'z ichiga olgan gidroksil guruhining molekulalarida mavjudligi bilan bog'liq. Bu xususiyatlar sizga yaxshi ma'lum. Keling, ularni yana suvda eruvchan organik kislotalar misolida ko'rib chiqaylik.
1. Kislota qoldig'ining vodorod kationlari va anionlari hosil bo'lishi bilan dissosiatsiya. Aniqroq aytganda, bu jarayon undagi suv molekulalarining ishtirokini hisobga oladigan tenglama bilan tavsiflanadi.
Karboksilik kislotalarning dissotsilanish muvozanati chapga siljiydi, ularning katta qismi kuchsiz elektrolitlardir. Shunga qaramay, masalan, chumoli va sirka kislotalarining nordon ta'mi kislotali qoldiqlarning vodorod kationlari va anionlariga ajralishi bilan izohlanadi.
Ko'rinib turibdiki, karboksilik kislotalar molekulalarida "kislotali" vodorodning mavjudligi, ya'ni karboksil guruhining vodorodi boshqa xarakterli xususiyatlarni ham belgilaydi.
2. Vodorodgacha bo'lgan elektrokimyoviy kuchlanish oralig'ida metallar bilan o'zaro ta'sir qilish. Shunday qilib, temir vodorodni sirka kislotasidan kamaytiradi:
2CH3-COOH + Fe -> (CHgCOO)2Fe + H2
3. Tuz va suv hosil qilish uchun asosli oksidlar bilan o'zaro ta'sir qilish:
2R-COOH + CaO -> (R-COO)2Ca + H20
4. Metall gidroksidlari bilan tuz va suv hosil qilish reaksiyasi (neytrallanish reaksiyasi):
R-COOH + NaOH -> R-COONa + H20 3R-COOH + Ca(OH)2 -> (R-COO)2Ca + 2H20
5. Kuchsiz kislotalarning tuzlari bilan o'zaro ta'siri, ikkinchisining hosil bo'lishi bilan. Shunday qilib, sirka kislotasi stearin kislotasini natriy stearatdan va karbonat kislotani kaliy karbonatdan siqib chiqaradi.
6. Karboksilik kislotalarning spirtlar bilan o'zaro ta'sirida efirlarni hosil qilish - bu sizga allaqachon ma'lum bo'lgan esterifikatsiya reaktsiyasi (karboksilik kislotalarga xos bo'lgan eng muhim reaktsiyalardan biri). Karboksilik kislotalarning spirtlar bilan o'zaro ta'siri vodorod kationlari tomonidan katalizlanadi.
Esterifikatsiya reaktsiyasi teskari. Muvozanat suvsizlantiruvchi moddalar ishtirokida efir hosil bo'lishi va reaktsiya aralashmasidan efirni olib tashlash tomon siljiydi.
Ester gidrolizi deb ataladigan esterlanishning teskari reaktsiyasida (esterni suv bilan reaksiyaga kiritish) kislota va spirt hosil bo'ladi. Ko'rinib turibdiki, ko'p atomli spirtlar, masalan, glitserin, karboksilik kislotalar bilan ham reaksiyaga kirishishi mumkin, ya'ni esterifikatsiya reaktsiyasiga kirishadi: 
Barcha karboksilik kislotalar (chumoli kislotasidan tashqari) karboksil guruhi bilan birga molekulalarida uglevodorod qoldig'i mavjud. Albatta, bu uglevodorod qoldig'ining tabiati bilan belgilanadigan kislotalarning xususiyatlariga ta'sir qilmasligi mumkin.
7. Ko'p bog'lanishda qo'shilish reaktsiyalari - ularga to'yinmagan karboksilik kislotalar kiradi; masalan, vodorod qo'shilishi reaktsiyasi gidrogenlashdir. Oleyk kislota gidrogenlanganda to'yingan stearin kislotasi hosil bo'ladi.
To'yinmagan karboksilik kislotalar, boshqa to'yinmagan birikmalar kabi, qo'sh bog' orqali galogenlarni qo'shadi. Masalan, akril kislota bromli suvni rangsizlantiradi.
8. Almashtirish reaktsiyalari (galogenlar bilan) - to'yingan karboksilik kislotalar unga kirishi mumkin; masalan, sirka kislotani xlor bilan reaksiyaga solib, turli xil xlorli kislotalarni olish mumkin:

Uglevodorod qoldig'ida bir nechta uglerod atomini o'z ichiga olgan karboksilik kislotalarni galogenlashda molekulada galogenning turli pozitsiyalari bo'lgan mahsulotlar hosil bo'lishi mumkin. Reaksiya erkin radikal mexanizm orqali sodir bo'lganda, uglevodorod qoldig'idagi har qanday vodorod atomlari almashtirilishi mumkin. Agar reaksiya oz miqdordagi qizil fosfor ishtirokida amalga oshirilsa, u tanlab davom etadi - vodorod faqat o'rnini bosadi. A-kislota molekulasidagi joylashuvi (funktsional guruhga eng yaqin uglerod atomida). Ushbu selektivlikning sabablarini oliy o'quv yurtida kimyo fanini o'rganayotganda bilib olasiz.
Karboksilik kislotalar gidroksil guruhini almashtirganda turli funktsional hosilalar hosil qiladi. Bu hosilalar gidrolizlanganda yana karboksilik kislota hosil bo'ladi.
Karboksilik kislota xloridini fosfor (III) xlorid yoki tionilxlorid (SOCl 2) ni kislota bilan reaksiyaga kiritish orqali olish mumkin. Karboksilik kislota angidridlari xlor angidridlarini karboksilik kislota tuzlari bilan reaksiyaga kiritish orqali tayyorlanadi. Esterlar karboksilik kislotalarning spirtlar bilan esterlanishi natijasida hosil bo'ladi. Esterifikatsiya noorganik kislotalar tomonidan katalizlanadi.
Bu reaksiya karboksil guruhining protonlanishi - vodorod kationining (proton) kislorod atomining yolg'iz elektron jufti bilan o'zaro ta'siridan boshlanadi. Karboksil guruhining protonlanishi undagi uglerod atomidagi musbat zaryadning oshishiga olib keladi:

Qabul qilish usullari
Karboksilik kislotalarni birlamchi spirtlar va aldegidlarni oksidlash orqali olish mumkin.
Aromatik karboksilik kislotalar benzol gomologlarining oksidlanishi natijasida hosil bo'ladi.
Turli xil karboksilik kislota hosilalari gidrolizlanishi natijasida ham kislotalar hosil bo'ladi. Shunday qilib, esterning gidrolizi spirt va karboksilik kislota hosil qiladi. Yuqorida aytib o'tilganidek, kislota-katalizli esterifikatsiya va gidroliz reaktsiyalari teskari bo'ladi. Ishqorning suvli eritmasi ta'sirida esterning gidrolizi qaytarilmas tarzda davom etadi, bu holda esterdan kislota emas, balki uning tuzi hosil bo'ladi. Nitrillarning gidrolizlanishi jarayonida avvalambor amidlar hosil bo'ladi, keyinchalik ular kislotalarga aylanadi. Karboksilik kislotalar organik magniy birikmalarining uglerod oksidi (IV) bilan o'zaro ta'siridan hosil bo'ladi.
Karboksilik kislotalarning alohida vakillari va ularning ahamiyati
Formik (metan) kislota HCOOH - o'tkir hidli va qaynash harorati 100,8 ° C bo'lgan suyuqlik, suvda yaxshi eriydi. Chumoli kislota zaharli bo'lib, teriga tegsa, kuyishga olib keladi! Chumolilar chiqaradigan qichitqi suyuqlikda bu kislota mavjud. Formik kislota dezinfektsiyalash xususiyatiga ega va shuning uchun oziq-ovqat, teri va farmatsevtika sanoatida va tibbiyotda qo'llaniladi. Bundan tashqari, mato va qog'ozni bo'yashda ham qo'llaniladi.
Sirka (etanik) kislota CH3COOH har qanday nisbatda suv bilan aralashib ketadigan o'ziga xos o'tkir hidli rangsiz suyuqlikdir. Sirka kislotasining suvli eritmalari sirka (3-5% eritma) va sirka mohiyati (70-80% eritma) nomi bilan sotiladi va oziq-ovqat sanoatida keng qo'llaniladi. Sirka kislotasi ko'plab organik moddalar uchun yaxshi erituvchi bo'lib, shuning uchun bo'yash, ko'nchilik va bo'yoq va lak sanoatida qo'llaniladi. Bundan tashqari, sirka kislotasi ko'plab texnik muhim organik birikmalar olish uchun xom ashyo hisoblanadi: masalan, begona o'tlarga qarshi kurashda ishlatiladigan moddalar - gerbitsidlar undan olinadi. 
Sirka kislotasi sharob sirkasining asosiy komponenti bo'lib, uning xarakterli hidi unga bog'liq. Bu etanol oksidlanish mahsuloti bo'lib, sharob havoda saqlanganida undan hosil bo'ladi.
Yuqori to'yingan bir asosli kislotalarning eng muhim vakillari palmitik C15H31COOH va stearin C17H35COOH kislotalaridir. Pastki kislotalardan farqli o'laroq, bu moddalar qattiq va suvda yomon eriydi.
Biroq, ularning tuzlari - stearatlar va palmitatlar - juda yaxshi eriydi va detarjan ta'siriga ega, shuning uchun ularni sovun deb ham atashadi. Bu moddalar keng miqyosda ishlab chiqarilganligi aniq.
To'yinmagan yuqori karboksilik kislotalardan oleyk kislotasi C17H33COOH yoki (CH2)7COOH eng katta ahamiyatga ega. Bu ta'mi va hidi bo'lmagan moyga o'xshash suyuqlikdir. Uning tuzlari texnologiyada keng qo'llaniladi.
Ikki asosli karboksilik kislotalarning eng oddiy vakili oksalat (etandioik) kislota HOOC-COOH bo'lib, uning tuzlari ko'plab o'simliklarda uchraydi, masalan, otquloq va otquloq. Oksalat kislotasi rangsiz kristall modda bo'lib, suvda yaxshi eriydi. Metalllarni parlatish, yog'ochni qayta ishlash va charm sanoatida qo'llaniladi.
1. To'yinmagan elaid kislotasi C17H33COOH oleyk kislotaning trans-izomeridir. Ushbu moddaning tuzilish formulasini yozing.
2. Oleyk kislotaning gidrogenlanish reaksiyasi tenglamasini yozing. Ushbu reaksiya mahsulotini ayting.
3. Stearin kislotaning yonish reaksiyasi tenglamasini yozing. 568 g stearin kislotani yoqish uchun qanday hajmdagi kislorod va havo (n.a.) kerak bo'ladi?
4. Qattiq yog 'kislotalari - palmitik va stearik aralashmasi - stearin deb ataladi (stearin shamlari shundan tayyorlanadi). Agar stearin tarkibida palmitik va stearin kislotalarning massasi teng bo'lsa, ikki yuz gramm stearik shamni yoqish uchun qancha havo hajmi (n.a.) kerak bo'ladi? Bu holda karbonat angidridning qanday hajmi (n.o.) va suvning massasi hosil bo'ladi?
5. Shamda teng miqdorda (bir xil miqdordagi mol) stearik va palmitik kislotalar bo'lishi sharti bilan oldingi masalani hal qiling.
6. Zang dog'larini olib tashlash uchun ularni sirka kislotasi eritmasi bilan davolang. Zang tarkibida temir (III) oksidi va gidroksid - Fe2O3 va Fe(OH)3 borligini hisobga olib, bu holda sodir bo'ladigan reaktsiyalar uchun molekulyar va ionli tenglamalar tuzing. Nima uchun bunday dog'lar suv bilan olib tashlanmaydi? Nima uchun ular kislota eritmasi bilan ishlaganda yo'qoladi?
7. Xamirturushsiz xamirga qo'shilgan pishirish (pishirish) soda NaHC03 avval sirka kislotasi bilan "söndürülür". Bu reaksiyani uyda bajaring va uglerod kislotasi sirka kislotadan kuchsiz ekanligini bilib, uning tenglamasini yozing. Ko'pik hosil bo'lishini tushuntiring.
8. Xlorning uglerodga nisbatan elektron manfiyligini bilib, quyidagi kislotalarni: sirka, propion, xlorasetik, dikxlorosirka va triklorosirka kislotalarni kislotalik xossalarini oshirish tartibida joylashtiring. Natijangizni asoslang.
9. Chumoli kislotaning “kumush oyna” reaksiyasida reaksiyaga kirishishini qanday izohlash mumkin? Ushbu reaksiya tenglamasini yozing. Bu holatda qanday gaz ajralib chiqishi mumkin?
10. 3 g to‘yingan bir asosli karboksilik kislota ortiqcha magniy bilan reaksiyaga kirishganda, 560 ml (n.s.) vodorod ajralib chiqdi. Kislota formulasini aniqlang.
11. Sirka kislotaning kimyoviy xossalarini tavsiflash uchun ishlatilishi mumkin bo‘lgan reaksiya tenglamalarini keltiring. Ushbu reaksiyalarning mahsulotlarini nomlang.
12. Propanik va akril kislotalarni tanib olishingiz mumkin bo'lgan oddiy laboratoriya usulini taklif qiling.
13. Metilformat - metanol va chumoli kislotaning efirini hosil qilish reaksiyasi tenglamasini yozing. Bu reaksiya qanday sharoitlarda amalga oshirilishi kerak?
14. Tarkibi C3H602 bo'lgan moddalarning tuzilish formulalarini tuzing. Ularni qanday moddalar sinfiga bo'lish mumkin? Ularning har biriga xos reaksiya tenglamalarini keltiring.
15. A modda - sirka kislotaning izomeri - suvda erimaydi, lekin gidrolizga tushishi mumkin. A moddaning tuzilish formulasi nima? Uning gidrolizlanishi mahsulotlarini ayting.
16. Quyidagi moddalarning tuzilish formulalarini tuzing:
a) metil asetat;
b) oksalat kislotasi;
v) chumoli kislotasi;
d) dixloroasetik kislota;
e) magniy asetat;
f) etil asetat;
g) etil format;
h) akril kislota.
17*. Og'irligi 3,7 g bo'lgan to'yingan monobazik organik kislotaning namunasi natriy bikarbonatning suvli eritmasi bilan zararsizlantirildi. Olingan gazni ohak suvidan o'tkazib, 5,0 g cho'kma olingan. Qanday kislota olindi va chiqarilgan gazning hajmi qanday?
Tabiatdagi karboksilik kislotalar
Karboksilik kislotalar tabiatda juda keng tarqalgan. Ular meva va o'simliklarda uchraydi. Ular igna, ter, siydik va qichitqi sharbatida mavjud. Bilasizmi, kislotalarning asosiy qismi hidga ega efirlarni hosil qiladi. Shunday qilib, inson teridagi sut kislotasining hidi chivinlarni o'ziga tortadi, ular buni juda uzoq masofada sezadilar. Shuning uchun, siz zerikarli chivinni qanchalik haydashga harakat qilsangiz ham, u o'z qurbonini yaxshi his qiladi. Inson teridan tashqari, sut kislotasi tuzlangan bodring va tuzlangan karam tarkibida mavjud.
Va urg'ochi maymunlar erkakni o'ziga jalb qilish uchun sirka va propion kislotasini chiqaradi. Itning sezgir burni 10-18 g / sm3 konsentratsiyaga ega bo'lgan butirik kislotani hidlaydi.
Ko'pgina o'simlik turlari sirka va butirik kislota ishlab chiqarishga qodir. Va ba'zi begona o'tlar bundan foydalanadi va moddalarni chiqarib, raqobatchilarni yo'q qiladi, ularning o'sishini bostiradi va ba'zan ularning o'limiga sabab bo'ladi.
Hindlar ham kislota ishlatgan. Dushmanni yo'q qilish uchun ular o'qlarni o'lik zahar bilan namlashdi, bu sirka kislotasining hosilasi bo'lib chiqdi.
Va bu erda tabiiy savol tug'iladi: kislotalar inson salomatligi uchun xavf tug'diradimi? Axir tabiatda keng tarqalgan va otquloq, apelsin, smorodina va malinada uchraydigan oksalat kislotasi negadir oziq-ovqat sanoatida qo'llanilishini topmagan. Ma’lum bo‘lishicha, oksalat kislota sirka kislotasidan ikki yuz baravar kuchli bo‘lib, hatto idishlarni ham korroziyaga olib kelishi mumkin, uning tuzlari esa inson tanasida to‘planib, tosh hosil qiladi.
Kislotalar inson hayotining barcha sohalarida keng qo'llanilishini topdi. Ular tibbiyot, kosmetologiya, oziq-ovqat sanoati, qishloq xo'jaligi va maishiy ehtiyojlar uchun ishlatiladi.
Tibbiy maqsadlarda sut, tartarik va askorbin kabi organik kislotalar qo'llaniladi. Ehtimol, har biringiz tanani mustahkamlash uchun S vitamini ishlatgansiz - bu askorbin kislotasi. U nafaqat immunitet tizimini mustahkamlashga yordam beradi, balki tanadan kanserogenlar va toksinlarni olib tashlash qobiliyatiga ega. Sut kislotasi koterizatsiya uchun ishlatiladi, chunki u juda gigroskopikdir. Ammo tartarik kislota engil laksatif, gidroksidi zaharlanish uchun antidot va qon quyish uchun plazma tayyorlash uchun zarur bo'lgan komponent sifatida ishlaydi.
Ammo kosmetik muolajalar muxlislari bilishlari kerakki, tsitrus mevalaridagi mevali kislotalar teriga foydali ta'sir ko'rsatadi, chunki ular chuqur kirib, terining yangilanish jarayonini tezlashtirishi mumkin. Bundan tashqari, tsitrus mevalarining hidi asab tizimiga tonik ta'sir ko'rsatadi.
Siz e'tibor berganmisiz, klyukva va lingonberries kabi rezavorlar uzoq vaqt saqlanadi va yangi bo'lib qoladi. Nega bilasizmi? Ma'lum bo'lishicha, ular tarkibida benzoik kislota mavjud bo'lib, u ajoyib konservant hisoblanadi.
Ammo qishloq xo'jaligida süksin kislotasi keng qo'llaniladi, chunki u madaniy o'simliklarning mahsuldorligini oshirish uchun ishlatilishi mumkin. Shuningdek, u o'simliklarning o'sishini rag'batlantirishi va ularning rivojlanishini tezlashtirishi mumkin.
1.Karboksilik kislotalar - bu molekulalarida bir yoki bir nechta karboksil guruhlari bo'lgan kislorod o'z ichiga olgan organik moddalar
(-C OOH ), uglerod radikali yoki vodorod atomiga bog'langan.
Karboksil guruhi ikkita funktsional guruhni o'z ichiga oladi - karbonil >C=O va gidroksil -OH, bir-biri bilan bevosita bog'langan:
2. Tasniflash
A) Molekuladagi karboksil guruhlar soni bo‘yicha
|
Ism |
Misollar |
|
1) monobazik |
Metan yangi , formik kislota Etan yangi , sirka kislotasi |
|
2) ikki asosli |
HOOC-COOH Oksalat kislotasi |
|
3) Ko'p asosli |
B) Uglevodorod radikalining tabiati bo'yicha
|
Ism |
Misollar |
|
1) Limit (to'yingan) |
HCOOH Metan yangi , formik kislota CH3COOH Etan yangi , sirka kislotasi |
|
2) Cheksiz |
Akril kislota CH2 = CHCOOH Krotonic kislota CH 3 –CH=CH–COOH Oleyk CH 3 –(CH 2) 7 –CH=CH–(CH 2) 7 –COOH Linoleik CH 3 –(CH 2) 4 –(CH=CH–CH 2) 2 –(CH 2) 6 –COOH Linolenik CH 3 –CH 2 –(CH=CH–CH 2) 3 –(CH 2) 6 –COOH |
|
3) aromatik |
C 6 H 5 COOH - benzoy kislotasi NOOS–C 6 H 4 –COOH Juftlash-tereftalik kislota |
3. Izomeriya va nomenklatura
I . Strukturaviy
A) Uglerod skeletining izomeriyasi (C.dan boshlab 4 )
B) Efirlar bilan sinflararo R - CO – O - R 1 (C 2 dan boshlab)
Masalan: C 3 H 6 O 2 uchun
CH 3 -CH 2 -COOH propion kislotasi
BILAN H 3 -CO -OCH 3 sirka kislotaning metil efiri
II . Fazoviy
A) Optik
Masalan:
B) To'yinmagan kislotalar uchun Cis-trans izomeriyasi
Misol:
4. Karbon kislotalarning nomenklaturasi
Kislotalarning sistematik nomlari tegishli uglevodorod nomi bilan qoʻshimcha qoʻshilishi bilan beriladi. -yangi va so'zlar kislota.
O'rnini bosuvchi (yoki radikal) o'rnini ko'rsatish uchun uglerod zanjirining raqamlanishi karboksil guruhining uglerod atomidan boshlanadi. Masalan, tarmoqlangan uglerod zanjiri (CH 3) 2 CH-CH 2 -COOH bo'lgan birikma deyiladi. 3-metilbutan kislotasi. Trivial nomlar organik kislotalar uchun ham keng qo'llaniladi, ular odatda birikmalar birinchi marta kashf etilgan tabiiy manbani aks ettiradi.
Ba'zi bir asosli kislotalar
|
Formula |
Kislota nomi R-COOH |
Qoldiq nomi RCOO - |
|
|
tizimli |
ahamiyatsiz |
||
|
HCOOH |
metan |
chumoli |
formatlash |
|
CH3COOH |
etan |
sirka |
asetat |
|
C2H5COOH |
propan |
propion |
propionat |
|
C3H7COOH |
butan |
moy |
butirat |
|
C4H9COOH |
pentan |
valerian |
valeratsiya |
|
C5H11COOH |
geksan |
neylon |
kaprat |
|
C15H31COOH |
heksadekan |
palmitik |
palmitat |
|
C17H35COOH |
oktadekan |
stearik |
stearat |
|
C6H5COOH |
benzolkarbon |
benzoin |
benzoat |
|
CH2 =CH-COOH |
propen |
akril |
akrilat |
Ko'p asosli kislotalar uchun qo'shimchalar qo'llaniladi -diovaya, -triovaya va hokazo.
Masalan:
HOOC-COOH- etandiyoik (oksalik) kislota;
HOOC-CH 2 -COOH - propandioik (malonik) kislota.
MONOBAZIZ KARBOKSIL KISLOTALARNI CHEKLASH
CnH 2 n +1 - COOHyokiCnH 2 nO 2
Gomologik seriyalar
|
Ism |
Formula kislotalar |
t pl. |
t kip. |
ρ |
|
|
kislotalar |
|||||
|
chumoli |
metan |
HCOOH |
100,5 |
1,22 |
|
|
sirka |
etan |
CH3COOH |
16,8 |
1,05 |
|
|
propion |
propan |
CH3CH2COOH |
0,99 |
||
|
moy |
butan |
CH3(CH2)2COOH |
0,96 |
||
Karboksil guruhining tuzilishi
Karboksil guruhi ikkita funktsional guruhni birlashtiradi - karbonil >C = O va gidroksil -OH, ular bir-biriga o'zaro ta'sir qiladi:
Karboksilik kislotalarning kislotali xossalari elektron zichligining karbonil kislorodga siljishi va natijada O-H bog'ining qo'shimcha (spirtlarga nisbatan) qutblanishi bilan bog'liq.
Suvli eritmada karboksilik kislotalar ionlarga ajraladi:
Suvda eruvchanligi va kislotalarning yuqori qaynash nuqtalari molekulalararo vodorod bog'larining hosil bo'lishi bilan bog'liq.
Molekulyar massa ortishi bilan kislotalarning suvda eruvchanligi pasayadi.
To'yingan bir asosli kislotalarning fizik xususiyatlari
Ushbu seriyaning pastki a'zolari, normal sharoitda, xarakterli o'tkir hidli suyuqliklardir. Misol uchun, etanoik (sirka) kislota xarakterli "sirka" hidiga ega. Suvsiz sirka kislotasi xona haroratida suyuqlikdir; 17 ° C da muzlaydi, "muzlik" sirka kislotasi deb ataladigan muzli moddaga aylanadi. Ushbu gomologik seriyaning o'rta vakillari viskoz, "yog'li" suyuqliklardir; C 10 dan boshlab - qattiq moddalar.
Eng oddiy aromatik kislota - benzoik kislota C 6 H 5 COOH (mp 122,4 ° C) - osongina sublimatsiya qiladi, ya'ni. suyuq holatni chetlab o'tib, gazsimon holatga aylanadi. Sovutganda, uning bug'lari kristallarga aylanadi. Bu xususiyat moddani iflosliklardan tozalash uchun ishlatiladi.
TA’RIF
Karboksilik kislotalar- molekulalari bir yoki bir nechta funktsional karboksil guruhini o'z ichiga olgan organik birikmalar - COOH, uglevodorod radikali bilan bog'liq.
Karboksil guruhi karbonil guruhidan iborat > C= O va tegishli gidroksil guruhi -OH.
Karboksilik kislotalarning umumiy formulasi R-COOH.
Karboksilik kislotalarning kislotali xossalari elektron zichligining karbonil kislorodga siljishi bilan bog'liq bo'lib, atomda qisman musbat zaryad paydo bo'lishiga olib keladi.
Natijada, O-H aloqasining qutbliligi oshadi va dissotsiatsiya jarayoni mumkin bo'ladi:
Olingan anion zaryad delokalizatsiyasi tufayli barqarorlashadi:

3 tagacha uglerod atomini o'z ichiga olgan quyi karboksilik kislotalar har qanday nisbatda suv bilan aralashadigan xarakterli o'tkir hidli rangsiz suyuqliklardir. 4-9 atomni o'z ichiga olgan ko'pchilik kislotalar yoqimsiz hidli yog'li suyuqliklardir. 10 dan ortiq vodorod atomlarini o'z ichiga olgan kislotalar suvda erimaydigan qattiq moddalardir.
Karboksilik kislotalarning suvda eruvchanligi va yuqori qaynash haroratlari molekulalararo vodorod aloqalarining shakllanishi bilan bog'liq. Qattiq holatda karboksilik kislotalar asosan siklik dimerlar shaklida bo'ladi va suyuq holatda chiziqli assotsiatsiya ham sodir bo'ladi:
Karboksilik kislotalarning turlari
Uglevodorod radikalining tuzilishiga ko'ra, karboksilik kislotalar quyidagilarga bo'linadi:
- aromatik (benzoy kislotasi)
- alifatik (to'yingan (kaproik kislota) va to'yinmagan (akril kislota))
- alitsiklik (kinik kislota)
- heterotsiklik (nikotinik kislota).
Karboksilik kislotalar karboksil guruhlar soniga qarab quyidagilarga bo'linadi.
- monobase()
- ikki asosli (oksalat kislotasi)
- polibazik (limon kislotasi).
Kislota molekulasiga boshqa funksional guruhlar (–OH, =CO, –NH2 va boshqalar) kiritilganda, birikmalarning boshqa sinflari: gidroksi, keto kislotalar va boshqalar hosil bo'ladi.
To'yingan bir asosli karboksilik kislotalarning umumiy formulasi:
BILAN n H2nO2 (n= 1,2,3...) yoki Cn H 2n+1 COOH (n = 0,1,2…)
To'yinmagan bir asosli karboksilik kislotalarning umumiy formulasi:
BILAN n H 2 n –2 O 2 (n= 1,2,3...) yoki CnH 2 n –1 COOH (n = 0,1,2…)
To'yingan ikki asosli karboksilik kislotalarning umumiy formulasi:
C n H 2n–2 O 4 (n = 2,3…)
Ayrim karboksilik kislotalarning nomlari va formulalari
|
Karboksilik kislota formulasi |
IUPAC nomi |
Arzimas ism |
|---|---|---|
|
To'yingan bir asosli karboksilik kislotalar |
||
|
To'yinmagan bir asosli karboksilik kislotalar |
||
|
Ikki asosli karboksilik kislotalar |
||
Muammoni hal qilishga misollar
MISOL 1
| Mashq qilish | Imzosiz uchta bir xil probirkada uchta kislota mavjud: chumoli, sirka va xlorid. Ularning kimyoviy xossalaridagi farqlardan kelib chiqib, har bir probirkada qaysi kislota borligini qanday aniqlash mumkin? |
| Yechim | Chumoli kislota ham ba'zi xususiyatlarni (qaytaruvchi) namoyon qiladi. Shuning uchun uni, masalan, mis (II) gidroksid bilan reaksiyaga kirishish orqali aniqlash mumkin; chumoli kislotasi bo'lsa, qizil mis (I) oksidi hosil bo'ladi: Qolgan kislotalarni kumush nitrat bilan reaksiyaga kirishish orqali ajratish mumkin. Xlorid kislotasi bo'lsa, kumush xloridning oq cho'kmasi cho'kadi: Kumush asetat suvda eriydi, shuning uchun probirkada hech qanday o'zgarishlar bo'lmaydi. Shunday qilib, qolgan probirkada sirka kislotasi mavjud. |
2-MISA
| Mashq qilish | Og'irligi 2,64 g bo'lgan namunani gidrolizlashda 1,38 g spirt va 1,8 g bir asosli karboksilik kislota ajralib chiqishini aniqlang. |
| Yechim | Turli xil miqdordagi uglerod atomlariga ega spirt va kislotadan tashkil topgan efirning umumiy formulasi: Shunday qilib, alkogol formulasi: va kislota formulasi: Ester gidrolizi tenglamasini yozamiz: Moddalar massasining saqlanish qonuniga muvofiq reaksiya mahsulotlarining massasi boshlang`ich moddalar massasiga teng. Keling, massani hisoblaymiz: M(kislota) + m(spirt) – m(efir) g Keling, suv moddasining miqdorini hisoblaymiz: Reaksiya tenglamasiga ko'ra n(kislota) = n(spirt) mol |
 Jismlarning tortishish kuchi ta'sirida harakati
Jismlarning tortishish kuchi ta'sirida harakati Troplar va stilistik figuralar
Troplar va stilistik figuralar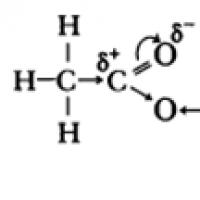 §12. Karboksilik kislotalar. Karboksilik kislotalar: fizik xossalari. Karboksilik kislotalarning tuzlari Eng oddiy karboksilik kislota formikdir
§12. Karboksilik kislotalar. Karboksilik kislotalar: fizik xossalari. Karboksilik kislotalarning tuzlari Eng oddiy karboksilik kislota formikdir Sobiq qiz do'sti bilan suhbat
Sobiq qiz do'sti bilan suhbat Nega eng yaxshi do'stingiz, sobiq do'stingiz yoki bolalikdagi do'stingiz haqida orzu qilasiz?
Nega eng yaxshi do'stingiz, sobiq do'stingiz yoki bolalikdagi do'stingiz haqida orzu qilasiz? Homilador ayolning tush talqini bolani orzu qiladi
Homilador ayolning tush talqini bolani orzu qiladi Nega uchqun oqimi haqida orzu qilasiz? Nega uchqunlar haqida orzu qilasiz? Ular tush kitoblarida nima yozadilar
Nega uchqun oqimi haqida orzu qilasiz? Nega uchqunlar haqida orzu qilasiz? Ular tush kitoblarida nima yozadilar