Открытый урок по химии скорость химической реакции. Урок "скорость химических реакций" план-конспект урока на тему. I. Организация начала занятия
Цель урока: способствовать формированию понятия о скорости химической реакциичерез использование информационно-коммуникативной технологии.
Задачи урока:
- освоение важнейших знаний гомогенной и гетерогенной системе, влиянии на скорость реакции природы реагирующих веществ, их концентрации, температуры, катализатора;
- способствовать формированию оперативно-контрольного умения и умение пользоваться компьютером через работу со слайдами;
- воспитания отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры;
- овладение умениями наблюдать химические явления, производить расчеты на основе химических формул веществ и уравнений химических реакций.
Материально-техническая база и оснащение:
Мультимедийный проектор, компьютер, железная проволока, хлорид меди (II), цинк (гранулы), соляная кислота (1:10) и (1:3), оксид меди (II), азотная кислота, спиртовка, пероксид водорода, лучинка, оксид марганца (IY), пробирки, стеклянная палочка.
Дидактическое обеспечение: слайды, диск с обучающей программой "Химия.8класс", сигнальные карточки.
Тип урока: изучение нового материала.
Эпиграф урока:
"Нам необыкновенно повезло, что мы
живем в век, когда еще можно
делать открытия"
Ход урока
| Этап урока | Деятельность учителя | Деятельность ученика |
| 1. Ориентировочно-мотивационный этап (инициация урока, объявление темы, цели, задач, начальные записи) | Учитель:
"Ребята, как вы понимаете
слово скорость? При изучении, каких предметов вы сталкивались с понятием скорость? Как вы думаете, применимо ли это понятие в курсе изучения предмета химии? Какое практическое значение имеет знание понятия скорость химической реакции? |
Учащиеся:
отвечают на вопросы,
формулируют задачи
|
| 2. Операционно-исследовательский этап (работа учащихся групповая и индивидуальная по выполнению заданий) | Учитель:
дает понятиескорости
химической реакции, учащиеся 10 минут работают с
обучающей компьютерной программой, раздает
инструкции по выполнению лабораторной работы в
парах, времени дается 15 минут (смотреть приложение) |
Учащиеся: записывают тему урока в тетрадь, после вводного слова учителя, работают с обучающей компьютерной программой: "Химия. 8 класс". По инструкции выполняют лабораторную работу, ведут записи в тетради. |
| 3. Этап первичного закрепления в обобщающей беседе. | Учитель
задает вопросы: Что определяет понятие скорость химической реакции? - Какой формулой выражается скорость химической реакции? Какие химические системы являются гомогенными и гетерогенными? Какие факторы влияют на скорость химических реакций? Какими химическими реакциями вы доказали эти положения? Что общего между понятиями скорость движения и скорость химической реакции? |
Учащиеся отвечают на вопросы учителя. |
| 4. Рефлексивно- оценочный этап (первичный контроль: экспресс - опрос) | Учитель проводит экспресс
- опрос:
Верно ли, что: :скорость химической реакции определяется изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени? :скорость химической реакции измеряется: моль/лс? :скорость химической реакции не зависит от температуры? :гетерогенными называют реакции, которые идут между веществами в неоднородной среде? :при повышении температуры на каждые 10° С скорость реакции увеличивается в 2-4 раза? |
Учащиеся
готовят сигнальные
карточки. Зеленая означает "да", красная - "нет", желтая - "сомневаюсь". |
| 5. Постановка домашнего задания. | Предлагается учащимся: 29, 30, 31, стр. 128 упр.1, стр.125 упр.1, 5, | Учащиеся записывают домашнее задание в дневник. |
| 6. Подведение итогов. | Учитель подводит итог урока, проводит рефлексию: если ребята выполнили поставленные задачи, поднимите красную карточку, если остались некоторые вопросы - зеленую, если не усвоили больше половины - желтую. Оценивает и комментирует работу наиболее активных учащихся | Учащиеся поднимают сигнальные карточки. |
Тема Скорость химических реакций и факторы на нее влияющие.
Тип урока: изучение нового материала
Вид урока: лекция
Класс : 9
Учитель химии ГБОУ СОШ № 1 города Байконур Гузикова Оксана Александровна
Цели урока.
Обучающие:
Дать понятие о скорости химических реакций и единицах ее измерения. Показать влияние на скорость реакций таких факторов как природа реагирующих веществ, их концентрация, площадь соприкосновения, использование катализаторов и температура. Познакомить учащихся с классификацией химических реакций по признаку фазности (агрегатного состояния): гомо- и гетерогенные.
Развивающие:
Привитие навыков определения скорости химической реакции, используя закон действующих масс. Продолжение развитие общеучебных и предметных умений: анализировать, сравнивать, делать выводы. Развитие логико-смыслового мышления учащихся, памяти, химического языка.
Воспитательные:
Расширение кругозора, умение применять полученные знания на практике, самоусвоение лекционного материала. Воспитание культуры умственного труда.
Оборудование и реактивы:
Плакат по технике безопасности, формулы на ПП, проектор, лист-памятка с планом лекции.
Для демонстрационного эксперимента: раствор тиосульфата натрия, раствор серной кислоты, вода, пробирки.
Для лабораторного эксперимента: раствор соляной кислоты, порошок цинка, гранулы цинка, магний, железо, пробирки.
ДЕВИЗ УРОКА:
«Химическое превращение, химическая реакция – есть главный предмет химии» Н.Н. Семенов.
ОРГАНИЗАЦИОННЫЙ МОМЕНТ
Учитель
Здравствуйте ребята, садитесь.
Учитель
Дежурные назовите отсутствующих сегодня на уроке.
(учитель отмечает отсутствующих на уроке).
ОБЪЯСНЕНИЕ НОВОГО МАТЕРИАЛА
Учитель
Сегодня мы переходим к изучению нового раздела «Скорость химических реакций. Химическое равновесие».
На этом уроке мы поговорим о том, как определяется скорость химической реакции, и какие факторы могут ее изменить.
УЧИТЕЛЬ
На доске написаны две химические реакции.
Взаимодействие раствора соляной кислоты и цинка.
Взаимодействие раствора серной кислоты и раствора хлорида бария.
Учитель
Чем они отличаются?
Ученик
Они отличаются тем, что одна протекает между растворами, а вот во второй есть и раствор – соляная кислота, и металл – цинк.
Учитель
Значит, первая реакция протекает в одной среде, и эта реакция называется гомогенной, а во второй реакции принимают участие вещества разного агрегатного состояния, она носит название – гетерогенная. Примером гомогенных сред будут газ-газ, жидкость-жидкость. Перечислите примеры гетерогенных сред.
УЧЕНИК
Газ – твердое вещество, газ – жидкость, твердое вещество - газ.
УЧИТЕЛЬ
Правильно. Мы определим скорость химической реакции, запишем определение и соответствующие формулы.
Предмет изучения химии – химическая реакция. В результате химической реакции исчезают одни и образуются другие вещества. В процессе реакции изменяются количества вещества как реагентов (исходных веществ), так и продуктов (конечных веществ). Скорость этого изменения называется скоростью химической реакции. Химическая кинетика – учение о скоростях и механизмах химических реакций. (запишем это определение)
Таким образом, скорость химической реакции можно описать уравнением
r = / (1)
где r – скорость реакции (от англ. rate – скорость процесса, в отличие от ранее используемого обозначения для скорости реакции - velocity – скорость перемещения), (прописная греч. дельта ) – синоним слов «конечное изменение», (греч. ню ) – количество (моль) вещества-реагента или вещества продукта, (греч. тау ) – время (с), за которое произошло данное изменение.
При таком определении скорость реакции зависит от того, количество какого из участников реакции мы наблюдаем и измеряем. Очевидно, что для реакции, например:
2 H 2 + O 2 =2 H 2 O .
количество вещества превращающегося водорода в два раза больше, чем кислорода. Поэтому
r (H 2 ) = 2 r (O 2 ) = r (H 2 O ).
Уравнение реакции связывает величины скоростей, определенных по любому из веществ. Поэтому выбор последнего зависит от удобства и легкости экспериментального измерения его количества в реакционной системе.
На качественном уровне реакции могут быть классифицированы на быстрые, для измерения скорости которых необходимы специальные методы, например, взрыв гремучего газа, реакции в растворах электролитов; медленные, для измерения скорости которых нужны большие промежутки времени, например коррозия железа; и реакции, за течением которых мы можем наблюдать непосредственно, например взаимодействие цинка с соляной кислотой.
Описываемая уравнением (1) скорость реакции зависит от количеств взятых веществ-реагентов. Если мы проводим одну и ту же реакцию с разными объемами или поверхностями соприкосновения реагентов, то для одной и той же реакции мы получим разные значения скорости, тем большие, чем больше вещества взято или чем лучше оно измельчено. Поэтому используют другое определение скорости реакции.
Скорость химической реакции – это изменение количества вещества какого-либо участка реакции в единицу времени в единице реакционного пространства (запишем это определение).
В гомогенной системе V системы (в газовой фазе или растворе). В такой реакции единицей реакционного пространства является единица объема, и если этот объем не изменяется в процессе реакции, то уравнение имеет вид:
V = c / t (2)
где с – молярная концентрация вещества (моль/л).
Скорость реакции – изменение концентрации вещества в единицу времени.
В гетерогенной системе ( например, при горении твердого тела в газе или при взаимодействии металла с кислотой) реакция происходит на границе раздела между компонентами. Если площадь этой границы S , то уравнение скорости имеет вид:
V = n / S t (3)
Очевидно, что при таком определении (см. уравнения (2) и (3)) величина скорости реакции не зависит от объема в гомогенной системе и от площади соприкосновения реагентов (степени измельчения) в гетерогенной системе.
Какие же факторы влияют на скорость химической реакции?
ЗАПИШЕМ ОСНОВНЫЕ
Природа реагирующих веществ.
Влияние температуры.
Наличие катализатора.
На каждый случай приведем пример.
1. Влияние природы реагентов
Первым, и достаточно очевидным, фактором, определяющим скорость реакции, является природа реагентов. Выше на этой основе мы привели примеры реакций, текущих с разной скоростью.
Теперь проведем опыт, который экспериментально докажет это.
Учитель предлагает ребятам выполнить лабораторный опыт.
Для этого в 3 пробирки наливаем 1-2 мл раствора соляной кислоты и опускаем в каждую примерно по одинаковому кусочку металла: в первую – магний, во вторую – цинк, а в третью – железо.
Учитель
Во всех ли пробирках скорость выделения газа одинакова?
Ученик
Нет, в пробирках интенсивность выделения пузырьков разная. В первой пробирке газ выделяется очень быстро, во второй медленней, а в третье еще медленнее.
Учитель
Сделаем вывод
Ученик
Скорость химической реакции зависит от природы реагирующих веществ.
2. Влияние концентраций реагентов
Второй, и тоже достаточно очевидный, фактор – концентрация реагентов.
Проведем опыт
Учитель проводит демонстрационный опыт.
В три пробирки наливаем раствор тиосульфата натрия. В первую – 5 мл, во вторую – 2,5 мл, в третью - 1 мл. Далее во вторую и третью пробирки добавим по 5 мл воды. Затем вовсе пробирки, начиная с третьей, добавляем по 3 мл раствора серной кислоты. По времени появления и интенсивности выделившейся коллоидной серы и судят о влиянии концентрации тиосульфата натрия на скорость реакции.
Ученик
Скорость химической реакции зависит от концентрации реагентов
Учитель
А почему так происходит? Чем выше концентрация вещества, тем больше частиц в единице объема, тем чаще они сталкиваются. Количество это выражается так называемым законом действующих масс – скорость реакции пропорциональна концентрациям реагентов в некоторых степенях. Например, для следующих ниже уравнений реакций выражения скорости такие:
A = X , r = kc A ;
A + B = X, r = kc A c B ;
A + 2B = X, r = kc A c B c B = kc A c B 2 .
Величина k – коэффициент пропорциональности – называется константой скорости реакции и не зависит от концентраций. Численно этот коэффициент равен скорости реакций, если произведение концентраций реагентов равно 1. Когда сравнивают скорости разных реакций, то сравнивают именно их константы скоростей.
Важно отметить, что показатели степеней при концентрациях в приведенных ниже выражениях для скоростей химических реакций равны стехиометрическим коэффициентам только в редких случаях, когда реакция протекает в одну стадию (для так называемых элементарных реакций). На самом деле отдельная химическая реакция является такой же абстракцией, как и совершенно чистое химическое вещество. Другими словами, реальные химические превращения практически всегда включают в себя несколько реакций.
Скорость реакций, протекающих в несколько последовательных стадий, определяется самой медленной из этих стадий. Вспомним арабскую поговорку: «Караван идет со скоростью самого медленного верблюда».
Например, реакция
2 Fe 2+ + H 2 O 2 = 2 FeOH 2+
протекает по следующим стадиям:
1) 2 Fe 2+ + H 2 O 2 = 2 FeOH 2+ + OH .
k 1 = 60 л/(моль . с);
2) OH . + Fe 2+ = FeOH 2+ , k 2 = 60 000 л/(моль . с).
Более медленная стадия – первая. Поэтому уравнение скорости данной реакции –
r = k 1 c (Fe 2+ ) c (H 2 O 2 ),
а не r = kc 2 (Fe 2+ ) c (H 2 O 2 ).
О таких сложных процессах мы будем еще говорить более подробно в 11 классе.
3. Влияние температуры.
Учитель
Влияние температуры на протекание химической реакции двояко. Во- первых температура может влиять на состав продуктов, а во-вторых - подавляющее большинство реакций ускоряются при увеличении температуры. Почему? Потому что с повышением температуры быстро растет число, так называемых «активных» молекул, т.е. молекул, обладающих энергией, большей, чем энергия активации.
Энергия активации – разность между средней энергией молекул при данной температуре и той энергией, которой они должны обладать, чтобы вступить в химические реакции.
Влияние температуры на скорость химической реакции иллюстрирует правило Вант – Гоффа
ОПРЕДЕЛЕНИЕ
При изменении температуры реакции на каждые 10 градусов скорость реакции изменяется в 2-4 раза (Формула на доске)
Учитель
Если температуру увеличивать, что произойдет со скоростью химической реакции.
Ученик
Скорость реакции увеличится при повышении температуры на каждые 10 градусов в 2-4 раза.
Учитель
Если температуру уменьшить, что произойдет со скоростью химической реакции.
Ученик
Скорость уменьшится при понижении температуры на каждые 10 градусов в 2-4 раза.
4. Площадь поверхности соприкосновения.
Учитель
Теперь перейдем к площади поверхности соприкосновения.
Лабораторный опыт. Памятка по соблюдению правил техники безопасности.
В две пробирки нальем соляную кислоту, в первую добавим порошок цинка, а во вторую гранулу. Запишите уравнение реакции. Определите ее тип. Где реакция проходит быстрее? Почему?
Ученик записывает реакцию. Она является реакцией замещения.
Реакция проходит быстрее в первой пробирке. Ведь там больше площадь поверхности соприкосновения.
Учитель
Правильно.
5. Катализатор
Последний фактор – это наличие специальных веществ - катализаторов. Химическая реакция – сложный процесс, в котором могут принимать участие не только вещества реагенты, но и другие присутствующие в системе вещества. Если они заметно изменяют скорость химической реакции, то их и называют катализаторами. Об этих веществах и о катализе мы подробно погорим на следующем уроке.
ЗАКРЕПЛЕНИЕ МАТЕРИАЛА
Учитель
Какую новую величину мы изучили на сегодняшнем уроке?
Ученик
Мы ознакомились со скоростью химической реакции.
Учитель
Какие виды сред вы узнали?
Ученик
Гомогенную и гетерогенную.
Учитель
Одинаково ли определяется скорость в разных средах?
Ученик
Нет, по разному.
Учитель
Как определяется скорость в гомогенной среде?
Ученик
В гомогенной системе реакция происходит во всем объеме V системы (в газовой фазе или растворе). В такой реакции единицей реакционного пространства является единица объема, и если этот объем не изменяется в процессе реакции
Учитель
Учитель
Как определяется скорость в гетерогенной среде?
В гетерогенной системе реакция происходит на границе раздела между компонентами. Если площадь этой границы S .
Учитель
В каких единицах она измеряется?
Какие факторы влияют на скорость химической реакции? Перечислите их.
Ученик
Природа реагирующих веществ.
Концентрация реагирующих веществ.
Температура.
Площадь поверхности соприкосновения.
Наличие катализатора.
IY . ОБОБЩЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА
Сегодня на уроке мы изучили понятие скорость химической реакции. Рассмотрели как определяется скорость химической реакции в гомогенной и гетерогенной системах. Определили факторы, которые могут повлиять на скорость химической реакции.
Y . ДОМАШНЕЕ ЗАДАНИЕ
Основные определения дома выучить. А так же на столах у вас есть задания, они трехуровневые. Как всегда, каждый для себя выбирает соответствующий уровень, который на данном этапе обучения вам под силу выполнить.
План урок по теме «Скорость химических реакций»,
9 класс
учитель химии О.В. Залозных
Цель: познакомить учащихся с понятием «скорость химических реакций» и факторами, от которых она зависит.
Задачи:
Образовательные: дать понятие о скорости химических реакций и единицах ее измерения. Показать значение ее в природе и человеческой деятельности; установить факторы, влияющие на скорость реакции. Углубить знания о катализаторах. Познакомить учащихся с классификацией химических реакций по признаку фазности (агрегатного состояния): гомо и гетерогенных.
Развивающие: развивать у учащихся навыки управления своей учебной деятельностью; развитие самостоятельного мышления; совершенствование практических навыков при выполнении лабораторных опытов; развитие умения выделять главное в изучаемом материале, наблюдать, сравнивать, анализировать, делать выводы.
Воспитывающие: формировать коммуникативные умения в ходе парной и коллективной работы; развивать самостоятельность; стремление к цели.
Тип урока: урок изучения нового материала
Ресурсы урока: учебники и учебные пособия разных авторов, электронное учебное приложение к учебнику О.С.Габриеляна (9класс), компьютер, мультимедийный проектор
Оборудование: штатив с пробирками, спиртовка, пробиркодержатель.
Реактивы : цинк, магний, медь, раствор серной кислоты, вода, железо (гвоздь и опилки), пероксид водорода, оксид марганца (IV).
Методы и методические приемы: самостоятельная работа с текстом, индивидуальная работа, работа в группах, заполнение таблицы, выполнение тестовых заданий, работа в парах.
Техника безопасности : работа со спиртовкой, раствором серной кислоты
Планируемы результаты:
Предметные :
● знать определение скорости химических реакций
● знать факторы, влияющие на скорость химических реакций
Метапредметные :
● уметь слушать собеседника и вести диалог; уметь признавать возможность существования различных точек зрения
● использовать различные способы поиска, сбора, обработки, анализа и интерпретации информации в соответствии с задачами урока
● уметь излагать свое мнение и аргументировать свою точку зрения
● активное использование речевых средств, информационных средств и ИКТ для решения коммуникативных и познавательных задач
Личностные :
●развивать навыки сотрудничества с учителем и сверстниками в разных ситуациях; умения не создавать конфликтов и находить выходы из спорных ситуаций
●формировать уважительное отношение к чужому мнению
● осуществлять самоконтроль, взаимоконтроль
● оценивать свои достижения на уроке
Ход урока
Организационный этап
Актуализация знаний
Почти неподвижности мука -
Мчаться куда-то со скоростью звука,
Зная прекрасно, что есть уже где-то
Со скоростью
Леонид Мартынов
Ребята, сегодня на уроке у нас очень интересная и очень важная в изучении химических реакций тема. Но начать урок я хочу с интересных фактов:
Скорость лопания мыльного пузыря составляет 0.001 секунды.
Наполеон читал со скоростью две тысячи слов в минуту 12.000 знаков.
Бальзак прочитывал 200 страниц за полчаса.
Скорость ветра от 10 до 15 миль в час.
При кипячении воды, ее молекулы движутся со скоростью 650 метров в секунду
Ураган может двигаться со скоростью 125 миль в час.
Ночью волосы растут медленно. Днём рост волос ускоряется. Между 10 и 11 часами скорость роста самая большая. Пик роста наступает между 14 и 16 часами.
Кровь движется быстро в артериях (500 мм/с), медленнее в венах(150 мм/с), и еще медленнее в капиллярах(1мм/с).
Ребята скажите, что объединяет эти научные факты? (в них говорится о скорости).
Следовательно, о чем мы будем говорить сегодня на уроке? (скорости)
Правильно. Сегодня мы будем говорить о скорости. Но не о той, с которой вы знакомились на уроках физики и математики, а о скорости химических реакций. Итак, тема сегодняшнего урока «Скорость химических реакций».
Как вы думаете, какие вопросы, помогут нам раскрыть тему урока?
(1. Что такое скорость химических реакций? 2. От чего зависит скорость химических реакций?)
Организация познавательной деятельности
А что же такое скорость химической реакции? Чтобы ответить на этот вопрос, предлагаю вам самостоятельно поработать с учебниками и учебными пособиями по химии разных авторов, которые имеются у вас на столах (учащиеся работают с учебникам, выписывают определение понятия «скорость химической реакции» и формулу для ее расчета).
Затем в ходе фронтальной беседы обсуждаем основные вопросы:
Что такое скорость химических реакций? (двое учащихся читают определения из разных источников)
В каких единицах измеряется скорость реакций?
Итак, одна проблема решена. Теперь перейдем ко второму вопросу: «Отчего зависит скорость химических реакций?»
В ходе работы с литературой вы встретились с факторами, влияющими на скорость химической реакции. Какие это факторы? (2 человека перечисляют факторы, можно записать на доске)
А сейчас вы проведете лабораторную работу, в ходе которой определите, как тот или иной фактор влияет на скорость химических реакций. Для этого вы заранее поделились на 5 групп. Каждая группе имеет свое задание. Вам необходимо точно по инструкции провести эксперимент, ответить на предложенные вопросы, заполнить таблицу. Для нахождения ответов на вопросы вы можете воспользоваться имеющейся у вас дополнительной литературой. Не забывайте соблюдать правила техники безопасности. После окончания исследования мы обсудим ваши результаты (учащиеся работают согласно инструктивным картам)
Начнем. В зависимости от того, какие именно вещества реагируют, реакции могут протекать очень быстро, да же со взрывом, с умеренной скоростью или крайне медленно. Поэтому одним из факторов, влияющим на скорость реакции является природа реагирующих веществ. Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов друг на друга. А как происходит это влияние, нам сейчас расскажет (выступление группы)
Согласно химической кинетики новые вещества образуются при взаимодействии молекул друг с другом. Поэтому, чем больше частиц в объеме, тем чаще они сталкиваются во времени. Следовательно, концентрации реагирующих веществ так же влияет скорость химических реакций. А каково это влияние нам расскажет (выступление группы)
Следующий фактор, на котором мы остановимся – это температура (выступление учащегося).
Для подавляющего большинства химически реакций их скорость с ростом температуры увеличивается. Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
при увеличении температуры на каждые 10 0 , скорость реакции увеличивается в 2-4 раза.
Это правило можно отобразить с помощью формулы:
ʋ t 2 = ʋ t 1 γ t 2 - t 1 /10
где, γ – температурный коэффициент, который зависит от природы реагирующих веществ и от катализатора.
Следующий фактор, который нас интересует – это поверхность соприкосновение реагирующих веществ (выступление учащегося).
О влиянии данного фактора на скорость химических реакций можно только в том случае, если реакция гетерогенная, т.е. реагирующие вещества находятся в разных агрегатных состояниях.
Если же реагирующие вещества находятся в одинаковом агрегатном состоянии, т.е. реакция гомогенная, то поверхность соприкосновения реагирующих веществ на скорость реакции не влияет.
У нас с вами остался последний фактор, влияющий на скорость химической реакции – это влияние катализатора. Давайте вспомним из курса биологии, какие вещества мы называем катализаторами.
Катализаторы – это вещества, изменяющие скорость реакции, но сами при этом остающиеся неизменными.
В зависимости от того, как катализаторы влияют на скорость реакции, их делят на две группы:
«+» катализаторы – увеличивают скорость химических реакций. Сюда можно отнести большинство биологические катализаторы – ферментов.
«-» катализаторы или ингибиторы – уменьшают скорость химических реакций. Сюда можно отнести антиоксиданты – это природные или синтетические ингибиторы, которые способны замедлять процесс окисления. Их используют для того, чтобы не портились продукты. Например, аскорбиновая кислота.
Мы рассмотрели с вами все факторы, влияющие на скорость химических реакций. Давайте еще раз их назовем.
Первичное закрепление
Выполнение тестового задания (по вариантам), решение задач
Ключ к тесту: 1 вариант – 1-1; 2-1; 3-4; 4-4; 5-3; 6-2; В1 – 3421; В2-2
2 вариант - 1-2; 2-1; 3-2; 4-4; 5-2; 6-3; В1 – 3412; В2-1
Задача: определите, как изменится скорость некоторой реакции:
а) при повышении температуры от 10° до 50° С;
б) при понижении температуры от 10° до 0° С.
Температурный коэффициент реакции равен 3.
Домашнее задание
повторить конспект, заполнить последнюю графу таблицы; индивидуальное задание: на «3» - найти интересные факты по теме «Скорость химической реакции»; на «4» - составить тест по теме «Скорость химической реакции»; на «5» - придумать задачу по теме «Скорость химической реакции»
Рефлексия
В конце урока обучающимся предлагается закончить предложения:
Сегодня я узнал…
Я удивился…
Теперь я умею…
Я хотел бы…
Наибольшее затруднение вызвало…
Своей работой на уроке я … (доволен /не доволен)
Ребята, вы сегодня все прекрасно работали на уроке в роли исследователей. Я вижу, что вы усвоили тему урока, а это было самое главное в нашей с вами совместной работе. Спасибо вам за урок.
Инструктивная карта №1
Зависимость скорости реакции от природы реагирующих веществ
Задание: в три пробирки налейте по 1мл кислоты. В первую пробирку поместите магний, во вторую – цинк, а в третью – медь. Сравните скорость взаимодействия металлов с кислотой. В чем, по- вашему, причина в различной скорости реакции взаимодействия кислоты с металлами. Заполните таблицу по проделанному опыту.
| № пробирки | условия опыта | Наблюдения | |
Инструктивная карта №2
Зависимость скорости реакции от концентрации реагирующих веществ
Задание: в 2 пробирки налейте по 1мл кислоты. В первую пробирку добавьте 0,5мл воды. В обе пробирки поместите 2-3 гранулы цинка. В какой из пробирок выделение газа началось быстрее? Почему? Сделайте вывод о зависимости скорости реакции от концентрации реагирующих веществ. Заполните таблицу по проделанному опыту.
| № пробирки | условия опыта | Наблюдения | |
Инструктивная карта №3
Зависимость скорости реакции от температуры
Задание: в две пробирки налейте по 1мл кислоты. В обе пробирки поместите 2-3 гранулы цинка. Одну из пробирок нагрейте. В какой из пробирок выделение газа протекает интенсивнее? Почему? Сделайте вывод о зависимости скорости реакции от температуры. Заполните таблицу по проделанному опыту.
| № пробирки | условия опыта | Наблюдения | |
Инструктивная карта №4
Зависимость скорости реакции от поверхности соприкосновения реагирующих веществ (для гетерогенных реакций)
Задание: в две пробирки налейте по 1мл кислоты. В одну пробирку поместите железный гвоздь, а в другую – железные опилки. В какой из пробирок реакция идет быстрее? Почему? Сделайте вывод о зависимости скорости реакции от поверхности соприкосновения реагирующих веществ. Заполните таблицу по проделанному опыту.
| № пробирки | условия опыта | Наблюдения | |
Инструктивная карта №5
Зависимость скорости реакции от катализаторов
Задание: в две пробирки налейте по 1мл пероксида водорода. В одну пробирку осторожно насыпьте несколько кристалликов оксида марганца (IV). В какой из пробирок наблюдается бурное выделение газа? Почему? Какую роль в этой реакции выполняет оксид марганца? Сделайте вывод о зависимости скорости реакции от катализаторов. Заполните таблицу по проделанному опыту.
| № пробирки | условия опыта | Наблюдения | |
| Факторы, влияющие на скорость | Выводы |
| Природа реагирующих веществ | |
| Концентрация реагирующих веществ | |
| Температура | |
| Поверхность соприкосновения реагирующих веществ | |
| Катализаторы |
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ 6.4.2 № 86
Пояснительная записка.
Данная разработка учебного занятия относится к разделу «Химические превращения», изучаемого в 11 классе. В ходе подготовки урока по теме были соблюдены общие требования к формированию занятий, таких как соотношение принципов наглядности, доступности и научности предлагаемого материала, соблюдение культуры безопасного обращения с веществами и привитие целостного миропонимания химических явлений и процессов, прогнозирования и планирования результатов урока.
Четко сформулированные цели и задачи урока реализуются использованием различных методов, форм и методических приемов обучения. Предложен урок открытия новых знаний с элементами исследования, поскольку на данном этапе обучающиеся получат достаточное количество теоретических понятий, которые закрепляются в ходе выполнения ими практической части урока. Использованы следующие формы организации учебной деятельности: фронтальная, групповая, индивидуальная. Учителю отводится роль в регулировании процесса обучения, направление обучающихся, контроле за их наблюдениями, коррекции и дополнении полученных ими результатов и анализе последних.
Планируемые результаты: сформировать основные понятия по теме, понимать значение влияния различных факторов на скорость химической реакции. Понимать возможность управления химической реакции с помощью изменениия условий ее протекания. Развить умение планировать и осуществлять химический эксперимент, умело фиксируя результаты, и анализировать их. Осознавать целостность протекающих химических процессов и явлений, осуществлять варьирование понятиями в применении к явлениям экологической и межпредметной сфер.
Тема урока : скорость химических реакций.
Цели урока : изучить сущность понятия: скорость химических реакций, выявить зависимость этой величины от различных внешних факторов.
Задачи урока:
обучающая Что такое скорость химических реакций и от каких факторов она зависит.
развивающая Обучающиеся учатся обрабатывать и анализировать экспериментальные данные, выявляют сущность химической реакции, выясняют взаимосвязь между скоростью химической реакции и внешними факторами
воспитательная Обучающиеся развивают коммуникативные умения в ходе парной, коллективной работы. Привлекают средства химии к пониманию процессов, происходящих в окружающем мире. В ходе практической работы осознают обязательность точного выполнения инструкций для получения результата.
Тип урока : урок открытия новых знаний с элементами исследования.
Метод обучения : частично поисковый , форма организации : индивидуальная, групповая, фронтальная, коллективная
Литература для учителя и обучающегося:
2. Г.Е.Рудзитис, Ф.Г.Фельдман Химия. 11 класс. Базовый уровень/ Учебник для общеобразовательный учреждений.
3. Гара Н.Н. Уроки химии 11 кл.
4. Гара Н.Н., Габрусева Н.И. Химия. Задачник с «помощником» 11 кл.
Средства обучения: химические вещества и оборудование для опытов, мультимедийная приставка, компьютер.
Этапы урока | Обоснование деятельности учителя | Прогнозируемая деятельность обучающихся | Формируемые УУД |
|||||||||||||||||||||||
Взаимное приветствие обучающихся и учителя; фиксация отсутствующих; проверка готовности обучающихся к уроку. | Подготовить обучающихся к работе | Готовность класса к работе | Готовность к сотрудничеству и сотворчеству с учителем |
|||||||||||||||||||||||
Вспомним:
| Подвести обучающихся к рассмотрению цели и задач урока. Обеспечить мотивацию и принятие обучающимися задачи урока При обсуждении вопроса (2) необходимо подчеркнуть, что химическая реакция возможна только при столкновении молекул | Активная работа обучающихся показывает их готовность к восприятию темы урока Из личного жизненного опыта обучающиеся предполагают, что продолжительность различных реакций разная | Уметь участвовать в коллективном обсуждении, аргументировать свою позицию. Уметь пользоваться знаниями и бытовыми наблюдениями |
|||||||||||||||||||||||
Записываем тему урока «Скорость химических реакций». Формулируем задачу урока: выяснить, что такое скорость химической реакции и от каких факторов она зависит. В ходе урока мы познакомимся с теорией вопроса «скорость химической реакции». Затем на практике подтвердим некоторые наши теоретические предположения . | Озвучить цель урока и примерный план его проведения. | |||||||||||||||||||||||||
Рассмотрим два примера. На столе – две пробирки, в одной – раствор щелочи (NaOH), в другой – гвоздь; в обе пробирки приливаем раствор CuSO 4 . Что мы видим? В первой пробирке реакция произошла мгновенно, во второй – видимых изменений пока нет. Составим уравнения реакций (два обучающихся записывают на доске уравнения):
Cu 2+ + 2OH - = Cu(OH) 2
Fe 0 + Cu 2+ = Fe 2+ + Cu 0 Отметим, что реакция 1) – гомогенная, а реакция 2) – гетерогенная. Это важно для нас. А как долго длится реакция и от чего это зависит? На эти вопросы мы попытаемся ответить в ходе нашего урока. Учение о скоростях и механизмах химических реакций называется химической кинетикой . | Необходимо подтвердить предположения обучающихся химическим экспериментом | По результатам демонстрационного эксперимента обучающиеся убеждаются в справедливости своих предположений | Уметь самостоятельно либо с помощью учителя фиксировать результаты демонстрации, делать умозаключение, планировать возможный этап изучения. Уметь записывать уравнения химических реакций. |
|||||||||||||||||||||||
Обратимся к понятию «скорость». Вам известны такие сочетания, как скорость движения, скорость чтения, скорость наполнения бассейна и т. д. В общем случае, что такое скорость? Изменение какого-либо фактора за единицу времени. А какой же фактор изменяется, когда речь идет о скорости реакции? Мы уже сказали, что химическая реакция происходит при столкновении частиц. Тогда, очевидно, что скорость реакции тем больше, чем чаще сталкиваются частицы. При столкновении частиц исходных веществ происходит образование новых частиц - продуктов реакции. Что же изменяется с течением времени в химической реакции? Изменяется количество исходных веществ и изменяется количество продуктов реакции. Если мы отнесем количество вещества к единице объема, мы получим молярную концентрацию вещества. Молярная концентрация вещества измеряется в моль/л. чтобы определить скорость реакции, необходимо иметь данные об измении концентрации какого-либо компонента реакции через определенные промежутки времени. На доске записано уравнение реакции I 2 (газ) + H 2 (газ) + 2HI(газ) и приведена таблица изменения концентрации йода во времени (правый столбец – изменение концентрации HI пока не заполнен) | Обеспечить осмысленное восприятие знаний Установить фактор, по которому можно судить о скорости реакции Введение понятия о молярной концентрации и единицах ее измерения | Активные действия обучающихся с объектом изучения В ходе беседы обучающиеся приходят к выводу о связи скорости реакции с концентрацией участвующих в реакции веществ | Уметь выстраивать причинно-следственные связи, осуществлять требуемые сравнение, обобщение и зависимость. |
|||||||||||||||||||||||
Строим график изменения концентрации йода во времени С HI, моль/л 3 1,2 1,0 2 1,0 0,8 0,8 0,6 0,6 0,4 3 0,4 0,2 0,2 0 5 10 15 20 Время, с | График изменения концентрации реагирующего вещества во времени дает обучающимся возможность самостоятельно определить скорость реакции и проследить, как она изменяется в ходе реакции | Формирование исследовательских умений – строят график по данным эксперимента | Уметь фиксировать зависимость скорости реакции от различных факторов. Формулировать соответствующие выводы |
|||||||||||||||||||||||
Кривая изменения концентрации реагирующего вещества или продукта реакции во времени называется кинетической кривой . Скорость химической реакции – это изменение концентрации одного из реагирующих веществ за единицу времени. C 2 - c 1 ∆c 0,3 - 1 v = = = = - 0,03 (моль/л · с) T 2 – t 1 ∆t 20 – 0 Принято считать скорость реакции положительной величиной, знак «минус» говорит о том, что функция зависимости концентрации I 2 от времени убывающая. Из графика следует, что с течением времени уменьшается не только концентрация, но и скорость реакции. Подтвердим это расчетами. Определим скорость для разных участков кинетической кривой: на участке 1: v = 0,08 моль /(л · с), на участке 2: v = 0,035 моль/(л · с), на участке 3: v = 0,01 моль/ (л · с) Какие выводы следуют из анализа кинетической кривой? – Концентрация реагирующего вещества уменьшается по мере протекания реакции. Скорость реакции с течением времени уменьшается. Очевидно, «скорость реакции» - это средняя скорость процесса в определенный промежуток времени, что чем меньше промежуток времени, тем точнее значение скорости. Заполним правый столбец таблицы значениями концентрации продукта реакции HI. При определении значений руководствуемся уравнением реакции. Строим кинетическую кривую относительно продукта реакции, определим скорости реакции для участков кривой 1, 2 и 3. Приходим к выводу, что скорость по компоненту HI в два раза больше, чем по компоненту I 2 . Это можно прогнозировать, исходя из уравнения реакции. дополнительный анализ кинетической кривой показал нам, что
| Поэтапный анализ кинетической кривой приводит к осмысленному пониманию изучаемого материала, исключает формализм знаний Построение кинетической кривой по продукту реакции показывают, что накопление продукта реакции происходит постепенно, по мере расходования исходных веществ Необходимо обратить внимание на физическую сущность стехиометрических коэффициентов в уравнении химической реакции | Самостоятельно формулируют понятие «скорость реакции» Самостоятельно рассчитывают скорость для всей кинетической кривой и отдельных ее участков. Обучающиеся сами выводят единицы скорости реакции Анализируют результаты полученных расчетов. формулируют выводы | ||||||||||||||||||||||||
На доске плакат: Химическая реакция идет по схеме А + В = 2С 2А + В = 2С | Оценить правильность и осознанность усвоения нового учебного материала, выявить и устранить пробелы и неверные представления | Заполняют таблицу | Уметь применять полученные знания для решения простых задач. Аналировать правильность выполения последовательности действий. Уметь участвовать в обсуждении проблемы, выражать собственное мнение о полученном результате. |
|||||||||||||||||||||||
Задача: в каком из сосудов одинаковой емкости реакция протекает с большой скоростью, если за одно и то же время в первом сосуде образуется 10 г фторводорода, а во втором – 53 г иодоводорода? | Закрепить полученные знания | Самостоятельное выполнение заданий с взаимной проверкой результата выполнения. | Уметь самостоятельно решать задания по теме. Анализировать правильность выполнения задания. |
|||||||||||||||||||||||
Подведем основные итоги. Сформулируем их и запишем в тетрадь | Сформировать умение обобщать полученную информацию и выделять главное | Самостоятельная формулировка выводов. Выявление общего эмоционально-продуктивного фона урока. | Уметь обобщить и систематизировать полученную информацию. Участвовать в обсуждении, уметь выражать свои мысли. |
|||||||||||||||||||||||
Предлагается разноуровневое задание по карточкам: 1) обязательное: §.12, у 1-6 с. 62 2) углубленное: §. 12, з1-4 с.63 3) творческое: Рассмотреть реакции получения серной кислоты из пирита с точки зрения зависимости скорости хим.реакции от разл. факторов. | Сопровождение записанного задания комментариями для различных уровней. | Выбор одного из видов задания для домашней работы. Извлечение необходимой информации и фиксация ее в дневник. | Правильно и с удовольствием выполненное домашнее задание. |
|||||||||||||||||||||||
Урок разработала Лопкина Светлана Ивановна
учитель химии и географии
МОУ «Лажъяльская средняя школа» Республики Марий Эл
Предмет: химия
Класс: 9
Тема: Скорость химических реакций
Цель урока : создание условий для осознания и осмысления знаний по теме «Скорость химических реакций. Факторы, влияющие на скорость химических реакций»»
Задачи урока:
Образовательный аспект:
сформировать понятие «скорость химических реакций», в результате наблюдения, анализа, сравнения, обобщения подвести учащихся к осмыслению зависимости скорости химических реакций от различных факторов;
формирование навыков исследовательской деятельности обучающихся.
Развивающий аспект:
способствовать формированию общеучебных умений:
учебно-интеллектуальных (анализировать факты, устанавливать причинно-следственные связи, делать выводы);
учебно-информационных (работать с тестами);
учебно-организационных (понимать смысл задания, распределять время для выполнения тестовых заданий и их проверки);
учебно-коммуникативных (умение вести диалог, высказывать свою точку зрения);
способствовать развитию кругозора учащихся.
Воспитательный аспект:
способствовать воспитанию аккуратности, внимательности, осторожности при работе с лабораторным оборудованием и реактивами.
Оборудование:
для лабораторных работ: набор реактивов: раствор HCl , Zn в таблетках и порошкообразный, Fe , Mg ; спиртовки, спички, держатели, пробирки;
на столе учителя: HCl (конц), соль лития, кусочек сахара, спиртовка, спички, тигельные щипцы;
демонстрационная компьютерная техника.
Тип учебного занятия: урок «открытия» новых знаний с элементами исследования
Форма организации: фронтальная, парная работа
Использование педагогических технологий:
технология проблемного обучения;
технология коллективного взаимодействия;
технология критического мышления
обучение на основе учебных ситуаций
Методы и приемы обучения:
проблемный диалог;
побуждающий диалог;
подводящий диалог;
сравнительный метод;
исследование
Ход урока
Деятельность учителя
Деятельность учащихся
I . Мотивационно-целевой этап.
1. Актуализация знаний (3 мин.)
Сегодня у нас необычный урок. Скажите, пожалуйста, любите ли вы сок?
О чем это свидетельствует (с точки зрения химии)? Какие признаки химических реакций наблюдаются при этом? (Слайд 2)
Значит, даже в обыденной жизни мы постоянно имеем дело с химическими реакциями. И сегодня речь у нас пойдет о реакциях.
Так как сегодня мы будем проводить исследование, вспомним основные правила техники безопасности. (Слайд 3)
Не пробуйте вещества на вкус. Старайтесь, чтобы вещества не попадали на кожу лица и рук, так как многие из них вызывают раздражение кожи и слизистых оболочек.
В случае ожога, пореза обращайтесь к учителю или лаборанту.
Не приступайте к выполнению опыта, не зная, что и как нужно делать.
Не загромождайте свое рабочее место предметами, которые не потребуются для выполнения опыта. Работайте спокойно, без суетливости, не мешая соседям.
Обращайтесь бережно с посудой, веществами и лабораторными принадлежностями.
Закончив работу, приведите рабочее место в порядок.
2. Целепологание (3 мин.)
Что же изменилось в испортившемся соке с химической точки зрения?
А в чем измеряется вещество?
Какова единица измерения количества вещества?
Но бывает так, что сок может простоять без изменений, и признаков порчи не наблюдается.
Значит ли это, что химические реакции не протекают?
Значит, химические реакции протекают с разной скоростью. И сегодня нам предстоит ознакомиться с понятием «скорость химической реакции» и выявить, от каких факторов она зависит.
Для чего это нужно?
Запишите тему урока.
II . Процессуальный этап. Совместное открытие новых знаний.
1. Понятие о скорости химической реакции. (10 мин.)
В курсе физики вы ознакомились с понятием «скорость движения». Давайте вспомним, что это такое.
Скорость движения – это изменение длины пути в единицу времени:
∆ S
Понятие «скорость химической реакции» во многом сходно с понятием «скорость движения». Как мы уже выяснили, во время химических реакций изменяется количества веществ, как реагирующих, так и продуктов реакций. В жидкостях и газах реакции протекают в определенном объеме, поэтому в жидкой и газообразной среде (гомогенные реакции) скорость химической реакции – это изменение количества вещества в единицу времени в единице объема:
∆ n n ∆с
Ѵ= - , но так как - = с, то Ѵ= ± -
V ∙∆t V ∆t
∆с = с2 -с1 (объяснить, почему перед формулой знак ±)
Единица измерения скорости химической реакции обычно моль/л∙с.
Если в реакции участвует твердое вещество (гетерогенная реакция), то взаимодействие веществ происходит не по всему объему. А только на поверхности твердого вещества, поэтому:
S ∙∆t
где S –площадь поверхности соприкосновения веществ (Слайд 4)
Давайте решим задачу на вычисление скорости химической реакции: в растворе протекает реакция А+ В = С. Какова скорость химической реакции, если начальная концентрация А была 0,8 моль/л, а через 20с снизилась до 0,78 моль/л? (Слайд 5)
2. Физкультминутка (2 мин.)
Вновь у нас физкультминутка
Наклонились, ну-ка, ну-ка!
Распрямились, потянулись,
А теперь назад прогнулись.
Голова устала тоже
Так давайте ей поможем
Вправо-влево, раз и два
Думай, думай, голова.
Хоть зарядка коротка,
Отдохнули мы слегка.
3. Факторы, оказывающие влияние на скорость химических реакций (20 мин.)
Давайте вернемся к нашему примеру.
Что мы можем сделать, чтобы сок сохранился как можно дольше?
Правильно. Итак, первый фактор:
Температура (Слайд 6)
Чем выше температура, тем больше скорость химических реакций; чем ниже температура, тем меньше скорость химических реакций.
Правило Вант-Гоффа: при повышении температуры на каждые 10ºС скорость реакции увеличивается в 2-4 раза:
Математически правило Вант-Гоффа выражается формулой:
где: – температурный коэффициент;– скорость химической реакции при температурах соответственно.
Решение задачи: Определите, как изменится скорость химической реакции, температурный коэффициент которой 3, при повышении температуры с 10ºС до 40ºС. (Слайд 7)
Большое внимание на классных часах вы уделяли мерам противопожарной безопасности и правилам поведения при пожарах. Вы знаете, что если в помещении пожар, нельзя открывать окна. Почему? Значит, увеличивается скорость реакции горения. - За счет чего увеличивается скорость горения? Вспомните, что такое горение.
На скорость химической реакции влияет: 2) концентрация реагирующих веществ (Слайд 8)
Демонстрация: а) взаимодействие раствора HCl
c
Zn
; б) взаимодействие конц. HCl
c
Zn
. Вывод: чем больше концентрация, тем выше скорость химической реакции. Объяснение: для химического взаимодействия необходимо, чтобы молекулы реагирующих веществ столкнулись. Чем выше концентрация веществ, тем больше таких столкновений, поэтому скорость реакции выше. (В сильном классе вводится понятие о законе действующих масс. По закону действующих масс скорость реакции, уравнение которой А+В=С может быть вычислена по формуле: v 1 = k 1 C A C B , а скорость реакции, уравнение которой А+2В=С, может быть вычислена по формуле: v 2 = k 2 C A C B 2 В этих формулах: C A и C B – концентрации веществ А и В (моль/л), k 1 и k 2 – коэффициенты пропорциональности, называемые константами скоростей реакции
. Эти формулы также называют кинетическими уравнениями.
Составьте кинетические уравнения для следующих реакций: а) H 2 +Cl
2 =2HCl
;
Б) 2 Fe + 3CI 2 = 2 FeCI 3)
Ребята, сейчас вы смотрели взаимодействие раствора HCl c Zn . Как ещё можно увеличить скорость этой реакции, не изменяя температуры и концентрации соляной кислоты? Вы наверняка когда-нибудь растапливали камин или печь, ходили в походы, разжигали костры. Какие брали дрова для костра – крупные поленья или измельчали их? - Как вы думаете, почему? Формулируем вывод:
3) для гетерогенных реакций скорость зависит от площади поверхности соприкосновения реагирующих веществ. (Слайд 9) Чем больше площадь поверхности соприкосновения, тем больше скорость химической реакции.
– Давайте сравним, как взаимодействуют с раствором HCl два металла – Fe и Mg .
Одинакова ли скорость этих реакций? Почему? Формулируем вывод: следующий фактор, влияющий на скорость химической реакции - 4) природа реагирующих веществ (Слайд 10)
Скажите, как вы думаете, сможем ли мы поджечь кусочек сахара? (Демонстрация) Не получается. А теперь поместим на кусочек сахара несколько крупинок соли лития (сигаретный пепел) (Демонстрация) Сахар загорается. Как вы думаете, почему?
Соли лития – катализаторы горения сахара. 5)следующий фактор – катализатор (Слайд 11)
Вспомните, что такое катализаторы. В нашем организме также имеются катализаторы. Как они называются?
Итак, мы узнали, что такое скорость химической реакции, и от чего она зависит.
III . Самопроверка. Коррекция полученных результатов. (3 мин.)
Предлагаю решить тест, оценить полученные знания. Выберите правильные варианты ответов. (Слайд 12)
1 . Единица измерения скорости химической реакции:
А) м/с В) моль/м
Б) моль/л∙мин Г) м∙с²
2. Фактор, не влияющий на скорость химической реакции:
А) катализатор
Б) концентрации реагирующих веществ
В) форма сосуда, в котором протекает реакция
Г) температура
3. Скорость химической реакции
Zn +2HCl = ZnCl 2 +H 2 будет наибольшей при использовании:
А) кусочка Zn и 5% раствора кислоты
Б) порошка Zn и 5% раствора кислоты
В) кусочка Zn и 10% раствора кислоты
Г) порошка Zn и 10% раствора кислоты
4 . «Растворение» цинка в соляной кислоте будет замедляться при:
А) увеличении концентрации кислоты
Б) раздроблении цинка
В) разбавлении кислоты
Г) повышении температуры
5 . При повышении температуры на каждые 10ºС скорость химической реакции:
А) не изменяется
Б) уменьшается
В) увеличивается в 10 раз
Г) увеличивается в 2-4 раза
Самопроверка: ответы: 1. Б); 2. В); 3. Г); 4. В); 5. Г). (Слайд 13)
IV . Рефлексия. (2 мин.)
Надеюсь, что в ходе нашего урока вы узнали много нового и важного, что может пригодиться в жизни. В ходе урока вы пытались овладеть самым главным в процессе познания – умением находить истину с помощью доказательств, т.е. проводить исследование.
Сейчас я предложу вам небольшой тест. Поставьте плюсики за утверждения. (Слайд 14)
Я узнал(а) много нового.
Мне это пригодится в жизни.
На уроке было над чем подумать.
На все возникшие у меня вопросы я получил(а) ответы.
На уроке я поработал(а) добросовестно.
Подсчитайте количество плюсиков. Их количество подсказывает вам, как вы поработали на уроке.
V . Домашнее задание. (Слайд 15) (2 мин.)
1. Решить задачу: Определить скорость химической реакции H 2 +Br 2 = 2HBr , если начальная концентрация водорода была 1 моль/л, а через 30 с стала 0,8 моль/л. (Задача распечатана на листочках)
2. Привести примеры влияния различных факторов на скорость химических реакций, которые вы осуществляете дома, в быту.
Отвечают (как правило, да )
Отвечают:
- Происходит химическая реакция
- Выделение газа, появление запаха
Предполагают:
- Исчезают вкусные и полезные вещества, появляются вещества, ухудшающие вкус сока.
- Количество вещества
- Моль
- Нет, реакции протекают, но медленнее
- Есть реакции полезные, их скорость нужно увеличить; есть реакции вредные, скорость которых нужно уменьшить.
Записывают тему урока
Отвечают
Совместно с учителем выводят формулу и записывают в тетрадь
Решают задачу совместно с учителем
Повторяют упражнения за учителем.
Предполагают: поставить в холодильник.
Проводят лабораторный опыт: а) взаимодействие раствора HCl c Zn при обычной температуре;
б) взаимодействие раствора HCl c Zn при нагревании
Формулируют вывод: чем выше температура, тем больше скорость химических реакций.
Решают задачу.
Отвечают: пламя разгорается с большей силой.
Обсуждение: горение – взаимодействие вещества с кислородом. Когда открываем окно, в комнату врывается поток кислорода (увеличивается концентрация кислорода).
Записывают в тетрадь.
Отвечают: измельченные поленья загораются быстрее, т.к. увеличивается площадь поверхности соприкосновения с кислородом.
Проводят лабораторный опыт: а) взаимодействие раствора HCl c Zn (таб.);
б) взаимодействие раствора HCl c Zn (порош.)
Проводят лабораторный опыт: а) взаимодействие раствора HCl c Fe ;
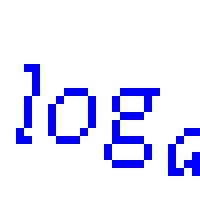 Как сравнить логарифмы с разным основанием
Как сравнить логарифмы с разным основанием Вывих сустава: признаки, диагностика и лечение Что такое вывих определение
Вывих сустава: признаки, диагностика и лечение Что такое вывих определение Тиреоидит щитовидной железы: лечение, симптомы, признаки, причины, что это такое?
Тиреоидит щитовидной железы: лечение, симптомы, признаки, причины, что это такое? Суп Велюте Дюбарри — Velouté Dubarry Салат дюбарри рецепт
Суп Велюте Дюбарри — Velouté Dubarry Салат дюбарри рецепт Голубцы с куриным фаршем – рецепт Голубцы из куриного фарша в духовке
Голубцы с куриным фаршем – рецепт Голубцы из куриного фарша в духовке Рождественский глинтвейн
Рождественский глинтвейн Куриный шашлычок на шпажках Как замариновать курицу для шашлыка
Куриный шашлычок на шпажках Как замариновать курицу для шашлыка