Pcl5 რა კავშირი. ტესტი ქიმიაში (მე-8 კლასი) „ატომის აგებულება.ქიმიური ბმების სახეები“. მოლეკულების დიპოლური მომენტები
მოლეკულების დიპოლური მომენტები
ვალენტური კავშირის მეთოდი ემყარება კონცეფციას, რომ ქიმიურ ნაწილაკში ატომების ყოველი წყვილი ერთად იმართება ერთი ან მეტი ელექტრონული წყვილით. ელექტრონების ეს წყვილი ეკუთვნის ორ ატომს, რომლებიც დაკავშირებულია და ლოკალიზებულია მათ შორის სივრცეში. შეკრული ატომების ბირთვების ამ ელექტრონებთან მიზიდულობის გამო წარმოიქმნება ქიმიური ბმა.
ატომური ორბიტალების გადახურვა
ქიმიური ნაწილაკების ელექტრონული სტრუქტურის აღწერისას ელექტრონები, მათ შორის სოციალიზებული, ენიჭება ცალკეულ ატომებს და მათი მდგომარეობა აღწერილია ატომური ორბიტალებით. შროდინგერის განტოლების ამოხსნისას ტალღის სავარაუდო ფუნქცია არჩეულია ისე, რომ იგი იძლევა სისტემის მინიმალურ ელექტრონულ ენერგიას, ანუ სავალდებულო ენერგიის უდიდეს მნიშვნელობას. ეს მდგომარეობა მიიღწევა ორბიტალების ყველაზე დიდი გადაფარვით, რომლებიც მიეკუთვნება ერთ ბმას. ამრიგად, ორი ატომის დამაკავშირებელი ელექტრონების წყვილი მდებარეობს მათი ატომური ორბიტალების გადახურვის რეგიონში.
გადახურულ ორბიტალებს უნდა ჰქონდეთ იგივე სიმეტრია ბირთვთაშორის ღერძის მიმართ.
ატომური ორბიტალების გადახურვა ატომის ბირთვების დამაკავშირებელი ხაზის გასწვრივ იწვევს σ ობლიგაციების წარმოქმნას. ქიმიური ნაწილაკების ორ ატომს შორის შესაძლებელია მხოლოდ ერთი σ ბმა. ყველა σ ბმას აქვს ღერძული სიმეტრია ბირთვთაშორის ღერძის მიმართ. ქიმიური ნაწილაკების ფრაგმენტებს შეუძლიათ ბრუნავდნენ ბირთვთაშორის ღერძის გარშემო ატომური ორბიტალების გადახურვის ხარისხის შეფერხების გარეშე, რომლებიც ქმნიან σ ობლიგაციებს. მიმართული, მკაცრად ორიენტირებული სივრცეში σ-ბმათა ნაკრები ქმნის ქიმიური ნაწილაკების სტრუქტურას.
ბმის ხაზის პერპენდიკულარული ატომური ორბიტალების დამატებითი გადაფარვით, წარმოიქმნება π ბმები.

შედეგად, ატომებს შორის წარმოიქმნება მრავალი ბმა:
| მარტოხელა (σ) | ორმაგი (σ +π) | სამმაგი (σ + π + π) |
| F−F | O=O | N≡N |
π-ბმის გაჩენისას, რომელსაც არ გააჩნია ღერძული სიმეტრია, შეუძლებელი ხდება ქიმიური ნაწილაკების ფრაგმენტების თავისუფალი ბრუნვა σ-ბმის ირგვლივ, ვინაიდან ამან უნდა გამოიწვიოს π-ბმის გაწყვეტა. გარდა σ- და π- ბმების, შესაძლებელია სხვა ტიპის ბმის ფორმირება - δ-ბმა:

როგორც წესი, ასეთი ბმა იქმნება მას შემდეგ, რაც ატომები ქმნიან σ- და π- ბმებს, თუ ატომებს აქვთ დ- და ვ-ორბიტალები მათი „ფურცლების“ გადაფარვით ერთდროულად ოთხ ადგილას. შედეგად, კომუნიკაციის სიმრავლე შეიძლება გაიზარდოს 4-5-მდე.
მაგალითად, ოქტაქლოროდირენატ (III) იონში 2-, ოთხი ბმა იქმნება რენიუმის ატომებს შორის.
კოვალენტური ბმების წარმოქმნის მექანიზმები
კოვალენტური ბმების წარმოქმნის რამდენიმე მექანიზმი არსებობს: გაცვლა(ექვივალენტი), დონორ-მიმღები, დატივი.
გაცვლის მექანიზმის გამოყენებისას ბმის წარმოქმნა განიხილება ატომების თავისუფალი ელექტრონების სპინების დაწყვილების შედეგად. ამ შემთხვევაში მეზობელი ატომების ორი ატომური ორბიტალი ერთმანეთს ემთხვევა, რომელთაგან თითოეულს ერთი ელექტრონი იკავებს. ამრიგად, თითოეული შეკრული ატომი გამოყოფს ელექტრონულ წყვილს გაზიარებისთვის, თითქოს მათ გაცვლის. მაგალითად, როდესაც ბორის ტრიფტორიდის მოლეკულა წარმოიქმნება ატომებისგან, ბორის სამი ატომური ორბიტალი, თითოეული შეიცავს ერთ ელექტრონს, გადაფარავს სამი ფტორის ატომის სამ ატომურ ორბიტალს (თითოეული ასევე შეიცავს ერთ დაუწყვილებელ ელექტრონს). შესაბამისი ატომური ორბიტალების გადახურვის ადგილებში ელექტრონების დაწყვილების შედეგად ჩნდება სამი წყვილი ელექტრონი, რომლებიც ატომებს აკავშირებს მოლეკულაში.
დონორ-მიმღები მექანიზმის მიხედვით, ორბიტალი ერთი ატომის წყვილი ელექტრონით და მეორე ატომის თავისუფალი ორბიტალი გადახურულია. ამ შემთხვევაში, ელექტრონების წყვილი ასევე ჩნდება გადახურვის რეგიონში. მაგალითად, დონორ-მიმღები მექანიზმის მიხედვით, ხდება ფტორის იონის დამატება ბორის ტრიფტორიდის მოლეკულაში. ვაკანტური რ-ბორის ორბიტალი (ელექტრონული წყვილის მიმღები) BF 3 მოლეკულაში გადახურულია რ- F − იონის ორბიტალი, რომელიც მოქმედებს როგორც ელექტრონული წყვილის დონორი. მიღებულ იონში ოთხივე კოვალენტური ბორი-ფტორის ბმა სიგრძით და ენერგიით ექვივალენტურია, მიუხედავად მათი წარმოქმნის მექანიზმში განსხვავებისა.
ატომები, რომელთა გარე ელექტრონული გარსი შედგება მხოლოდ ს- და რ-ორბიტალი შეიძლება იყოს ელექტრონული წყვილის დონორი ან მიმღები. ატომები, რომელთა გარე ელექტრონულ გარსში შედის დ-ორბიტალებს შეუძლიათ იმოქმედონ როგორც ელექტრონული წყვილების დონორიც და მიმღებიც. ამ შემთხვევაში განიხილება ბმის ფორმირების დატიური მექანიზმი. ბმის ფორმირებისას დატივის მექანიზმის გამოვლინების მაგალითია ქლორის ორი ატომის ურთიერთქმედება. ქლორის ორი ატომი Cl 2 მოლეკულაში ქმნის კოვალენტურ კავშირს გაცვლის მექანიზმის მიხედვით, აერთიანებს მათ დაუწყვილებელ 3-ს. რ- ელექტრონები. გარდა ამისა, არსებობს გადახურვა 3 რ- Cl-1 ატომის ორბიტალი, რომელსაც აქვს წყვილი ელექტრონები და ვაკანტური 3 დ-Cl-2 ატომის ორბიტალები, ასევე გადახურვა 3 რ- Cl-2 ატომის ორბიტალი, რომელსაც აქვს წყვილი ელექტრონები და ვაკანტური 3 დ- Cl-1 ატომის ორბიტალები. დატივის მექანიზმის მოქმედება იწვევს კავშირის სიძლიერის ზრდას. ამრიგად, Cl 2 მოლეკულა უფრო ძლიერია ვიდრე F 2 მოლეკულა, რომელშიც კოვალენტური ბმები იქმნება მხოლოდ გაცვლის მექანიზმით:
ატომური ორბიტალების ჰიბრიდიზაცია
ქიმიური ნაწილაკების გეომეტრიული ფორმის დადგენისას გასათვალისწინებელია, რომ ცენტრალური ატომის გარე ელექტრონების წყვილი, მათ შორის, რომლებიც არ ქმნიან ქიმიურ კავშირს, განლაგებულია სივრცეში რაც შეიძლება შორს ერთმანეთისგან.
კოვალენტური ქიმიური ბმების განხილვისას ხშირად გამოიყენება ცენტრალური ატომის ორბიტალების ჰიბრიდიზაციის კონცეფცია - მათი ენერგიისა და ფორმის გასწორება. ჰიბრიდიზაცია არის ფორმალური ტექნიკა, რომელიც გამოიყენება ქიმიურ ნაწილაკებში ორბიტალების გადანაწილების კვანტური ქიმიური აღწერისთვის თავისუფალ ატომებთან შედარებით. ატომური ორბიტალის ჰიბრიდიზაციის არსი მდგომარეობს იმაში, რომ შეკრული ატომის ბირთვთან მახლობლად ელექტრონი ხასიათდება არა ერთი ატომური ორბიტალით, არამედ ატომური ორბიტალების კომბინაციით იგივე ძირითადი კვანტური რიცხვით. ამ კომბინაციას ჰიბრიდული ორბიტალი ეწოდება. როგორც წესი, ჰიბრიდიზაცია გავლენას ახდენს მხოლოდ ელექტრონების მიერ დაკავებულ უფრო მაღალი და მსგავსი ენერგიის ატომურ ორბიტალებზე.
ჰიბრიდიზაციის შედეგად ჩნდება ახალი ჰიბრიდული ორბიტალები (ნახ. 24), რომლებიც სივრცეში ისეა ორიენტირებული, რომ მათზე განლაგებული ელექტრონული წყვილი (ან დაუწყვილებელი ელექტრონები) რაც შეიძლება შორს იყოს ერთმანეთისგან, რაც შეესაბამება ინტერელექტრონის მოგერიების მინიმალური ენერგია. ამრიგად, ჰიბრიდიზაციის ტიპი განსაზღვრავს მოლეკულის ან იონის გეომეტრიას.
ჰიბრიდიზაციის სახეები
| ჰიბრიდიზაციის ტიპი | გეომეტრიული ფორმა | კუთხე ბმებს შორის | მაგალითები |
| sp | ხაზოვანი | 180 o | BeCl2 |
| sp 2 | სამკუთხა | 120 o | BCl 3 |
| sp 3 | ოთხკუთხედი | 109,5 ო | CH 4 |
| sp 3 დ | ტრიგონალ-ბიპირამიდული | 90 o; 120 o | PCl 5 |
| sp 3 დ 2 | ოქტაედრული | 90 o | SF 6 |

ჰიბრიდიზაცია გულისხმობს არა მხოლოდ ელექტრონების, არამედ მარტოხელა ელექტრონების წყვილებსაც. მაგალითად, წყლის მოლეკულა შეიცავს ორ კოვალენტურ ქიმიურ კავშირს ჟანგბადის ატომსა და წყალბადის ორ ატომს შორის.

წყალბადის ატომებთან გაზიარებული ელექტრონების ორი წყვილის გარდა, ჟანგბადის ატომს აქვს ორი წყვილი გარე ელექტრონები, რომლებიც არ მონაწილეობენ ბმის ფორმირებაში (მარტოხელა ელექტრონული წყვილი). ოთხივე წყვილი ელექტრონი იკავებს სპეციფიკურ უბნებს ჟანგბადის ატომის გარშემო სივრცეში.
იმის გამო, რომ ელექტრონები ერთმანეთს მოგერიებენ, ელექტრონული ღრუბლები განლაგებულია რაც შეიძლება შორს. ამ შემთხვევაში, ჰიბრიდიზაციის შედეგად იცვლება ატომური ორბიტალების ფორმა, ისინი წაგრძელებული და მიმართულია ტეტრაედრის წვეროებისკენ. მაშასადამე, წყლის მოლეკულას აქვს კუთხოვანი ფორმა, ხოლო კუთხე ჟანგბად-წყალბადის ბმებს შორის არის 104,5 o.
ჰიბრიდიზაციის ტიპის პროგნოზირებისთვის მოსახერხებელია მისი გამოყენება დონორ-აქცეპტორი მექანიზმიბმის ფორმირება: არის გადახურვა ნაკლებად ელექტროუარყოფითი ელემენტის ცარიელ ორბიტალებსა და უფრო ელექტროუარყოფითი ელემენტის ორბიტალებს შორის, მათზე განთავსებული ელექტრონების წყვილებით. ატომების ელექტრონული კონფიგურაციების შედგენისას მხედველობაში მიიღება ისინი ჟანგვის მდგომარეობები- პირობითი რიცხვი, რომელიც ახასიათებს ნაერთში ატომის მუხტს, გამოითვლება ნივთიერების იონური სტრუქტურის დაშვების საფუძველზე.
ჰიბრიდიზაციის ტიპისა და ქიმიური ნაწილაკების ფორმის დასადგენად, გააკეთეთ შემდეგი:
π ობლიგაციების არსებობა გავლენას არ ახდენს ჰიბრიდიზაციის ტიპზე. ამასთან, დამატებითი კავშირის არსებობამ შეიძლება გამოიწვიოს ბმის კუთხეების ცვლილებები, რადგან მრავალჯერადი ბმის ელექტრონები ერთმანეთს უფრო ძლიერად უკუაგდებენ. ამ მიზეზით, მაგალითად, ბმის კუთხე NO 2 მოლეკულაში ( sp 2-ჰიბრიდიზაცია) იზრდება 120 o-დან 134 o-მდე.

აზოტ-ჟანგბადის ბმის სიმრავლე ამ მოლეკულაში არის 1,5, სადაც ერთი შეესაბამება ერთ σ ბმას, ხოლო 0,5 უდრის აზოტის ატომის ორბიტალების რაოდენობის თანაფარდობას, რომლებიც არ მონაწილეობენ ჰიბრიდიზაციაში (1) რიცხვთან. დარჩენილი აქტიური ელექტრონული წყვილები ჟანგბადის ატომზე, რომლებიც ქმნიან π-ბმას (2). ამრიგად, შეინიშნება π ობლიგაციების დელოკალიზაცია (დელოკალიზებული ბმები არის კოვალენტური ბმები, რომელთა სიმრავლე არ შეიძლება გამოისახოს მთელი რიცხვით).
Როდესაც sp, sp 2 , sp 3 , sp 3 დპოლიედრონში 2 წვერო ჰიბრიდიზაცია, რომელიც აღწერს ქიმიური ნაწილაკების გეომეტრიას, ექვივალენტურია და, შესაბამისად, მრავალი ბმა და ელექტრონების მარტოხელა წყვილი შეიძლება დაიკავოს რომელიმე მათგანი. თუმცა sp 3 დ- პასუხობს ჰიბრიდიზაცია ტრიგონალური ბიპირამიდა, რომელშიც პირამიდის ფუძეზე მდებარე ატომების ბმის კუთხეები (ეკვატორული სიბრტყე) უდრის 120 o-ს, ხოლო ბმის კუთხეები ბიპირამიდის წვეროებზე მდებარე ატომების მონაწილეობით უდრის 90 o-ს. ექსპერიმენტი აჩვენებს, რომ მარტოხელა ელექტრონული წყვილი ყოველთვის განლაგებულია ტრიგონალური ბიპირამიდის ეკვატორულ სიბრტყეში. ამ საფუძველზე, დასკვნა, რომ მათ ესაჭიროებათ მეტი თავისუფალი სივრცე, ვიდრე ბმის ფორმირებაში ჩართული ელექტრონული წყვილები. ელექტრონების მარტოხელა წყვილის ასეთი განლაგებით ნაწილაკების მაგალითია გოგირდის ტეტრაფტორიდი (სურ. 27). თუ ცენტრალურ ატომს ერთდროულად აქვს ელექტრონების მარტოხელა წყვილი და აყალიბებს მრავალ კავშირს (მაგალითად, XeOF 2 მოლეკულაში), მაშინ იმ შემთხვევაში sp 3 დ-ჰიბრიდიზაცია, ისინი განლაგებულია ტრიგონალური ბიპირამიდის ეკვატორულ სიბრტყეში (სურ. 28).
მოლეკულების დიპოლური მომენტები
იდეალური კოვალენტური ბმა არსებობს მხოლოდ იდენტური ატომებისგან შემდგარ ნაწილაკებში (H 2, N 2 და ა.შ.). თუ კავშირი წარმოიქმნება სხვადასხვა ატომებს შორის, მაშინ ელექტრონის სიმკვრივე გადადის ერთ-ერთ ატომურ ბირთვზე, ანუ ხდება ბმის პოლარიზაცია. ბმის პოლარობა ხასიათდება მისი დიპოლური მომენტით.
მოლეკულის დიპოლური მომენტი ტოლია მისი ქიმიური ბმების დიპოლური მომენტების ვექტორული ჯამის (ელექტრონების მარტოხელა წყვილის არსებობის გათვალისწინებით). თუ პოლარული ბმები მოლეკულაში სიმეტრიულად არის განლაგებული, მაშინ დადებითი და უარყოფითი მუხტები ანადგურებენ ერთმანეთს, ხოლო მოლეკულა მთლიანობაში არაპოლარულია. ეს ხდება, მაგალითად, ნახშირორჟანგის მოლეკულასთან. პოლიატომური მოლეკულები პოლარული ბმების ასიმეტრიული განლაგებით (და შესაბამისად ელექტრონის სიმკვრივით) ზოგადად პოლარულია. ეს განსაკუთრებით ეხება წყლის მოლეკულას.

მოლეკულის დიპოლურ მომენტზე შეიძლება გავლენა იქონიოს ელექტრონების მარტოხელა წყვილმა. ამრიგად, NH 3 და NF 3 მოლეკულებს აქვთ ტეტრაედრული გეომეტრია (ელექტრონების მარტოხელა წყვილის გათვალისწინებით). აზოტი-წყალბადის და აზოტ-ფტორის ბმების იონურობის ხარისხი არის შესაბამისად 15 და 19%, ხოლო მათი სიგრძე, შესაბამისად, 101 და 137 pm. ამის საფუძველზე შეიძლება დავასკვნათ, რომ NF 3-ს აქვს უფრო დიდი დიპოლური მომენტი. თუმცა ექსპერიმენტი საპირისპიროს აჩვენებს. დიპოლური მომენტის უფრო ზუსტი პროგნოზირებისთვის მხედველობაში უნდა იქნას მიღებული მარტოხელა წყვილის დიპოლური მომენტის მიმართულება (სურ. 29).
61. რომელ ქიმიურ კავშირს ეწოდება წყალბადის ბმა? მიეცით წყალბადის კავშირის მქონე ნაერთების სამი მაგალითი. დახაზეთ ზემოაღნიშნული ასოციაციების სტრუქტურული დიაგრამები. როგორ მოქმედებს წყალბადის ბმის წარმოქმნა ნივთიერებების თვისებებზე (სიბლანტე, დუღილის და დნობის წერტილები, შერწყმისა და აორთქლების სითბო?
62. რომელ კავშირს ეწოდება s-ბმა და რომელს p-ბმა? რომელია ნაკლებად გამძლე? დახაზეთ ეთანის C 2 H 6, ეთილენის C 2 H 4 და აცეტილენის C 2 H 2 სტრუქტურული ფორმულები. მონიშნეთ s- და p- ბმები ნახშირწყალბადის სტრუქტურულ დიაგრამებზე.
63. მოლეკულებში F 2, O 2, H 2 SO 4, HCl, CO 2, მიუთითეთ ბმების ტიპი, s- და p-ბმების რაოდენობა.
64. მოლეკულათაშორისი ურთიერთქმედების რა ძალებს ეწოდება დიპოლ-დიპოლური (ორიენტაციული), ინდუქციური და დისპერსიული? ახსენით ამ ძალების ბუნება. როგორია უპირატესი ინტერმოლეკულური ურთიერთქმედების ძალები თითოეულ შემდეგ ნივთიერებაში: H 2 O, HBr, Ar, N 2, NH 3?
65. მიეცით MO-ების შევსების ორი სქემა ატომური პოპულაციების მქონე სისტემებში დონორ-მიმღები ბმის ფორმირებისას:
ა) ელექტრონული წყვილი – თავისუფალი ორბიტალი (2+0) და
ბ) ელექტრონული წყვილი – ელექტრონი (2+1).
დაადგინეთ ობლიგაციების რიგი, შეადარეთ ბონდის ენერგია. განხილული ბმებიდან რომელი მონაწილეობს ამონიუმის იონის წარმოქმნაში?
66. ნორმალურ და აღგზნებულ მდგომარეობებში ატომების აგებულებიდან გამომდინარე, განსაზღვრეთ ბერილიუმის და ნახშირბადის კოვალენტობა BeCl 2, (BeCl 2) n, CO და CO 2 მოლეკულებში. დახაზეთ მოლეკულების სტრუქტურული ფორმულები.
67. კრისტალების ზოლის თეორიის დებულებების საფუძველზე ახასიათებს ლითონებს, გამტარებლებს და დიელექტრიკებს. რა განსაზღვრავს ზოლის უფსკრული? რა მინარევები უნდა დაემატოს სილიკონს მის გადაქცევად:
ა) n-ნახევარგამტარი; ბ) p-ნახევარგამტარი?
68. მიეცით NO მოლეკულის ელექტრონული კონფიგურაცია MO მეთოდის გამოყენებით. როგორ იცვლება მაგნიტური თვისებები და ბმის სიძლიერე NO მოლეკულიდან NO + მოლეკულურ იონზე გადასვლისას?
69. რომელ ქიმიურ ბმას ეწოდება იონური? როგორია მისი ფორმირების მექანიზმი? რა თვისებები განასხვავებს იონურ ბმას კოვალენტური ბმისგან? მიეცით მოლეკულების მაგალითები ტიპიური იონური ბმებით და მიუთითეთ კრისტალური მედის ტიპი. შეადგინეთ ქსენონის იზოელექტრონული სერია.
70. ნორმალურ და აღგზნებულ მდგომარეობებში ატომების აგებულებიდან გამომდინარე, განსაზღვრეთ ლითიუმის და ბორის კოვალენტობა ნაერთებში: Li 2 Cl 2, LiF, -, BF 3.
71. რომელ ქიმიურ ბმას ეწოდება კოორდინაცია ან დონორ-მიმღები? კომპლექსის 2+ სტრუქტურის დაშლა. მიუთითეთ დონორი და მიმღები. როგორ ხსნის ვალენტური კავშირის (BC) მეთოდი ამ იონის ტეტრაედრული სტრუქტურას?
72. რატომ არსებობს PCl 5 მოლეკულა, მაგრამ არა NCl 5 მოლეკულა, თუმცა აზოტი და ფოსფორი პერიოდული ცხრილის VA ქვეჯგუფშია? რა სახის კავშირია ფოსფორისა და ქლორის ატომებს შორის? მიუთითეთ ფოსფორის ატომის ჰიბრიდიზაციის ტიპი PCl 5 მოლეკულაში.
73 აღწერეთ კრისტალური სტრუქტურების ტიპები გისოსების ადგილების ნაწილაკების ბუნებით. რა კრისტალური სტრუქტურები აქვთ: CO 2, CH 3 COOH, ბრილიანტი, გრაფიტი, NaCl, Zn? დაალაგეთ ისინი ბროლის გისოსების ენერგიის გაზრდის მიზნით. რა არის ინტერკალაცია?
74. მიეცით მოლეკულების და იონების ოთხი მაგალითი დელოკალიზებული ბმებით. დახაზეთ მათი სტრუქტურული ფორმულები.
75. რა ტიპის ჰიბრიდიზაციაა CCl 4, H 2 O, NH 3 მოლეკულებში? დახაზეთ ჰიბრიდული ღრუბლების ფარდობითი პოზიციების დიაგრამები და მიუთითეთ მათ შორის კუთხეები.
76. მიეცით MO-ების შევსების ორი სქემა, როდესაც ორი AO ურთიერთქმედებს პოპულაციებთან:
ა) ელექტრონი + ელექტრონი (1+1) და
ბ) ელექტრონი + ვაკანტური ორბიტალი (1+0).
დაადგინეთ თითოეული ატომის კოვალენტობა და კავშირის რიგი. რა არის შებოჭვის ენერგიის საზღვრები? ქვემოთ ჩამოთვლილი ბმებიდან რომელია წყალბადის მოლეკულაში H 2 და მოლეკულურ იონში?
77. მიეცით აზოტის მოლეკულის ელექტრონული კონფიგურაცია MO მეთოდის გამოყენებით. დაამტკიცეთ, რატომ აქვს აზოტის მოლეკულას მაღალი დისოციაციის ენერგია.
78. რა არის დიპოლური მომენტი? როგორ იცვლება ის მსგავსი აგებულების მოლეკულების სერიაში: HCl, HBr, HJ? რა სახის ბმა ჩნდება მოცემულ მოლეკულებში წყალბადის, ქლორის, ბრომისა და იოდის ატომებს შორის? ს- ან p-ბმა ამ მოლეკულებში?
79. რა არის ვალენტური ორბიტალური ჰიბრიდიზაცია? რა სტრუქტურა აქვთ AB n ტიპის მოლეკულებს, თუ მათში ბმა წარმოიქმნება sp-, sp 2 -, sp 3 - A ატომის ორბიტალების ჰიბრიდიზაციის გამო? მიეცით მოლეკულების მაგალითები ჰიბრიდიზაციის მითითებული ტიპებით. მიუთითეთ კუთხეები ბმებს შორის.
80. მოცემულია ნივთიერებების წყვილი: ა) H 2 O და CO; ბ) Br 2 და CH 4; გ) CaO და N 2; დ) H 2 და NH 3. ნივთიერებების რომელ წყვილს ახასიათებს კოვალენტური არაპოლარული ბმა? დახაზეთ არჩეული მოლეკულების სტრუქტურული დიაგრამები, მიუთითეთ ამ მოლეკულების ფორმები და კავშირებს შორის კუთხეები.
ვარიანტი 1
2) მიუთითეთ პერიოდის ნომერი და ჯგუფის ნომერი ქიმიური ელემენტების პერიოდულ ცხრილში D.I. მენდელეევი, რომელშიც ეს ელემენტი მდებარეობს;
მიუთითეთ გოგირდის პოზიცია პერიოდულ ცხრილში. მიეცით მისი ელექტრონული ფორმულა.
სიიდან აირჩიეთ ნივთიერებები, რომელთა მოლეკულები შეიცავს კოვალენტურ არაპოლარულ კავშირს:PCl 5 , CH 4 , ჰ 2 , CO 2 , ო 2 , ს 8 , SCl 2 , SiH 4 .
2 ო, ს 2 , ნ.ჰ. 3 .
ტესტი "ქიმიური ელემენტების ატომები"
ვარიანტი 2
ფიგურაში ნაჩვენებია გარკვეული ქიმიური ელემენტის ატომის ელექტრონული სტრუქტურის მოდელი.

შემოთავაზებული მოდელის ანალიზის საფუძველზე შეასრულეთ შემდეგი ამოცანები:
1) იდენტიფიცირება ქიმიური ელემენტი, რომლის ატომს აქვს ასეთი ელექტრონული სტრუქტურა;
3) დაადგინეთ, მარტივი ნივთიერება, რომელიც ქმნის ამ ქიმიურ ელემენტს, არის ლითონი თუ არალითონი.
მიუთითეთ აზოტის მდებარეობა პერიოდულ ცხრილში. მიეცით მისი ელექტრონული ფორმულა.
სიიდან აირჩიეთ ნივთიერებები, რომელთა მოლეკულები შეიცავს იონურ კავშირებს:NaF, ნ 2 ო 5 , ჰ 2 ს, KI, კუ, ᲘᲡᲔ 3 , BaS.
დაადგინეთ ქიმიური ბმის ტიპი და ჩამოწერეთ მისი წარმოქმნის სქემა ნივთიერებებისთვის: Cl 2 MgCl 2 , NCl 3 .
განსაზღვრეთ თითოეული იზოტოპისთვის:
ტესტი "ქიმიური ელემენტების ატომები"
ვარიანტი 3
ფიგურაში ნაჩვენებია გარკვეული ქიმიური ელემენტის ატომის ელექტრონული სტრუქტურის მოდელი.

შემოთავაზებული მოდელის ანალიზის საფუძველზე შეასრულეთ შემდეგი ამოცანები:
1) იდენტიფიცირება ქიმიური ელემენტი, რომლის ატომს აქვს ასეთი ელექტრონული სტრუქტურა;
2) მიუთითეთ პერიოდის ნომერი და ჯგუფის ნომერი D.I. მენდელეევის ქიმიური ელემენტების პერიოდულ ცხრილში, რომელშიც მდებარეობს ეს ელემენტი;
3) დაადგინეთ, მარტივი ნივთიერება, რომელიც ქმნის ამ ქიმიურ ელემენტს, არის ლითონი თუ არალითონი.
მიუთითეთ ალუმინის პოზიცია პერიოდულ ცხრილში. მიეცით მისი ელექტრონული ფორმულა.
სიიდან აირჩიეთ ნივთიერებები, რომელთა მოლეკულები შეიცავს პოლარულ კოვალენტურ კავშირს:ო 3 , პ 2 ო 5 , პ 4 , ჰ 2 ᲘᲡᲔ 4 , CsF, HF, HNO 3 , ჰ 2 .
დაადგინეთ ქიმიური ბმის ტიპი და ჩამოწერეთ ნივთიერებების წარმოქმნის სქემა: H 2 ო, ნ 2 , ნა 3 ს.
განსაზღვრეთ თითოეული იზოტოპისთვის:
ტესტი "ქიმიური ელემენტების ატომები"
ვარიანტი 4
ფიგურაში ნაჩვენებია გარკვეული ქიმიური ელემენტის ატომის ელექტრონული სტრუქტურის მოდელი.

შემოთავაზებული მოდელის ანალიზის საფუძველზე შეასრულეთ შემდეგი ამოცანები:
1) იდენტიფიცირება ქიმიური ელემენტი, რომლის ატომს აქვს ასეთი ელექტრონული სტრუქტურა;
2) მიუთითეთ პერიოდის ნომერი და ჯგუფის ნომერი D.I. მენდელეევის ქიმიური ელემენტების პერიოდულ ცხრილში, რომელშიც მდებარეობს ეს ელემენტი;
3) დაადგინეთ, მარტივი ნივთიერება, რომელიც ქმნის ამ ქიმიურ ელემენტს, არის ლითონი თუ არალითონი.
მიუთითეთ ჟანგბადის მდებარეობა პერიოდულ ცხრილში. მიეცით მისი ელექტრონული ფორმულა.
3. ნივთიერებები, რომლებსაც აქვთ მხოლოდ იონური ბმები, ჩამოთვლილია შემდეგ სერიებში:
1) ფ 2 , SSლ 4 , კს1;
2) NaBr, Na 2 O, KI;
3) ასე 2 , პ 4 , CaF 2 ;
4) ჰ 2 ს, ძმ 2 , კ 2 ს.
4. დაადგინეთ ქიმიური ბმის ტიპი და დაწერეთ მისი წარმოქმნის სქემა ნივთიერებებისთვის: CaCl 2 , ო 2 , HF.
5. განსაზღვრეთ თითოეული იზოტოპისთვის:
ტესტი "ქიმიური ელემენტების ატომები"
ვარიანტი 5
ფიგურაში ნაჩვენებია გარკვეული ქიმიური ელემენტის ატომის ელექტრონული სტრუქტურის მოდელი.

შემოთავაზებული მოდელის ანალიზის საფუძველზე შეასრულეთ შემდეგი ამოცანები:
1) იდენტიფიცირება ქიმიური ელემენტი, რომლის ატომს აქვს ასეთი ელექტრონული სტრუქტურა;
2) მიუთითეთ პერიოდის ნომერი და ჯგუფის ნომერი D.I. მენდელეევის ქიმიური ელემენტების პერიოდულ ცხრილში, რომელშიც მდებარეობს ეს ელემენტი;
3) დაადგინეთ, მარტივი ნივთიერება, რომელიც ქმნის ამ ქიმიურ ელემენტს, არის ლითონი თუ არალითონი.
2. მიუთითეთ ნახშირბადის მდებარეობა პერიოდულ ცხრილში. მიეცით მისი ელექტრონული ფორმულა.
3. რომელ სერიაშია ყველა ნივთიერებას პოლარული კოვალენტური ბმა?
1) HCl, NaCl, Cl 2 ;
2) ო 2 , ჰ 2 O, CO 2 ;
3) ჰ 2 O, NH 3 , CH 4 ;
4) NaBr, HBr, CO.
4. დაადგინეთ ქიმიური ბმის ტიპი და ჩამოწერეთ ნივთიერებების წარმოქმნის სქემა: Li 2 ო, ს 2 , ნ.ჰ. 3 .
5. განსაზღვრეთ თითოეული იზოტოპისთვის:
"ქიმიური ბმების ძირითადი ტიპები" - მეტალის ბმა. კოვალენტური ბმის გაწყვეტის მექანიზმები. ელექტრონები. Na+Cl. იონური ქიმიური ბმა. ქიმიური ბმა. კომუნიკაციის პოლარობა. კოვალენტური ბმის პარამეტრები. გაჯერება. წყალბადის ბმა. კოვალენტური ბმის ფორმირების მექანიზმები. კოვალენტური ბმების თვისებები. კოვალენტური ბმების სახეები. ატომების ურთიერთქმედება ქიმიურ ნაერთებში.
„ჰიდროგენური ბმა“ - წყალბადის ბმა. 2) ამიაკის მოლეკულებს შორის. საგანი. მაღალი ტემპერატურა. ჩნდება მოლეკულებს შორის. ფაქტორები, რომლებიც ანადგურებენ წყალბადის ობლიგაციებს ცილის მოლეკულაში (დენატურული ფაქტორები). 2) ზოგიერთი ალკოჰოლი და მჟავა შეუზღუდავად იხსნება წყალში. 1) წყლის მოლეკულებს შორის. Ელექტრომაგნიტური რადიაცია. ინტრამოლეკულური წყალბადის ბმა.
"მეტალის ქიმიური ბმა" - მეტალის ბმას აქვს კოვალენტური ბმის მსგავსი თვისებები. ლითონის ქიმიური ბმა. ყველაზე დრეკადი არის ოქრო, სპილენძი და ვერცხლი. საუკეთესო გამტარებია სპილენძი და ვერცხლი. განსხვავებები მეტალის ბმებსა და იონურ და კოვალენტურ ბმებს შორის. მეტალის ბმა არის ქიმიური ბმა, რომელიც გამოწვეულია შედარებით თავისუფალი ელექტრონების არსებობით.
"ქიმია "ქიმიური ბმა" - ნივთიერებები კოვალენტური ბმებით. კოვალენტური ბმის პარამეტრები. Კოვალენტური ბმა. იონური კავშირი არის ელექტროსტატიკური მიზიდულობა იონებს შორის. ლითონები ქმნიან მეტალის ბროლის გისოსებს. გაზიარებული ელექტრონული წყვილების რაოდენობა უდრის ორ ატომს შორის არსებული ბმების რაოდენობას. წყალბადის ქიმიური ბმა. ქიმიური ბმების სახეები და ბროლის გისოსების ტიპები.
"კოვალენტური ბმა" - ბმის ფორმირების მეთოდები. A 3. ქიმიური ბმა. გოგირდის (IV) ოქსიდის მოლეკულაში არის ბმები 1) 1b და 1 P 2) 3b და 1 P 3) 4b 4) 2b და 2 P. ქიმიური ელემენტების ჟანგვის მდგომარეობა და ვალენტობა. ჟანგვის მდგომარეობა ნულის ტოლია ნაერთებში: 1) Ca3P2 2) O3 3) P4O6 4) CaO 12. ყველაზე მაღალი ჟანგვის მდგომარეობა ნაჩვენებია ნაერთში 1) SO3 2) Al2S3 3) H2S 4) NaHSO3 11.
"ქიმიური ბმა და მისი ტიპები" - პოლარული ბმა. ატომებს შორის ურთიერთქმედება. ცნების განმარტება. გადამოწმების სამუშაო. ქიმიური ბმების სახეები არაორგანულ ნივთიერებებში. კოვალენტური არაპოლარული ბმა. კომუნიკაციის ტიპების მახასიათებლები. გამარჯვების გზა. დაასრულეთ დავალება. იონური ბმა. კომუნიკაციის მახასიათებლების პარამეტრები. დამოუკიდებელი მუშაობა.
თემაში სულ 23 პრეზენტაციაა
 ქალაქის სოციალურ-პოლიტიკური გაზეთი Stary Oskol
ქალაქის სოციალურ-პოლიტიკური გაზეთი Stary Oskol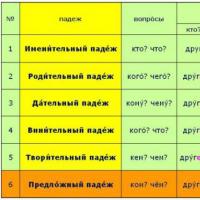 გაკვეთილი "არსებითი სახელის დაქვეითების სამი ტიპი" არსებითი სახელის დაქვეითების სახეები რუსულში
გაკვეთილი "არსებითი სახელის დაქვეითების სამი ტიპი" არსებითი სახელის დაქვეითების სახეები რუსულში მაქსველის თეორიის საფუძვლები ელექტრომაგნიტური ველისთვის მაქსველის ელექტრომაგნიტური ველი
მაქსველის თეორიის საფუძვლები ელექტრომაგნიტური ველისთვის მაქსველის ელექტრომაგნიტური ველი როგორ აღდგება ადამიანი ქალაქის რიგიდან მოხსნის შემდეგ საბინაო პირობების გაუმჯობესების რიგში?
როგორ აღდგება ადამიანი ქალაქის რიგიდან მოხსნის შემდეგ საბინაო პირობების გაუმჯობესების რიგში? ქმედებები სადაზღვევო შემთხვევის დადგომასთან დაკავშირებით MTPL სადაზღვევო MTPL სადაზღვევო მოვლენების ფარგლებში
ქმედებები სადაზღვევო შემთხვევის დადგომასთან დაკავშირებით MTPL სადაზღვევო MTPL სადაზღვევო მოვლენების ფარგლებში მე-4 კვარტლის ვადით დღგ-ს დღგ-ის გადახდის წესი და ვადები
მე-4 კვარტლის ვადით დღგ-ს დღგ-ის გადახდის წესი და ვადები Veloute Dubarry წვნიანი – Veloute Dubarry Dubarry სალათის რეცეპტი
Veloute Dubarry წვნიანი – Veloute Dubarry Dubarry სალათის რეცეპტი