Koji je znanstvenik uveo pojam valencije? Što je valencija? Elementi s konstantnom valencijom
Postoji nekoliko definicija pojma "valencije". Najčešće se ovaj pojam odnosi na sposobnost atoma jednog elementa da vežu određeni broj atoma drugih elemenata. Često oni koji tek počinju proučavati kemiju imaju pitanje: Kako odrediti valenciju elementa? To je lako učiniti ako znate nekoliko pravila.
Valencije konstantne i promjenjive
Razmotrimo spojeve HF, H2S i CaH2. U svakom od ovih primjera jedan atom vodika na sebe veže samo jedan atom drugog kemijskog elementa, što znači da mu je valencija jednaka jedinici. Vrijednost valencije ispisana je iznad simbola kemijskog elementa rimskim brojevima.
U navedenom primjeru, atom fluora je vezan samo na jedan monovalentni atom H, što znači da je njegova valencija također 1. Atom sumpora u H2S već veže dva atoma H na sebe, tako da je dvovalentan u ovom spoju. Kalcij u svom hidridu CaH2 također je vezan na dva atoma vodika, što znači da je njegova valencija dva.

 Kisik je u velikoj većini svojih spojeva dvovalentan, odnosno tvori dvije kemijske veze s drugim atomima.
Kisik je u velikoj većini svojih spojeva dvovalentan, odnosno tvori dvije kemijske veze s drugim atomima.
U prvom slučaju atom sumpora na sebe veže dva atoma kisika, odnosno tvori ukupno 4 kemijske veze (jedan kisik tvori dvije veze, što znači sumpor - dva puta 2), odnosno valencija mu je 4.
 U spoju SO3 sumpor već veže tri atoma O, stoga mu je valencija 6 (tri puta stvara dvije veze sa svakim atomom kisika). Atom kalcija veže samo jedan atom kisika, stvarajući s njim dvije veze, što znači da mu je valencija jednaka valenciji O, odnosno jednaka je 2.
U spoju SO3 sumpor već veže tri atoma O, stoga mu je valencija 6 (tri puta stvara dvije veze sa svakim atomom kisika). Atom kalcija veže samo jedan atom kisika, stvarajući s njim dvije veze, što znači da mu je valencija jednaka valenciji O, odnosno jednaka je 2.
Imajte na umu da je H atom jednovalentan u svakom spoju. Valencija kisika je uvijek (osim hidronijevog iona H3O(+)) jednaka 2. Kalcij stvara dvije kemijske veze s vodikom i kisikom. To su elementi s konstantnom valencijom. Osim već spomenutih, konstantnu valenciju imaju i:
- Li, Na, K, F - monovalentni;
- Be, Mg, Ca, Zn, Cd - imaju valenciju II;
- B, Al i Ga su trovalentni.
Atom sumpora, za razliku od razmatranih slučajeva, u kombinaciji s vodikom ima valenciju II, a s kisikom može biti četverovalentan ili šesterovalentan. Kaže se da atomi takvih elemenata imaju promjenjivu valenciju. Štoviše, njegova najveća vrijednost u većini slučajeva podudara se s brojem skupine u kojoj se element nalazi u periodnom sustavu (pravilo 1).
Postoje mnoge iznimke od ovog pravila. Dakle, element 1 skupine bakar pokazuje valencije i I i II. Željezo, kobalt, nikal, dušik, fluor, naprotiv, imaju najveću valenciju manju od broja grupe. Dakle, za Fe, Co, Ni to su II i III, za N - IV, a za fluor - I.
Minimalna vrijednost valencije uvijek odgovara razlici između broja 8 i broja grupe (pravilo 2).
Kolika je valencija elemenata za koje je ona promjenjiva, moguće je jednoznačno odrediti samo po formuli određene tvari.
Određivanje valencije u binarnom spoju
Razmotrimo kako odrediti valenciju elementa u binarnom (od dva elementa) spoju. Ovdje postoje dvije mogućnosti: u spoju je točno poznata valencija atoma jednog elementa ili obje čestice imaju promjenjivu valenciju.
Prvi slučaj:

Drugi slučaj:

Određivanje valencije pomoću čestične formule s tri elementa.
Ne sastoje se sve kemijske tvari od dvoatomnih molekula. Kako odrediti valenciju elementa u čestici od tri elementa? Razmotrimo ovo pitanje na primjeru formula dvaju spojeva K2Cr2O7.

Ako umjesto kalija formula sadrži željezo ili neki drugi element s promjenjivom valencijom, morat ćemo znati koja je valencija kiselinskog ostatka. Na primjer, trebate izračunati valencije atoma svih elemenata u kombinaciji s formulom FeSO4.

Treba napomenuti da se izraz "valencija" češće koristi u organskoj kemiji. Pri sastavljanju formula za anorganske spojeve često se koristi koncept "oksidacijskog stanja".
Na nastavi kemije već ste se upoznali s pojmom valencije kemijskih elemenata. Sve korisne informacije o ovoj temi prikupili smo na jednom mjestu. Koristite ga kada se pripremate za državni ispit i Jedinstveni državni ispit.
Valencija i kemijska analiza
Valencija– sposobnost atoma kemijskih elemenata da stupaju u kemijske spojeve s atomima drugih elemenata. Drugim riječima, to je sposobnost atoma da stvori određeni broj kemijskih veza s drugim atomima.
S latinskog se riječ "valencija" prevodi kao "snaga, sposobnost". Vrlo ispravno ime, zar ne?
Pojam "valencije" jedan je od osnovnih u kemiji. Uveden je čak i prije nego što su znanstvenici upoznali strukturu atoma (još 1853. godine). Stoga, dok smo proučavali strukturu atoma, ona je doživjela neke promjene.
Dakle, sa stajališta elektronske teorije, valencija je izravno povezana s brojem vanjskih elektrona atoma elementa. To znači da se "valencija" odnosi na broj elektronskih parova koje atom ima s drugim atomima.
Znajući to, znanstvenici su mogli opisati prirodu kemijske veze. Leži u činjenici da par atoma tvari dijeli par valentnih elektrona.
Možete se zapitati kako su kemičari 19. stoljeća mogli opisati valentnost čak i kada su vjerovali da ne postoje čestice manje od atoma? To ne znači da je bilo tako jednostavno – oslanjali su se na kemijsku analizu.
Kemijskim analizama znanstvenici prošlosti određivali su sastav kemijskog spoja: koliko atoma različitih elemenata sadrži molekula dotične tvari. Da bi se to postiglo, bilo je potrebno odrediti kolika je točna masa svakog elementa u uzorku čiste (bez nečistoća) tvari.
Istina, ova metoda nije bez nedostataka. Budući da se valencija elementa može tako odrediti samo u njegovoj jednostavnoj kombinaciji s uvijek jednovalentnim vodikom (hidrid) ili uvijek dvovalentnim kisikom (oksid). Na primjer, valencija dušika u NH 3 je III, jer je jedan atom vodika vezan na tri atoma dušika. I valencija ugljika u metanu (CH 4), prema istom principu, je IV.
Ova metoda za određivanje valencije prikladna je samo za jednostavne tvari. Ali u kiselinama na ovaj način možemo odrediti samo valenciju spojeva kao što su kiselinski ostaci, ali ne i svih elemenata (osim poznate valencije vodika) pojedinačno.
Kao što ste već primijetili, valencija je označena rimskim brojevima.
Valencija i kiseline
Budući da valencija vodika ostaje nepromijenjena i dobro vam je poznata, lako možete odrediti valenciju kiselinskog ostatka. Tako, na primjer, u H 2 SO 3 valencija SO 3 je I, u HClO 3 valencija ClO 3 je I.
Na sličan način, ako je poznata valencija kiselinskog ostatka, lako je napisati ispravnu formulu kiseline: NO 2 (I) - HNO 2, S 4 O 6 (II) - H 2 S 4 O 6.
Valencija i formule
Koncept valencije ima smisla samo za tvari molekularne prirode i nije baš prikladan za opisivanje kemijskih veza u spojevima klasterne, ionske, kristalne prirode itd.
Indeksi u molekulskim formulama tvari odražavaju broj atoma elemenata koji ih čine. Poznavanje valencije elemenata pomaže u ispravnom postavljanju indeksa. Na isti način, gledajući molekulsku formulu i indekse, možete odrediti valencije sastavnih elemenata.
Ovakve zadatke radite na satovima kemije u školi. Na primjer, ako imate kemijsku formulu tvari u kojoj je poznata valencija jednog od elemenata, lako možete odrediti valenciju drugog elementa.
Da biste to učinili, samo se trebate sjetiti da je u tvari molekularne prirode broj valencija oba elementa jednak. Stoga upotrijebite najmanji zajednički višekratnik (koji odgovara broju slobodnih valencija potrebnih za spoj) da odredite valenciju elementa koji vam nije poznat.
Da budemo jasniji, uzmimo formulu željeznog oksida Fe 2 O 3. Ovdje u stvaranju kemijske veze sudjeluju dva atoma željeza s valencijom III i 3 atoma kisika s valencijom II. Njihov najmanji zajednički višekratnik je 6.
- Primjer: imate formule Mn 2 O 7. Znate valenciju kisika, lako je izračunati da je najmanji zajednički višekratnik 14, dakle valencija Mn je VII.
Na sličan način možete učiniti suprotno: zapišite ispravnu kemijsku formulu tvari, znajući valencije njezinih elemenata.
- Primjer: da bismo pravilno napisali formulu fosfornog oksida, uzimamo u obzir valenciju kisika (II) i fosfora (V). To znači da je najmanji zajednički višekratnik za P i O 10. Stoga formula ima sljedeći oblik: P 2 O 5.
Poznavajući dobro svojstva elemenata koja oni pokazuju u raznim spojevima, moguće je već po izgledu takvih spojeva odrediti njihovu valenciju.
Na primjer: bakreni oksidi su crvene (Cu 2 O) i crne (CuO) boje. Bakreni hidroksidi obojeni su žuto (CuOH) i plavo (Cu(OH) 2).
Kako bi vam kovalentne veze u tvarima bile vizualnije i razumljivije, napišite njihove strukturne formule. Crte između elemenata predstavljaju veze (valenciju) koje nastaju između njihovih atoma:

Karakteristike valentnosti
Danas se određivanje valencije elemenata temelji na poznavanju strukture vanjskih elektronskih ljuski njihovih atoma.
Valencija može biti:
- konstanta (metali glavnih podskupina);
- varijabilni (nemetali i metali sekundarnih skupina):
- viša valencija;
- najniža valencija.
Sljedeće ostaje konstantno u različitim kemijskim spojevima:
- valencija vodika, natrija, kalija, fluora (I);
- valencija kisika, magnezija, kalcija, cinka (II);
- valencija aluminija (III).
Ali valencija željeza i bakra, broma i klora, kao i mnogih drugih elemenata mijenja se kada tvore različite kemijske spojeve.
Teorija valencije i elektrona
U okviru elektronske teorije, valencija atoma se određuje na temelju broja nesparenih elektrona koji sudjeluju u formiranju elektronskih parova s elektronima drugih atoma.
U stvaranju kemijskih veza sudjeluju samo elektroni smješteni u vanjskoj ljusci atoma. Stoga je najveća valencija kemijskog elementa broj elektrona u vanjskoj elektronskoj ljusci njegovog atoma.
Pojam valencije usko je povezan s periodičnim zakonom koji je otkrio D. I. Mendeljejev. Ako pažljivo pogledate periodni sustav, lako možete primijetiti: položaj elementa u periodnom sustavu i njegova valencija neraskidivo su povezani. Najveća valencija elemenata koji pripadaju istoj skupini odgovara rednom broju skupine u periodnom sustavu.
Najnižu valenciju saznat ćete kada od broja skupina u periodnom sustavu (ima ih osam) oduzmete broj skupine elementa koji vas zanima.
Na primjer, valencija mnogih metala podudara se s brojevima skupina u tablici periodičnih elemenata kojima pripadaju.
Tablica valencije kemijskih elemenata
|
Serijski broj kem. element (atomski broj) |
Ime |
Kemijski simbol |
Valencija |
| 1 | Vodik Helij Litij Berilijum Ugljik Dušik / dušik Kisik Fluor Neon / Neon Natrij/natrij Magnezij / magnezij Aluminij Silicij Fosfor / Fosfor Sumpor/Sumpor Klor Argon / Argon Kalij/Kalij Kalcij Skandij / Skandij Titanij Vanadij Krom / Krom Mangan / Mangan Željezo Kobalt nikal Bakar Cinkov Galij germanij Arsen/Arsen Selen Brom Kripton / Kripton Rubidij / Rubidij Stroncij / Stroncij Itrij / itrij Cirkonij / cirkonij Niobij / niobij Molibden Tehnecij / tehnecij Rutenij / rutenij Rodij paladij Srebro Kadmij Indij Lim/Kositer Antimon / Antimon Telur / Telur Jod / jod Xenon / Xenon cezij Barij / barij Lantan / Lantan Cerij Praseodim / Praseodim Neodimij / Neodimij Prometij / Prometij Samarij / Samarium Europij Gadolinij / Gadolinij Terbij / terbij Disprozij / Disprozij Holmij Erbij Tulij Iterbij / Iterbij Lutecij / Lutecij Hafnij / hafnij Tantal / tantal Volfram/Volfram Renij / Renij Osmij / osmij Iridij / Iridij Platina Zlato Merkur Talij / talij Voditi/Voditi Bizmut Polonij Astatin Radon / Radon francij Radij aktinij torij Proactinium / Protaktinij Uran / uran |
H | ja (I), II, III, IV, V I, (II), III, (IV), V, VII II, (III), IV, VI, VII II, III, (IV), VI (I), II, (III), (IV) I, (III), (IV), V (II), (III), IV (II), III, (IV), V (II), III, (IV), (V), VI (II), III, IV, (VI), (VII), VIII (II), (III), IV, (VI) I, (III), (IV), V, VII (II), (III), (IV), (V), VI (I), II, (III), IV, (V), VI, VII (II), III, IV, VI, VIII (I), (II), III, IV, VI (I), II, (III), IV, VI (II), III, (IV), (V) Nema podataka Nema podataka (II), III, IV, (V), VI |
One valencije koje elementi koji ih posjeduju rijetko pokazuju dane su u zagradama.
Valencija i oksidacijsko stanje
Dakle, govoreći o stupnju oksidacije, misli se da atom u tvari ionske (što je važno) prirode ima određeni konvencionalni naboj. A ako je valencija neutralna karakteristika, tada oksidacijsko stanje može biti negativno, pozitivno ili jednako nuli.
Zanimljivo je da atomu istog elementa, ovisno o elementima s kojima tvori kemijski spoj, valencija i oksidacijsko stanje mogu biti isti (H 2 O, CH 4 itd.) ili različiti (H 2 O 2, HNO3).
Zaključak
Produbljivanjem znanja o građi atoma dublje ćete i detaljnije učiti o valenciji. Ovaj opis kemijskih elemenata nije iscrpan. Ali ima veliki praktični značaj. Kao što ste i sami vidjeli više od jednom, rješavanje problema i provođenje kemijskih eksperimenata na vašim satovima.
Ovaj je članak osmišljen kako bi vam pomogao organizirati svoje znanje o valenciji. I podsjetiti vas kako se može odrediti i gdje se koristi valencija.
Nadamo se da će vam ovaj materijal biti od koristi u pripremi domaće zadaće i samostalnoj pripremi za kolokvije i ispite.
blog.site, pri kopiranju materijala u cijelosti ili djelomično, poveznica na izvorni izvor je obavezna.
Kemijska formula odražava sastav (strukturu) kemijskog spoja ili jednostavne tvari. Na primjer, H 2 O - dva atoma vodika povezana su s atomom kisika. Kemijske formule također sadrže neke informacije o strukturi tvari: na primjer, Fe(OH) 3, Al 2 (SO 4) 3 - ove formule označavaju neke stabilne skupine (OH, SO 4) koje su dio tvari - njezine molekula, formula ili strukturna jedinica (FU ili SE).
Molekularna formula označava broj atoma svakog elementa u molekuli. Molekularna formula opisuje samo tvari s molekularnom strukturom (plinovi, tekućine i neke krute tvari). Sastav tvari s atomskom ili ionskom strukturom može se opisati samo simbolima jedinica formule.
Formulske jedinice označavaju najjednostavniji odnos između broja atoma različitih elemenata u tvari. Na primjer, jedinica formule benzena je CH, molekulska formula je C6H6.
Strukturna (grafička) formula označava redoslijed povezanosti atoma u molekuli (kao i u PU i CE) te broj veza među atomima.
Razmatranje takvih formula dovelo je do ideje o valencija(valentia - snaga) - kao sposobnost atoma danog elementa da na sebe veže određeni broj drugih atoma. Mogu se razlikovati tri vrste valencije: stehiometrijska (uključujući oksidacijsko stanje), strukturna i elektronska.
Stehiometrijska valencija. Kvantitativni pristup određivanju valencije pokazao se mogućim nakon što je uspostavljen pojam "ekvivalent" i njegova definicija prema zakonu ekvivalenata. Na temelju ovih pojmova možemo uvesti ideju o stehiometrijska valencija je broj ekvivalenata koje određeni atom može spojiti na sebe, ili je broj ekvivalenata u atomu. Ekvivalenti su određeni brojem vodikovih atoma, tada V sh zapravo znači broj vodikovih atoma (ili njemu ekvivalentnih čestica) s kojima određeni atom stupa u interakciju.
V stx = Z B ili V stx = . (1.1)
Na primjer, u SO 3 ( S= +6), Z B (S) je jednako 6 V stx (S) = 6.
Ekvivalent vodika je 1, pa je za elemente u spojevima u nastavku Z B (Cl) = 1, Z B (O) = 2, Z B (N) = 3 i Z B (C) = 4. Brojčana vrijednost stehiometrijska valencija obično se označava rimskim brojevima:
I I I II III I IV I
HCl, H20, NH3, CH4.
U slučajevima kada se element ne spaja s vodikom, valencija traženog elementa određuje se iz elementa čija je valencija poznata. Najčešće se nalazi pomoću kisika, budući da je njegova valencija u spojevima obično jednaka dva. Na primjer, u vezama:
II II III II IV II
CaO Al 2 O 3 CO 2.
Pri određivanju stehiometrijske valencije elementa pomoću formule binarnog spoja treba imati na umu da ukupna valencija svih atoma jednog elementa mora biti jednaka ukupnoj valenciji svih atoma drugog elementa.
Poznavajući valenciju elemenata, možete stvoriti kemijsku formulu tvari. Prilikom sastavljanja kemijskih formula možete slijediti sljedeći postupak:
1. Uz kemijske simbole upiši elemente koji izgrađuju spoj: KO AlCl AlO ;
2. Njihova valencija naznačena je iznad simbola kemijskih elemenata:
I II III I III II
3. Pomoću gornjeg pravila odredite najmanji zajednički višekratnik brojeva koji izražavaju stehiometrijsku valenciju oba elementa (2, 3 i 6, redom).
Dijeljenjem najmanjeg zajedničkog višekratnika s valentnošću odgovarajućeg elementa dobivaju se indeksi:
I II III I III II
K 2 O AlCl 3 Al 2 O 3 .
Primjer 1. Napravite formulu za klor oksid, znajući da je klor u njemu sedmerovalentan, a kisik dvovalentan.
Riješenje. Nalazimo najmanji višekratnik brojeva 2 i 7 - jednak je 14. Podijelimo li najmanji zajednički višekratnik stehiometrijskom valencijom odgovarajućeg elementa, nalazimo indekse: za atome klora 14/7 = 2, za atome kisika 14 /2 = 7.
Formula oksida je -Cl 2 O 7.
Oksidacijsko stanje također karakterizira sastav tvari i jednaka je stehiometrijskoj valenciji s predznakom plus (za metal ili elektropozitivniji element u molekuli) ili minus.
= ±V stx. (1.2)
w je definiran kroz V stx, dakle kroz ekvivalent, a to znači da je w(H) = ±1; nadalje, w svih ostalih elemenata u raznim spojevima može se pronaći eksperimentalno. Posebno je važno da određeni broj elemenata uvijek ili gotovo uvijek ima stalna oksidacijska stanja.
Korisno je zapamtiti sljedeća pravila za određivanje oksidacijskih stanja.
1. w(H) = ±1 (. w = +1 u H 2 O, HCl; . w = –1 u NaH, CaH 2);
2. F(fluor) u svim spojevima ima w = –1, preostali halogeni s metalima, vodikom i drugim elektropozitivnijim elementima također imaju w = –1.
3. Kisik u običnim spojevima ima. w = –2 (izuzetak su vodikov peroksid i njegovi derivati – H 2 O 2 ili BaO 2, u kojima kisik ima oksidacijsko stanje –1, kao i kisikov fluorid OF 2, u kojem je oksidacijsko stanje kisika +2 ).
4. Alkalijski (Li – Fr) i zemnoalkalijski (Ca – Ra) metali uvijek imaju oksidacijsko stanje jednako broju skupine, odnosno +1, odnosno +2;
5. Al, Ga, In, Sc, Y, La i lantanidi (osim Ce) – w = +3.
6. Najviše oksidacijsko stanje elementa jednako je broju skupine periodnog sustava, a najniže = (broj skupine - 8). Na primjer, najveći w (S) = +6 u SO 3, najmanji w = -2 u H 2 S.
7. Pretpostavlja se da su oksidacijska stanja jednostavnih tvari nula.
8. Oksidacijska stanja iona jednaka su njihovim nabojima.
9. Oksidacijska stanja elemenata u spoju međusobno se poništavaju tako da je njihov zbroj za sve atome u molekuli ili jedinici neutralne formule jednak nuli, a za ion njegov naboj. To se može koristiti za određivanje nepoznatog oksidacijskog stanja od poznatih i stvaranje formula za višeelementne spojeve.
Primjer 2. Odredite stupanj oksidacije kroma u soli K 2 CrO 4 i u ionu Cr 2 O 7 2 - .
Riješenje. Prihvaćamo w(K) = +1; w(O) =-2. Za strukturnu jedinicu K 2 CrO 4 imamo:
2 . (+1) + X + 4 . (-2) = 0, stoga je X =w(Cr) = +6.
Za ion Cr 2 O 7 2 - imamo: 2 . X + 7 . (-2) = -2, X = w(Cr) = +6.
To jest, oksidacijsko stanje kroma je isto u oba slučaja.
Primjer 3. Odredite stupanj oksidacije fosfora u spojevima P 2 O 3 i PH 3.
Riješenje. U spoju P 2 O 3 w(O) = -2. Na temelju činjenice da algebarski zbroj oksidacijskih stanja molekule mora biti jednak nuli, nalazimo oksidacijsko stanje fosfora: 2. X + 3. (-2) = 0, stoga je X =w(P) = +3.
U spoju PH 3 w(H) = +1, stoga je X + 3.(+1) = 0. X =w(P) =-3.
Primjer 4. Napiši formule oksida koji se mogu dobiti toplinskom razgradnjom niže navedenih hidroksida:
H2Si03; Fe(OH)3; H3AsO4; H2WO4; Cu(OH)2.
Riješenje. H 2 SiO 3 - odredimo oksidacijsko stanje silicija: w(H) = +1, w(O) =-2, dakle: 2. (+1) + X + 3 . (-2) = 0.w(Si) = X = +4. Sastavljamo formulu oksida-SiO 2.
Fe(OH) 3 - naboj hidrokso skupine je -1, dakle w(Fe) = +3 i formula odgovarajućeg oksida je Fe 2 O 3.
H 3 AsO 4 - oksidacijsko stanje arsena u kiselini: 3. (+1) +X+ 4 . (-2) = 0.X=w(As) = +5. Dakle, formula oksida je As 2 O 5.
H 2 WO 4 -w(W) u kiselini je +6, pa je formula odgovarajućeg oksida WO 3.
Cu(OH) 2 - budući da postoje dvije hidrokso skupine, čiji je naboj -1, stoga je w(Cu) = +2 i formula oksida je -CuO.
Većina elemenata ima nekoliko oksidacijskih stupnjeva.
Razmotrimo kako, koristeći tablicu D.I. Mendeljejev može odrediti glavna oksidacijska stanja elemenata.
Stabilna oksidacijska stanja elementi glavnih podskupina može se odrediti prema sljedećim pravilima:
1. Elementi skupina I-III imaju samo jedno oksidacijsko stanje - pozitivno i jednako vrijednosti brojevima skupina (osim talija, koji ima w = +1 i +3).
Za elemente skupina IV-VI, osim pozitivnog oksidacijskog stanja koje odgovara broju skupine, i negativnog, jednakog razlici između broja 8 i broja skupine, postoje i srednja oksidacijska stanja, koja se obično razlikuju za 2. jedinice. Za skupinu IV, oksidacijska stanja su redom +4, +2, -2, -4; za elemente skupine V, odnosno -3, -1 +3 +5; a za skupinu VI - +6, +4, -2.
3. Elementi VII skupine imaju sva oksidacijska stanja od +7 do -1, razlikuju se za dvije jedinice, tj. +7, +5, +3, +1 i -1. U skupini halogena oslobađa se fluor koji nema pozitivna oksidacijska stanja i u spojevima s drugim elementima postoji samo u jednom oksidacijskom stupnju -1. (Postoji nekoliko halogenih spojeva s jednakim oksidacijskim stanjima: ClO, ClO 2 itd.)
Elementi bočne podskupine ne postoji jednostavan odnos između stabilnih oksidacijskih stanja i broja skupine. Za neke elemente sekundarnih podskupina treba jednostavno zapamtiti stabilna oksidacijska stanja. Ovi elementi uključuju:
Cr (+3 i +6), Mn (+7, +6, +4 i +2), Fe, Co i Ni (+3 i +2), Cu (+2 i +1), Ag (+1) ), Au (+3 i +1), Zn i Cd (+2), Hg (+2 i +1).
Za sastavljanje formula za tro- i višeelementne spojeve prema oksidacijskim stanjima potrebno je poznavati oksidacijska stanja svih elemenata. U ovom slučaju broj atoma elemenata u formuli određuje se iz uvjeta da je zbroj oksidacijskih stanja svih atoma jednak naboju jedinice formule (molekule, iona). Na primjer, ako je poznato da nenabijena jedinica formule sadrži atome K, Cr i O s oksidacijskim stanjima jednakim +1, +6 i -2, tada će ovaj uvjet biti zadovoljen formulama K 2 CrO 4, K 2 Cr 2 O 7, K 2 Cr 3 O 10 i mnogi drugi; slično, ovaj ion s nabojem -2 koji sadrži Cr +6 i O - 2 odgovarat će formulama CrO 4 2 -, Cr 2 O 7 2 -, Cr 3 O 10 2 -, Cr 4 O 13 2 - itd.

3. Elektronska valencija V  - broj kemijskih veza koje tvori određeni atom.
- broj kemijskih veza koje tvori određeni atom.
Na primjer, u molekuli H 2 O 2 H ¾ O
V stx (O) = 1, V c.h (O) = 2, V  .(O) = 2
.(O) = 2
To jest, postoje kemijski spojevi u kojima se stehiometrijske i elektronske valencije ne podudaraju; tu spadaju, na primjer, kompleksni spojevi.
O koordinaciji i elektronskim valencijama detaljnije se govori u temama “Kemijska veza” i “Kompleksni spojevi”.
Na nastavi kemije već ste se upoznali s pojmom valencije kemijskih elemenata. Sve korisne informacije o ovoj temi prikupili smo na jednom mjestu. Koristite ga kada se pripremate za državni ispit i Jedinstveni državni ispit.
Valencija i kemijska analiza
Valencija– sposobnost atoma kemijskih elemenata da stupaju u kemijske spojeve s atomima drugih elemenata. Drugim riječima, to je sposobnost atoma da stvori određeni broj kemijskih veza s drugim atomima.
S latinskog se riječ "valencija" prevodi kao "snaga, sposobnost". Vrlo ispravno ime, zar ne?
Pojam "valencije" jedan je od osnovnih u kemiji. Uveden je čak i prije nego što su znanstvenici upoznali strukturu atoma (još 1853. godine). Stoga, dok smo proučavali strukturu atoma, ona je doživjela neke promjene.
Dakle, sa stajališta elektronske teorije, valencija je izravno povezana s brojem vanjskih elektrona atoma elementa. To znači da se "valencija" odnosi na broj elektronskih parova koje atom ima s drugim atomima.
Znajući to, znanstvenici su mogli opisati prirodu kemijske veze. Leži u činjenici da par atoma tvari dijeli par valentnih elektrona.
Možete se zapitati kako su kemičari 19. stoljeća mogli opisati valentnost čak i kada su vjerovali da ne postoje čestice manje od atoma? To ne znači da je bilo tako jednostavno – oslanjali su se na kemijsku analizu.
Kemijskim analizama znanstvenici prošlosti određivali su sastav kemijskog spoja: koliko atoma različitih elemenata sadrži molekula dotične tvari. Da bi se to postiglo, bilo je potrebno odrediti kolika je točna masa svakog elementa u uzorku čiste (bez nečistoća) tvari.
Istina, ova metoda nije bez nedostataka. Budući da se valencija elementa može tako odrediti samo u njegovoj jednostavnoj kombinaciji s uvijek jednovalentnim vodikom (hidrid) ili uvijek dvovalentnim kisikom (oksid). Na primjer, valencija dušika u NH 3 je III, jer je jedan atom vodika vezan na tri atoma dušika. I valencija ugljika u metanu (CH 4), prema istom principu, je IV.
Ova metoda za određivanje valencije prikladna je samo za jednostavne tvari. Ali u kiselinama na ovaj način možemo odrediti samo valenciju spojeva kao što su kiselinski ostaci, ali ne i svih elemenata (osim poznate valencije vodika) pojedinačno.
Kao što ste već primijetili, valencija je označena rimskim brojevima.
Valencija i kiseline
Budući da valencija vodika ostaje nepromijenjena i dobro vam je poznata, lako možete odrediti valenciju kiselinskog ostatka. Tako, na primjer, u H 2 SO 3 valencija SO 3 je I, u HClO 3 valencija ClO 3 je I.
Na sličan način, ako je poznata valencija kiselinskog ostatka, lako je napisati ispravnu formulu kiseline: NO 2 (I) - HNO 2, S 4 O 6 (II) - H 2 S 4 O 6.
Valencija i formule
Koncept valencije ima smisla samo za tvari molekularne prirode i nije baš prikladan za opisivanje kemijskih veza u spojevima klasterne, ionske, kristalne prirode itd.
Indeksi u molekulskim formulama tvari odražavaju broj atoma elemenata koji ih čine. Poznavanje valencije elemenata pomaže u ispravnom postavljanju indeksa. Na isti način, gledajući molekulsku formulu i indekse, možete odrediti valencije sastavnih elemenata.
Ovakve zadatke radite na satovima kemije u školi. Na primjer, ako imate kemijsku formulu tvari u kojoj je poznata valencija jednog od elemenata, lako možete odrediti valenciju drugog elementa.
Da biste to učinili, samo se trebate sjetiti da je u tvari molekularne prirode broj valencija oba elementa jednak. Stoga upotrijebite najmanji zajednički višekratnik (koji odgovara broju slobodnih valencija potrebnih za spoj) da odredite valenciju elementa koji vam nije poznat.
Da budemo jasniji, uzmimo formulu željeznog oksida Fe 2 O 3. Ovdje u stvaranju kemijske veze sudjeluju dva atoma željeza s valencijom III i 3 atoma kisika s valencijom II. Njihov najmanji zajednički višekratnik je 6.
- Primjer: imate formule Mn 2 O 7. Znate valenciju kisika, lako je izračunati da je najmanji zajednički višekratnik 14, dakle valencija Mn je VII.
Na sličan način možete učiniti suprotno: zapišite ispravnu kemijsku formulu tvari, znajući valencije njezinih elemenata.
- Primjer: da bismo pravilno napisali formulu fosfornog oksida, uzimamo u obzir valenciju kisika (II) i fosfora (V). To znači da je najmanji zajednički višekratnik za P i O 10. Stoga formula ima sljedeći oblik: P 2 O 5.
Poznavajući dobro svojstva elemenata koja oni pokazuju u raznim spojevima, moguće je već po izgledu takvih spojeva odrediti njihovu valenciju.
Na primjer: bakreni oksidi su crvene (Cu 2 O) i crne (CuO) boje. Bakreni hidroksidi obojeni su žuto (CuOH) i plavo (Cu(OH) 2).
Kako bi vam kovalentne veze u tvarima bile vizualnije i razumljivije, napišite njihove strukturne formule. Crte između elemenata predstavljaju veze (valenciju) koje nastaju između njihovih atoma:

Karakteristike valentnosti
Danas se određivanje valencije elemenata temelji na poznavanju strukture vanjskih elektronskih ljuski njihovih atoma.
Valencija može biti:
- konstanta (metali glavnih podskupina);
- varijabilni (nemetali i metali sekundarnih skupina):
- viša valencija;
- najniža valencija.
Sljedeće ostaje konstantno u različitim kemijskim spojevima:
- valencija vodika, natrija, kalija, fluora (I);
- valencija kisika, magnezija, kalcija, cinka (II);
- valencija aluminija (III).
Ali valencija željeza i bakra, broma i klora, kao i mnogih drugih elemenata mijenja se kada tvore različite kemijske spojeve.
Teorija valencije i elektrona
U okviru elektronske teorije, valencija atoma se određuje na temelju broja nesparenih elektrona koji sudjeluju u formiranju elektronskih parova s elektronima drugih atoma.
U stvaranju kemijskih veza sudjeluju samo elektroni smješteni u vanjskoj ljusci atoma. Stoga je najveća valencija kemijskog elementa broj elektrona u vanjskoj elektronskoj ljusci njegovog atoma.
Pojam valencije usko je povezan s periodičnim zakonom koji je otkrio D. I. Mendeljejev. Ako pažljivo pogledate periodni sustav, lako možete primijetiti: položaj elementa u periodnom sustavu i njegova valencija neraskidivo su povezani. Najveća valencija elemenata koji pripadaju istoj skupini odgovara rednom broju skupine u periodnom sustavu.
Najnižu valenciju saznat ćete kada od broja skupina u periodnom sustavu (ima ih osam) oduzmete broj skupine elementa koji vas zanima.
Na primjer, valencija mnogih metala podudara se s brojevima skupina u tablici periodičnih elemenata kojima pripadaju.
Tablica valencije kemijskih elemenata
|
Serijski broj kem. element (atomski broj) |
Ime |
Kemijski simbol |
Valencija |
| 1 | Vodik Helij Litij Berilijum Ugljik Dušik / dušik Kisik Fluor Neon / Neon Natrij/natrij Magnezij / magnezij Aluminij Silicij Fosfor / Fosfor Sumpor/Sumpor Klor Argon / Argon Kalij/Kalij Kalcij Skandij / Skandij Titanij Vanadij Krom / Krom Mangan / Mangan Željezo Kobalt nikal Bakar Cinkov Galij germanij Arsen/Arsen Selen Brom Kripton / Kripton Rubidij / Rubidij Stroncij / Stroncij Itrij / itrij Cirkonij / cirkonij Niobij / niobij Molibden Tehnecij / tehnecij Rutenij / rutenij Rodij paladij Srebro Kadmij Indij Lim/Kositer Antimon / Antimon Telur / Telur Jod / jod Xenon / Xenon cezij Barij / barij Lantan / Lantan Cerij Praseodim / Praseodim Neodimij / Neodimij Prometij / Prometij Samarij / Samarium Europij Gadolinij / Gadolinij Terbij / terbij Disprozij / Disprozij Holmij Erbij Tulij Iterbij / Iterbij Lutecij / Lutecij Hafnij / hafnij Tantal / tantal Volfram/Volfram Renij / Renij Osmij / osmij Iridij / Iridij Platina Zlato Merkur Talij / talij Voditi/Voditi Bizmut Polonij Astatin Radon / Radon francij Radij aktinij torij Proactinium / Protaktinij Uran / uran |
H | ja (I), II, III, IV, V I, (II), III, (IV), V, VII II, (III), IV, VI, VII II, III, (IV), VI (I), II, (III), (IV) I, (III), (IV), V (II), (III), IV (II), III, (IV), V (II), III, (IV), (V), VI (II), III, IV, (VI), (VII), VIII (II), (III), IV, (VI) I, (III), (IV), V, VII (II), (III), (IV), (V), VI (I), II, (III), IV, (V), VI, VII (II), III, IV, VI, VIII (I), (II), III, IV, VI (I), II, (III), IV, VI (II), III, (IV), (V) Nema podataka Nema podataka (II), III, IV, (V), VI |
One valencije koje elementi koji ih posjeduju rijetko pokazuju dane su u zagradama.
Valencija i oksidacijsko stanje
Dakle, govoreći o stupnju oksidacije, misli se da atom u tvari ionske (što je važno) prirode ima određeni konvencionalni naboj. A ako je valencija neutralna karakteristika, tada oksidacijsko stanje može biti negativno, pozitivno ili jednako nuli.
Zanimljivo je da atomu istog elementa, ovisno o elementima s kojima tvori kemijski spoj, valencija i oksidacijsko stanje mogu biti isti (H 2 O, CH 4 itd.) ili različiti (H 2 O 2, HNO3).
Zaključak
Produbljivanjem znanja o građi atoma dublje ćete i detaljnije učiti o valenciji. Ovaj opis kemijskih elemenata nije iscrpan. Ali ima veliki praktični značaj. Kao što ste i sami vidjeli više od jednom, rješavanje problema i provođenje kemijskih eksperimenata na vašim satovima.
Ovaj je članak osmišljen kako bi vam pomogao organizirati svoje znanje o valenciji. I podsjetiti vas kako se može odrediti i gdje se koristi valencija.
Nadamo se da će vam ovaj materijal biti od koristi u pripremi domaće zadaće i samostalnoj pripremi za kolokvije i ispite.
web stranice, pri kopiranju materijala u cijelosti ili djelomično, poveznica na izvor je obavezna.
Valencija je sposobnost atoma da na sebe vežu određeni broj drugih atoma.
Jedan atom drugog jednovalentnog elementa spaja se s jednim atomom jednovalentnog elementa(HCl) . Atom dvovalentnog elementa spaja se s dva atoma jednovalentnog elementa.(H2O) ili jedan dvovalentni atom(CaO) . To znači da se valencija elementa može prikazati kao broj koji pokazuje s koliko atoma jednovalentnog elementa se atom danog elementa može spojiti. Valencija elementa je broj veza koje atom formira:
Na – monovalentna (jedna veza)
H – monovalentna (jedna veza)
O – dvovalentna (dvije veze za svaki atom)
S – heksavalentna (tvori šest veza sa susjednim atomima)
Pravila za određivanje valencije
elementi u vezama
1. Valencija vodik pogrešno za ja(jedinica). Zatim, u skladu s formulom vode H 2 O, dva atoma vodika su vezana za jedan atom kisika.
2. Kisik u svojim spojevima uvijek pokazuje valenciju II. Prema tome, ugljik u spoju CO 2 (ugljikov dioksid) ima valenciju IV.
3. Viša valencija jednak broj grupe .
4. Najniža valencija jednaka je razlici između broja 8 (broja grupa u tablici) i broja grupe u kojoj se taj element nalazi, tj. 8 - N skupine .
5. Za metale koji se nalaze u podskupini “A”, valencija je jednaka broju grupe.
6. Nemetali općenito pokazuju dvije valencije: višu i nižu.
Na primjer: sumpor ima najveću valenciju VI, a najnižu (8 – 6) jednaku II; fosfor pokazuje valencije V i III.
7. Valencija može biti konstantna ili promjenjiva.
Za sastavljanje kemijskih formula spojeva mora se znati valencija elemenata.
Algoritam za sastavljanje formule spoja fosfornog oksida
|
Sekvenciranje |
Formuliranje fosfornog oksida |
|
1. Napiši simbole elemenata |
R O |
|
2. Odrediti valencije elemenata |
V II |
|
3. Pronađite najmanji zajednički višekratnik brojčanih vrijednosti valencija |
5 2 = 10 |
|
4. Pronađite odnose među atomima elemenata dijeljenjem pronađenog najmanjeg višekratnika s odgovarajućim valencijama elemenata |
10: 5 = 2, 10: 2 = 5; P:O=2:5 |
|
5. Napišite indekse za simbole elemenata |
R 2 O 5 |
|
6. Formula spoja (oksida) |
R 2 O 5 |
Zapamtiti!
Značajke sastavljanja kemijskih formula spojeva.
1) Najnižu valenciju pokazuje element koji se nalazi desno i iznad u tablici D.I. Mendeljejeva, a najvišu valenciju pokazuje element koji se nalazi lijevo i ispod.
Na primjer, u kombinaciji s kisikom, sumpor pokazuje najveću valenciju VI, a kisik najnižu valenciju II. Dakle, formula za sumporni oksid će biti SO 3.
U spoju silicija s ugljikom, prvi pokazuje najveću valenciju IV, a drugi - najnižu IV. Dakle, formula
– SiC. Ovo je silicijev karbid, osnova vatrostalnih i abrazivnih materijala.
2) Atom metala je prvi u formuli.
2) U formulama spojeva atom nemetala s najnižom valencijom uvijek dolazi na drugo mjesto, a naziv takvog spoja završava na "id".
Na primjer,Sao – kalcijev oksid, NaCl - natrijev klorid, PbS – olovni sulfid.
Sada možete napisati formule za sve spojeve metala i nemetala.
 Gradske društveno-političke novine Stary Oskol
Gradske društveno-političke novine Stary Oskol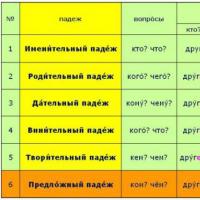 Lekcija "tri vrste deklinacije imenica" Vrste deklinacije imenica u ruskom
Lekcija "tri vrste deklinacije imenica" Vrste deklinacije imenica u ruskom Osnove Maxwellove teorije za elektromagnetsko polje Maxwellovo elektromagnetsko polje
Osnove Maxwellove teorije za elektromagnetsko polje Maxwellovo elektromagnetsko polje Kako se vratiti u red čekanja za poboljšanje stambenih uvjeta nakon brisanja iz gradskog reda?
Kako se vratiti u red čekanja za poboljšanje stambenih uvjeta nakon brisanja iz gradskog reda? Radnje pri nastanku osiguranog slučaja iz obveznog osiguranja motornih vozila osiguranje osiguranih slučajeva
Radnje pri nastanku osiguranog slučaja iz obveznog osiguranja motornih vozila osiguranje osiguranih slučajeva Postupak i rokovi plaćanja PDV-a PDV za 4. tromjesečje
Postupak i rokovi plaćanja PDV-a PDV za 4. tromjesečje Velouté Dubarry juha – Velouté Dubarry Dubarry recept za salatu
Velouté Dubarry juha – Velouté Dubarry Dubarry recept za salatu